Ринит: многообразие клинических проявлений
Многоликая аллергия. XII Международный конгресс «Современные проблемы иммунологии, аллергологии и иммунофармакологии»
- Аннотация
- Статья
- Ссылки







Согласно современной классификации, в зависимости от этиологии и патогенеза различают такие формы ринита, как инфекционный (острый и хронический), аллергический (интермиттирующий и круглогодичный), профессиональный, вазомоторный, неаллергический (медикаментозный, гормональный, рефлекторный, идиопатический), гипер- и атрофический. Профессор Светлана Вячеславовна МОРОЗОВА (д.м.н., кафедра болезней уха, горла и носа лечебного факультета ГБОУ ВПО «Первый Московский государственный медицинский университет им. И.М. Сеченова» Минздрава России) подчеркнула, что каждый из подтипов требует тщательного и специфического лечения, вне зависимости от тяжести течения заболевания. Дело в том, что назальная обструкция в результате нарушений слизистой оболочки полости носа создает условия для кислородного голодания. Это приводит к развитию гипоксии центральной нервной системы и внутренних органов, повышению кровяного, внутричерепного и внутриглазного давления. Кроме того, среднетяжелые и тяжелые формы ринита негативно влияют на дневную активность, нарушается сон, а следовательно, снижается качество жизни больных. Затруднения носового дыхания у детей первого года жизни приводят к раздражительности и беспокойству, нарушениям сна и отказу от груди. Кроме того, в силу некоторых анатомических особенностей у детей ринит часто осложняется острым средним отитом.
Наиболее распространенной формой ринита является острый инфекционный ринит. Так, в период эпидемии респираторных вирусных инфекций ежегодно заболевают до 6–8 человек из тысячи. Проявлениями ринита сопровождаются острые респираторные инфекции как вирусной (ОРВИ), так и бактериальной этиологии.
Лечение неосложненных форм ринита у взрослых, как правило, не вызывает затруднений. Классическая схема терапии этого заболевания включает промывание полости носа теплым физиологическим раствором, горячие ножные ванны и короткий курс сосудосуживающих препаратов. По мнению С.В. Морозовой, альтернативой деконгестантам может стать применение Супрастина.
Хорошо известный и врачам, и пациентам как блокатор Н1-гистаминовых рецепторов, Супрастин также является конкурентным антагонистом мускариновых рецепторов, оказывающих влияние на стимуляцию секреции желез и вазодилатацию. Прием Супрастина уменьшает выраженность чихания благодаря способности препарата проникать сквозь гематоэнцефалический барьер и влиять на рецепторные образования в центре чихания в продолговатом мозге. Супрастин обладает способностью снижать гиперреактивность терморегуляторного центра головного мозга, что позволяет уменьшить дозу жаропонижающих препаратов. Существуют данные о том, что применение Супрастина одновременно с парацетамолом позволяет снизить дозу последнего в 4 раза [1].
Назначение Супрастина при остром инфекционном рините целесообразно еще и потому, что препарат способствует обратному развитию симптомов и уменьшает продолжительность заболевания. По данным собственного исследования С.В. Морозовой, назначение Супрастина в острой фазе ринита позволяет существенно купировать симптомы и сразу перевести течение заболевания в третью фазу. При назначении препарата во второй фазе заболевания резко сокращается выраженность выделений из носа, заложенности носа и чихания [2]. Немаловажно также, что Супрастин может применяться и у пациентов с острым инфекционным ринитом, которым противопоказаны деконгестанты.
С инфекционным ринитом тесно связан аллергический ринит (АР) – интермиттирующее или персистирующее воспаление слизистой оболочки носа и его пазух, вызываемое причинно-значимым аллергеном. Доказано, что 10–12% случаев АР начинается с ОРВИ. Объясняется это, с одной стороны, способностью некоторых респираторных вирусов вызывать выработку иммуноглобулинов (Ig) класса E и потенцировать аллергический ответ, а с другой стороны, тем, что развивающееся на фоне ОРВИ повреждение слизистой оболочки носа само по себе способно усиливать симптомы АР.
Для подтверждения аллергической природы ринита необходимо провести лабораторное исследование (эозинофилия крови и носового секрета). Обязательным также является определение общего уровня IgE и аллергенспецифических антител в сыворотке (радиоаллергосорбентный и хемилюминесцентный тесты) и взятие кожных проб (прик-тесты, скарификационные и внутрикожные пробы).
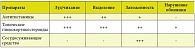
Лечение АР базируется на элиминационной терапии (специфической иммунотерапии, диетотерапии и др.), а также фармакотерапии, включающей, в зависимости от течения заболевания, разные группы препаратов (рис. 1). Чаще всего пациентам с АР назначаются топические глюкокортикостероиды, антигистаминные препараты и деконгестанты. Эффективность препаратов разных групп в отношении симптомов АР неодинакова (табл. 1). Ключевую роль в развитии проявлений аллергии играет гистамин – медиатор, запускающий реакцию клеточного иммунного ответа, воздействующий на рецепторы респираторной системы и стимулирующий воспаление. Он также усиливает секреторные процессы, идущие в слизистой оболочке носа и дыхательных путей, что приводит к возникновению аллергического ринита. Именно поэтому антигистаминные средства, воздействующие на большое количество проявлений АР, оказываются практически незаменимыми в терапии АР.
В клинической практике до сих пор успешно используются антигистаминные препараты I и II поколения, однако на сегодняшний день на рынке представлены современные антигистаминные средства III поколения (например, Супрастинекс). В отличие от препаратов I поколения они почти не оказывают седативного и холинолитического действия, не проникают через гематоэнцефалический барьер, не снижают умственной и физической активности и имеют большую продолжительность действия.
Действующее вещество Супрастинекса – левоцетиризин – является первым и пока единственным примером выделения активного изомера как самостоятельного противоаллергического лекарственного средства. Препараты на его основе зарегистрированы более чем в 80 странах мира. Управление по контролю качества пищевых продуктов и лекарственных препаратов США (Food and Drug Administration, FDA), разрешая выход препарата левоцетиризина на американский рынок, основывалось на результатах 8 рандомизированных плацебоконтролируемых исследований, в которых приняли участие в общей сложности более 2000 пациентов. В многочисленных исследованиях левоцетиризин продемонстрировал лучшую эффективность в отношении симптомов аллергии по сравнению с цетиризином, дезлоратадином, лоратадином или фексофенадином. Имеются также данные европейских исследований, доказавших, что Супрастинекс полностью биоэквивалентен оригинальному препарату левоцетиризина по всем основным фармакокинетическим характеристикам.
Левоцетиризин оказывает не только антигистаминное, но и противовоспалительное действие. Благодаря этому Супрастинекс эффективно устраняет как симптомы ранней фазы аллергического ответа (зуд, гиперемию, отек), так и проявления поздней стадии аллергии, аллергического воспаления. Для препарата характерно быстрое действие – у 50% больных эффект развивается уже через 12 минут после приема, а у 95% – в течение 1 часа. При этом прием Супрастинекса не сопровождается такими неприятными побочными эффектами, как сонливость, ощущение сухости во рту или тахикардия.
Супрастинекс выпускается в двух формах, таблетированной и жидкой, и может применяться как во взрослой, так и в детской практике. Препарат отличается чрезвычайно удобным режимом дозирования (как правило, он применяется 1 раз в сутки), что особенно важно для сохранения приверженности терапии длительными курсами. В исследованиях демонстрируется также очень хорошая переносимость препарата – он не вызывает побочных эффектов у 95% пациентов. Препарат может использоваться как для монотерапии, так и в составе комплексного лечения ринита различной этиологии.
Таким образом, антигистаминные препараты имеют важные преимущества в терапии АР. Их применение позволяет купировать такие симптомы, как отек, затруднение носового дыхания, гиперсекреция и ринорея, зуд и жжение в полости носа. Кроме того, антигистаминные препараты находят свое применение в комплексной терапии острого инфекционного ринита, подавляя симптомы и уменьшая продолжительность заболевания.
Противогрибковая терапия при атопическом дерматите: нужна ли она?
Атопический дерматит – многофакторное заболевание, возникающее у лиц с наследственной предрасположенностью, обусловленное сложными иммунными механизмами развития аллергического воспаления в органе-мишени – коже. Врач аллерголог-иммунолог Ольга Гурьевна ЕЛИСЮТИНА (к.м.н., ФГБУ «ГНЦ Институт иммунологии» ФМБА России) отметила, что единой точки зрения на первопричины заболевания не существует. По одним данным, причиной заболевания является дисбаланс иммунного ответа, в результате которого происходит гиперпродукция IgE и развитие сенсибилизации организма к различным аллергенам. По другим – атопический дерматит развивается в результате генетически детерминированного нарушения функции эпидермального барьера, а также структурных и функциональных изменений кожи. В любом случае нарушение защитной функции эпидермиса чревато повышенной проницаемостью кожного покрова и риском проникновения в организм аллергенов и инфекционных агентов. Среди вероятных причин грибковой и микробной колонизации кожи больных атопическим дерматитом выделяют дефект врожденного иммунного ответа, нарушение местного и общего иммунитета, изменение pH на поверхности кожи, изменение защитных свойств кожи, обусловленное нарушениями секреции сальных и потовых желез, и др.
Практически у каждого человека кожа, особенно верхней части тела, колонизирована грибами рода Malassezia (90%). На коже здорового человека в 22,8% случаев также определяются грибы Candida spp. Однако грибы рода Malassezia и Candida способны выступать не только в роли комменсалов, но и паразитов, вызывая специфический иммунный ответ у больных атопическим дерматитом. Так, Malassezia spp. при определенных условиях под влиянием эндогенных и экзогенных факторов могут переходить из дрожжевой в патогенную мицелиальную форму. Сходным диморфизмом обладают и грибы рода Candida. Антигены Malassezia spp. и Candida spp. провоцируют развитие IgE-опосредованной реакции. Кроме того, у пациентов наблюдается перекрестная реактивная активность между дрожжевыми грибами. Актуальность этой проблемы чрезвычайно высока: по разным данным, антитела к перечисленным грибам выделяются у 40–100% пациентов с атопическим дерматитом.
Качественный состав грибковой флоры, определяемой на коже больных атопическим дерматитом, зависит от локализации проявлений заболевания. Malassezia spp. обладают уникальным свойством – облигатной липофильностью, поэтому, как правило, поражают сальные железы. Если дерматит развился на волосистой части головы, высока вероятность того, что у пациента обнаружится патологический рост Malassezia spp. Если же заболевание развилось в областях кожных складок, оно чаще сопровождается кандидозом.
Наличие грибковой инфекции при атопическом дерматите изменяет клиническую картину заболевания, утяжеляет его течение и очень часто приводит к диагностическим ошибкам и назначению неадекватной терапии. Заподозрить наличие инфекции Candida spp. у пациентов, страдающих атопическим дерматитом, можно по следующим признакам:
- тяжелое непрерывное течение заболевания, сопровождающееся мокнутием и интенсивным зудом, несмотря на адекватно назначенную противовоспалительную терапию;
- отсутствие улучшения в летнее время года;
- связь обострений с употреблением в пищу продуктов, содержащих дрожжеподобные грибы и углеводы;
- поражение крупных складок кожи;
- вскрытие экссудативных элементов с образованием эрозий, содержащих белесоватый налет.
На присоединение Malassezia spp. указывают другие симптомы:
- локализация поражения в области богатых сальными железами участков кожи лица, воротниковой зоны, а также волосистой части головы и шеи;
- желтовато-красные шелушащиеся пятна и папулы различного размера, начинающиеся от устьев волосяных фолликулов, сливающиеся между собой;
- участки гипопигментации, чередующиеся с гиперпигментацией.
Диагностика грибковых инфекций проводится при помощи лампы Вуда. Используются также микроскопическое, бактериологическое и культуральное исследования, ПЦР-диагностика, определение специфических IgE-антител к антигенам Candida spp. и Malassezia spp., а также кожные скарификационные, внутрикожные и аппликационные тесты.
Лечение грибковой инфекции у пациентов с атопическим дерматитом включает диетотерапию, применение системных противогрибковых препаратов, пробиотиков, местных антимикотических и антисептических средств, препаратов цинка и средств по уходу за кожей. Существуют многочисленные исследования, демонстрирующие положительный эффект противогрибковой терапии. Так, в исследовании O. Bäck и соавт. продолжительная противогрибковая терапия позволила уменьшить тяжесть течения атопического дерматита, а также добиться снижения уровня IgE к антигенам грибов рода Candida и Malassezia [3]. В работе M. Tajima и соавт. противогрибковая терапия в 70% случаев улучшила состояние кожи пациентов и в 90% случаев позволила элиминировать Malassezia [4].
Однако противогрибковая терапия не включена в стандартную схему лечения атопического дерматита, так как применение системных антимикотиков сопряжено с рядом сложностей. Во-первых, элиминация дрожжевой микрофлоры увеличивает риск заражения патогенными микроорганизмами. Во-вторых, длительное системное применение антимикотиков может сопровождаться нежелательными реакциями. В-третьих, грибковая микрофлора при длительном использовании противогрибковых препаратов может сформировать к ним резистентность. Именно поэтому антимикотическая терапия с целью уменьшения контаминации кожи грибковой микрофлорой должна назначаться только при клинических проявлениях атопического дерматита, осложненных клинически значимой и лабораторно подтвержденной грибковой инфекцией.
Одним из наиболее перспективных противогрибковых средств является современный препарат Залаин на основе сертаконазола – антимикотика последнего поколения. Он обладает уникальным тройным механизмом действия. Повреждая мембрану гриба и нарушая механизмы его роста, сертаконазол способствует уменьшению численности популяций грибов. Кроме того, Залаин ингибирует трансформацию Candida albicans, препятствуя превращению дрожжевой формы в мицелиальную.
Фунгицидная активность Залаина в отношении Candida albicans превосходит таковую клотримазола, кетоконазола, миконазола и бифоназола [5], при этом препарат эффективен также в отношении возбудителей сопутствующей бактериальной инфекции.
Залаин хорошо переносится, на фоне его приема не развивается фотосенсибилизация, кроме того, для препарата не характерна системная абсорбция. Он может с успехом применяться у пациентов с атопическим дерматитом, страдающих от сопутствующего дерматоза.
В заключение докладчик подчеркнула, что противогрибковая терапия при атопическом дерматите, осложненном клинически значимой и лабораторно подтвержденной грибковой инфекцией, является рациональной. В таких случаях назначение антимикотиков позволяет значительно повысить эффективность лечения.
Крапивница и ангиоотек у детей: особенности диагностики и терапии
Вопросам диагностики и особенностям течения крапивницы у детей посвятил свой доклад профессор Александр Николаевич ПАМПУРА (д.м.н., заведующий отделением аллергологии и клинической иммунологии ФГБУ «Московский НИИ педиатрии и детской хирургии» Минздрава России). Поскольку существующая классификация крапивницы создавалась с учетом особенностей взрослых пациентов, в педиатрической практике она должна применяться с определенными ограничениями. То же можно сказать и о современных подходах к диагностике и лечению крапивницы. Так, механически перенесены из взрослой практики тесты с физическими воздействиями. Не удовлетворяют требованиям педиатра и критерии рецидивирующей крапивницы. У детей отличаются само течение заболевания и его прогноз, который в наибольшей степени зависит от этиологических факторов развития заболевания (рис. 2).
Диагноз острой крапивницы в педиатрии может быть поставлен только после исключения целого ряда патологий: контактной крапивницы, физической или особой (например, холинергической) крапивницы, сывороточной болезни, ангионевротического отека без уртикарий, аутовоспалительного синдрома и анафилаксии.
Далеко не всегда наличие волдыря (первичного элемента кожной сыпи, представляющего собой локальный отек сосочкового слоя дермы) является указанием на наличие крапивницы. В качестве примера А.Н. Пампура привел клинический случай Димы Б. (7 лет), который поступил в стационар с кожными высыпаниями, представленными в виде уртикарий и папулезных элементов, тяжелейшим зудом и нарушениями сна. Назначенная пациенту антигистаминная терапия оказалась неэффективной. После консультации дерматолога ребенку был поставлен диагноз «герпетиформный дерматит Дюринга». Диагноз был поставлен с учетом истинного полиморфизма высыпаний (наличие эритем, пузырьков, уртикароподобных элементов, эрозий и корок), наличия субэпидермальных пузырей и отложений IgA, повышения уровня эозинофилов в крови и, как уже упоминалось, отсутствия эффекта от антигистаминной терапии. Пациенту была рекомендована пожизненная безглютеновая диета, предполагающая также исключение продуктов и лекарств, содержащих йод, кроме того, ребенку был назначен препарат дапсон в дозировке 1 мг/кг/сут. Состояние пациента улучшилось практически сразу после коррекции рациона.
Основную сложность в данном клиническом случае представляла именно диагностика. Вообще, дифференциальная диагностика крапивницы нередко сопряжена с целым рядом затруднений, особенно если пациентом является ребенок младшего возраста. Для облегчения этой задачи можно воспользоваться, например, специальной таблицей (табл. 2). Если у ребенка наблюдаются кожные высыпания, не исчезающие после приема антигистаминных препаратов, скорее всего, речь идет не о крапивнице, а о каком-либо другом заболевании с кожной симптоматикой.
Заболеваемость острой крапивницей у детей характеризуется сезонностью: в зимний период она растет в связи с увеличением количества случаев инфицирования вирусами гриппа, парагриппа, респираторно-синцитиальным вирусом, аденовирусом и риновирусами, а в летнее время развитие крапивницы связано с повышением распространенности коксакивируса, коронавируса и аденовирусов. В лечении острой крапивницы используются антигистаминные препараты (в частности, Супрастин), глюкокортикостероиды (при наличии показаний) и диета с исключением продуктов, содержащих распространенные аллергены (яйца, рыба, морепродукты, орехи), а также продуктов с высокой концентрацией гистаминлибераторов.
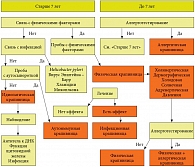
Для диагностики хронической крапивницы у детей докладчик рекомендовал придерживаться алгоритма (рис. 3). Вне зависимости от предполагаемых причин заболевания, диагностика должна проводиться по возможности быстро, поскольку зуд, сопровождающий крапивницу, существенно снижает качество жизни ребенка.
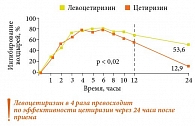
Для лечения хронической крапивницы наиболее рациональным является применение антигистаминных препаратов II поколения или комбинаций средств I и II поколения и сочетаний антигистаминных средств II поколения с антилейкотриеновыми препаратами. Эффективность лечения оценивается на 5-е сутки. Одним из самых действенных средств для лечения крапивницы считается антигистаминный препарат левоцетиризин, который в 4 раза превосходит по эффективности цетиризин (рис. 4). Помимо оригинального препарата на основе левоцетиризина для лечения крапивницы с успехом может применяться Супрастинекс, дженерик с доказанной биоэквивалентностью.
Обоснованность использования антигистаминных препаратов при атопическом дерматите
Согласно эпидемиологическим данным, которые привела профессор Елена Сергеевна ФЕДЕНКО (д.м.н., заведующая отделением аллергологии и иммунопатологии кожи ФГБУ «ГНЦ Институт иммунологии» ФМБА России), на сегодняшний день атопическим дерматитом страдают 15–30% детей и 2–10% взрослых. Всего в мире с этим заболеванием живут около 40–50 млн человек. Атопический дерматит нередко проявляется одновременно с пищевой аллергией, ее признаки наблюдаются у 40% детей со среднетяжелым и тяжелым атопическим дерматитом. На сегодняшний день общепризнанной является теория атопического марша, согласно которой эти два заболевания первыми развиваются у детей с генетической предрасположенностью к аллергии. В более позднем возрасте у таких детей также могут развиться сенная лихорадка или бронхиальная астма.
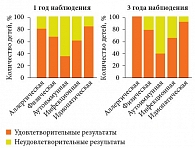
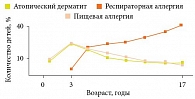
В свете вышесказанного становится ясно, какими проблемами чревата широко распространенная среди детей аллергия к белкам коровьего молока – ей страдают 0,5–1,5% младенцев, находящихся на грудном вскармливании, и 2–7% «искусственников». Среди детей первого года жизни, страдающих атопическим дерматитом, данная форма пищевой аллергии встречается в 85–90% случаев. У детей старше трех лет распространенность атопического дерматита и пищевой аллергии снижается, однако на смену ей приходят респираторные проявления аллергии (рис. 5) [6]. Если же у одного пациента наблюдается сочетание атопического дерматита, АР и бронхиальной астмы, это свидетельствует о дермато-респираторном синдроме или, в случае со взрослыми пациентами, о тяжелом атопическом синдроме.
Основной причиной развития атопии является генетическая предрасположенность. Всего на сегодняшний день открыто 37 генов, ассоциированных с атопическими заболеваниями. Последние исследования указывают на то, что нарушение функции эпидермального барьера связано с мутациями в гене, ответственном за синтез белка филаггрина. В результате этих мутаций экспрессия белка снижается, что облегчает проникновение аллергенов в кожу и способствует развитию сенсибилизации, а следовательно, появлению не только атопического дерматита, но и респираторной атопии. Нарушения работы иммунной системы у пациентов с атопией приводят к тому, что у одного и того же больного могут одновременно присутствовать очаги острого и хронического воспаления.
При атопическом дерматите наблюдается повышение содержания гистамина в коже, однако чувствительность к аппликациям или внутрикожному введению этого вещества снижена, что может свидетельствовать либо о нарушении плотности и аффинности Н1-рецепторов, либо о повышенном распаде гистамина в коже. Назначение антигистаминных препаратов таким пациентам обычно оказывается малоэффективным. Впрочем, это явление чаще наблюдается у взрослых больных, у которых в патогенезе атопического дерматита превалирует хроническое воспаление. В педиатрической практике патогенез атопического дерматита тесно связан с Th2-ответом, и применение антигистаминных препаратов, как правило, приводит к положительным результатам, особенно если речь идет об антигистаминных средствах последнего поколения, обладающих не только противоаллергическим, но и противовоспалительным эффектом.
На протяжении долгих лет пациентам с атопическим дерматитом назначались антигистаминные препараты I поколения, которые, оказывая седативный эффект, корректируют нарушенный из-за зуда сон. Однако использование более современных средств также способно повлиять на течение заболевания, например, предотвратить развитие или купировать респираторные проявления. Антигистаминные препараты могут применяться и как часть базисного лечения, и для купирования обострений, и в качестве премедикации перед проведением рентгеноконтрастных исследований и оперативных вмешательств. Кроме того, они широко используются у пациентов, получающих аллергенспецифическую иммунотерапию.
До недавнего времени в аллергологии применялся препарат цетиризин, показывавший хорошие результаты. Однако появление левоцетиризина вывело антигистаминную терапию на новый уровень. В левоцетиризине (Супрастинекс) отсутствует конкуренция за рецептор между неактивным правовращающим изомером и активным левовращающим, а длительность связывания цетиризина и левоцетиризна с рецепторами отличается приблизительно в 1,5 раза (95 и 142 минуты соответственно).
В ходе исследования эффективности левоцетиризина у детей 9–14 лет, страдающих атопическим дерматитом, было показано, что двухнедельный курс левоцетиризина уменьшает выраженность зуда, расчесов и мокнутия. После проведенной терапии было зафиксировано изменение числа эозинофилов, тогда как уровень нейтрофилов не изменился. Снизился процент CD4+ T-клеток, экспрессирующих интерлейкин (ИЛ) 5, и CD4+, экспрессирующих ИЛ-13, уровень же CD+, экспрессирующих ИЛ-10, напротив, повысился до нормальных значений [7]. «Это означает, что левоцетиризин позволяет контролировать аллергическое воспаление, следовательно, его применение у пациентов с атопическими заболеваниями обоснованно», – подчеркнула в завершение доклада профессор Е.С. Феденко.
Аллергия к насекомым: симптомы разные, подход один
Инсектная аллергия может развиваться при ужалениях или укусах взрослых особей представителей как минимум 13 отрядов насекомых. Однако, как отметила профессор Татьяна Германовна ФЕДОСКОВА (д.м.н., ФГБУ «ГНЦ Институт иммунологии» ФМБА РФ), укусы и ужаления насекомых представляют собой лишь один из возможных путей сенсибилизации к их антигенам. Полный список способов, которыми антигены насекомых проникают в человеческий организм, выглядит следующим образом:
- парентеральный – с ядом при ужалениях, а также с секретом слюнных желез при укусах кровососущих и кусающих насекомых;
- аэрогенный – при вдыхании частиц тел и продуктов жизнедеятельности насекомых;
- контактный – при соприкосновении кожи и слизистых с продуктами жизнедеятельности насекомых;
- алиментарный – через желудочно-кишечный тракт (при употреблении насекомых в пищу, а также при поедании продуктов, зараженных экскрементами насекомых, или приеме лекарственных средств, являющихся продуктом жизнедеятельности насекомых).
Инсектная аллергия может возникнуть и в отсутствие непосредственного контакта с насекомыми, например, при купании в водоемах со стоячей водой или вследствие употребления в пищу морепродуктов (ракообразных или моллюсков). На контакт с насекомыми и продуктами их жизнедеятельности организм человека может отреагировать патологическими реакциями нескольких типов:
- аллергические реакции гиперчувствительности немедленного (IgE-опосредованного), иммунокомплексного и замедленного типов;
- псевдоаллергические реакции;
- токсические реакции.
Истинная аллергия к жалящим насекомым встречается, по разным данным, у 0,4–8% популяции, к нежалящим – у 1,7–17,5%. Факторами риска развития истинной аллергии являются отягощенный аллергологический анамнез (сенсибилизация к аллергенам клещей домашней пыли, плесневых грибов, эпидермиса животных), место жительства, предполагающее повышенный риск контакта с насекомыми, род деятельности (пчеловоды, лесничие, егеря, работники инсектариев и др.). Вопросы предупреждения инсектной аллергии представляют собой серьезную проблему прежде всего потому, что контакт с насекомыми невозможно прогнозировать.
Клинические проявления инсектной аллергии чрезвычайно разнообразны. К местным формам аллергии на насекомых относятся папулезные, везикулезные или буллезные элементы, острая эритематозная реакция, отек с зоной гиперемии, воспаление с исходом в рубцевание, а также респираторные проявления – заложенность носа, ринорея и др. Среди системных проявлений инсектной аллергии выделяют такие опасные состояния, как ангионевротический отек и анафилактический шок, а также острую крапивницу и удушье. С риском для жизни может быть сопряжена даже местная аллергическая реакция на контакт с насекомым, если отек развился в полости рта или горла.
Для инсектной аллергии характерна сенсибилизация: при повторных укусах кровососущих насекомых аллергические реакции возникают также в местах более ранних укусов. Относится это и к системным проявлениям – все пациенты, перенесшие анафилактический шок в результате контакта с насекомым, оказываются в группе риска повторной тяжелой реакции на ужаление или укус.
Несмотря на огромное разнообразие клинических проявлений инсектной аллергии, а также факторов, способных спровоцировать ее развитие, врачебный подход к пациентам с гиперергической реакцией на ужаления и укусы насекомых должен быть единым. Таких пациентов необходимо направлять на консультацию к аллергологу для проведения аллергологического обследования и назначения соответствующей терапии.
Основными принципами терапии инсектной аллергии являются элиминация аллергенов, проведение профилактических мероприятий в группах риска, обучение пациентов и их родственников, а также фармакотерапия. Для устранения зуда у пациентов с инсектной аллергией профессор Т.Г. Федоскова рекомендовала назначать Супрастин, а для борьбы с проявлениями ранней фазы аллергического ответа и предотвращения развития поздней стадии – антигистамин последнего поколения – Супрастинекс. Немаловажно, что оба эти препарата могут применяться как у взрослых пациентов, так и в педиатрической практике. Как правило, Супрастин назначается в первые 1–2 недели обострения аллергического заболевания (при необходимости препарат вводится в инъекционной форме), а Супрастинекс – в период ремиссии, для ее поддержания. В целом инсектная аллергия успешно поддается терапии, и проведение адекватного лечения позволит не доводить случаи инсектной аллергии до тяжелых состояний.
Заключение
Лечение аллергических заболеваний подразумевает назначение препаратов разных фармакологических групп. Особое внимание докладчики уделили роли антигистаминных средств в терапии аллергического ринита, аллергического дерматита, крапивницы, инсектной аллергии. Целесообразность применения антигистаминных препаратов при различных аллергических заболеваниях определяется широким спектром эффектов гистамина. Этот медиатор может вызывать патофизиологические реакции со стороны разных органов и систем (дыхательных путей, кожи, желудочно-кишечного тракта, сердечно-сосудистой системы и др.). Таким образом, препараты, блокирующие гистаминовые рецепторы, эффективно предотвращают и купируют симптомы аллергии.
Свойства антигистаминных препаратов различаются в зависимости от того, к какому поколению принадлежит средство. Именно поэтому в одних случаях показан проверенный временем препарат первого поколения Супрастин, а в других – современное средство Супрастинекс на основе левоцетиризина. Оба эти препарата обладают доказанной эффективностью и безопасностью и по праву занимают свое место в схемах лечения аллергических заболеваний.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.