Модуляция кишечной микробиоты метформином
- Аннотация
- Статья
- Ссылки
- English
В статье представлен обзор современной литературы о влиянии пероральной сахароснижающей терапии, в частности метформина, на микробиоту кишечника. Метформин является препаратом первой линии и наиболее широко используется для лечения предиабета и сахарного диабета 2 типа. Он вызывает широкий спектр физиологических эффектов на метаболизм, однако механизм его действия до сих пор изучен недостаточно. Последние данные свидетельствуют о метформин-индуцированном изменении качественного состава микробиоты кишечника, в частности о повышении представленности бактерий рода Akkermansia spp. и уменьшении условно патогенной флоры. Препарат также влияет на синтез глюкагоноподобного пептида 1. Не исключено, что указанный эффект реализуется через модуляцию микробиоты кишечника и синтез бактериями короткоцепочечных жирных кислот. Поэтому представляется актуальным изучение влияния агонистов рецепторов глюкагоноподобного пептида 1 на микробиоту кишечника не только с целью коррекции метаболических нарушений, но и возможного улучшения ее качественного состава.
В статье представлен обзор современной литературы о влиянии пероральной сахароснижающей терапии, в частности метформина, на микробиоту кишечника. Метформин является препаратом первой линии и наиболее широко используется для лечения предиабета и сахарного диабета 2 типа. Он вызывает широкий спектр физиологических эффектов на метаболизм, однако механизм его действия до сих пор изучен недостаточно. Последние данные свидетельствуют о метформин-индуцированном изменении качественного состава микробиоты кишечника, в частности о повышении представленности бактерий рода Akkermansia spp. и уменьшении условно патогенной флоры. Препарат также влияет на синтез глюкагоноподобного пептида 1. Не исключено, что указанный эффект реализуется через модуляцию микробиоты кишечника и синтез бактериями короткоцепочечных жирных кислот. Поэтому представляется актуальным изучение влияния агонистов рецепторов глюкагоноподобного пептида 1 на микробиоту кишечника не только с целью коррекции метаболических нарушений, но и возможного улучшения ее качественного состава.


Введение
Учение о микроорганизмах, населяющих человеческий организм, насчитывает не одно столетие. Начало эвристического этапа ассоциируется с А. ван Левенгуком (XVIII в.), который обнаружил в организме человека и животных микроорганизмы. Следующий этап можно охарактеризовать как накопительный. Огромный вклад внесли И.И. Мечников, Л.Г. Перец, Л. Пастер, Р. Кох, Н.Ф. Гамалей и др. В этот период были обнаружены и идентифицированы микроорганизмы в разных органах человека, изучены их свойства и роль. 30–90-е гг. прошлого столетия – этап детализации. Благодаря современным микробиологическим методам исследования изучена не только роль отдельных представителей нормальной и патологической микрофлоры, но и обусловленные ими механизмы нарушения гомеостаза.
В конце ХХ – начале XXI в. сформировалось представление о микрофлоре как еще об одном органе человеческого организма.
Термин «микробиота» был введен Дж. Ледербергом [1].
В настоящее время под микробиотой понимают совокупность микроорганизмов, их генов и взаимоотношений внутри определенной среды с акцентом на их таксономическом составе.
Наибольшей плотностью и совокупной биомассой, а также значением для физиологии обладает микробиота кишечника (МК). Ее вес достигает 3–5 кг.
В просвете желудочно-кишечного тракта у здоровых лиц обитает более 1014 бактериальных клеток, что на порядок выше общего числа клеток организма [2]. Содержание симбиотических микроорганизмов в желудочно-кишечном тракте широко варьируется – от 102–103 КОЕ/г в желудке до 1012–1013 КОЕ/г в дистальных отделах толстой кишки.
Для идентификации микроорганизмов как в научных исследованиях, так и в рутинной клинико-лабораторной бактериологической практике используется ген 16S рРНК. Исследования последнего десятилетия, проведенные с помощью метагеномного анализа, показали, что у здоровых взрослых в МК доминируют представители пяти филумов (отделов) бактерий: грамположительные Firmicutes, Actinobacteria и грамотрицательные Bacteroidetes, Proteobacteria и Verrucomicrobia. До 90% приходится на Firmicutes и Bacteroidetes [3]. В здоровой МК Actinobacteria, Proteobacteria и Verrucomicrobia, как правило, представлены в меньшем количестве. Однако именно эти микроорганизмы оказывают значительное влияние на состояние макроорганизма.
Микробиота организма в целом и кишечника в частности является своеобразным индикатором макроорганизма – в зависимости от физиологических, диетических, климатических и географических факторов изменяется ее качественный и количественный состав.
Результаты многочисленных исследований продемонстрировали связь между качественными и количественными изменениями МК и синдромами, ассоциированными с неправильным питанием. Речь, в частности, идет об ожирении, метаболическом синдроме, сахарном диабете (СД) 2 типа, атеросклерозе [2, 4–6]. При ожирении и СД 2 типа отмечено уменьшение численности Bacteroidetes и увеличение количества Firmicutes [7, 8].
Приходится констатировать, что на сегодняшний день относительно хорошо изучены механизмы морфологических и функциональных изменений при метаболическом синдроме, недостаточно – вклад в его этиологию и патогенез МК. Кроме того, нет единого мнения о том, что представляет собой «типичная» микробиота при метаболическом синдроме.
Сказанное выше обусловливает актуальность изучения препаратов, направленных на коррекцию метаболических нарушений, на предмет их воздействия через модуляцию микробиоты, что может положительно повлиять и на макроорганизм.
В статье будут подробно рассмотрены эффекты метформина.
Влияние на численность и состав микробиоты кишечника
Метформин (МЕТ) вызывает широкий спектр физиологических эффектов, однако механизм его действия до сих пор изучен недостаточно.
У человека и животных МЕТ абсорбируется и накапливается преимущественно в кишечнике. Установлено, что его содержание в тонкой кишке во много раз превышает таковое в плазме и других тканях [9]. Именно этим объясняется развитие побочных эффектов со стороны желудочно-кишечного тракта при приеме препарата. Внутривенное применение МЕТ в отличие от перорального не улучшает гликемию [10].
Метформин влияет на активность генов, регулирующих метаболизм ксенобиотиков, клеточный стресс, энергетический обмен, биосинтез, передачу сигналов и т.д. Их экспрессия меняется также при снижении энергетической ценности пищи [11]. У нематод Caenorhabditis elegans МЕТ воздействует на метаболизм метионина и фолата (как антифолатный препарат) бактерий-симбионтов и замедляет процесс старения в присутствии Escherichia coli. Фолатный цикл признан ключевым регулятором клеточного метаболизма и интегратором нутриентного статуса, поэтому назначение МЕТ имитирует эффект ограничения калорийности питания. У человека МЕТ также приводит к дефициту фолата и витамина В12 и повышению уровня гомоцистеина. Кроме того, препарат действует как прямой метаболический стрессор [12].
В исследовании K. Forslund и соавт., в котором участвовали 784 пациента с СД 2 типа, в группе МЕТ по сравнению с контрольной группой отмечалось обилие бактерий Subdoligranulum и Akkermansia. Таким образом, терапия препаратом ассоциировалась с более здоровым составом микробиоты кишечника [13]. У получавших его наблюдалось более высокое содержание Adlercreutsia [14].
Функциональный анализ продемонстрировал значительное увеличение синтеза короткоцепочечных жирных кислот, таких как бутират и пропионат [13]. У пациентов с СД 2 типа, не получавших МЕТ, повысилась численность Eubacterium и Clostridiaceae SMB53 [14] и сократилось количество бактерий, продуцирующих короткоцепочечные жирные кислоты (Roseburia, Subdoligranulum), и кластера бутират-продуцирующих Clostridiales [13]. Это доказывает влияние микробиоты на антидиабетический эффект МЕТ через деградацию муцина и синтез короткоцепочечных жирных кислот. F.H. Karlsson и соавт. установили связь между приемом МЕТ и повышением количества энтеробактерий (Escherichia, Shigella, Klebsiella и Salmonella), а также снижением числа Clostridium и Eubacterium у пациентов с СД 2 типа [15].
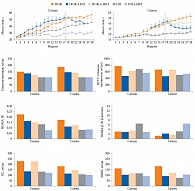
В 2014 г. изучено влияние диетотерапии и МЕТ на метаболические показатели. Шестинедельные мыши в течение 28 недель находились на диете с повышенным содержанием жиров (ПСЖ) [16]. Их разделили на несколько групп: первая – диета с ПСЖ с переходом в дальнейшем на МЕТ (300 мг/кг) в течение десяти недель, вторая – диета с ПСЖ, третья – диета с ПСЖ с переходом на нормальное питание (НП) в течение десяти недель, четвертая – НП, пятая – НП с переходом в дальнейшем на МЕТ в течение десяти недель.
В группе диеты с ПСЖ наблюдалось увеличение массы тела, уровня глюкозы натощак и нарушение толерантности к глюкозе (НТГ) при проведении перорального глюкозотолерантного теста (ПГТТ), а также снижение инсулинорезистентности тканей (HOMA-IR), нарушение функции β-клеток (HOMA-β) и липидного обмена (рис. 1). В группе ПСЖ и МЕТ масса тела после добавления препарата не увеличивалась, несмотря на продолжение диеты. Отмечалось снижение гликемии, особенно у самок, и HOMA-IR. Однако существенного влияния метформина на НТГ и функцию β-клеток не зарегистрировано. Эффект МЕТ на уровень общего холестерина (ХС) различался в зависимости от пола – значительное снижение у самок (р = 0,023). Терапия МЕТ также способствовала уменьшению уровня липопротеинов высокой плотности (ЛПВП). В группе ПСЖ и НП выявлено значительное снижение массы тела, уровня глюкозы натощак, улучшение НТГ, уменьшение концентрации ХС, ЛПВП и резистентности к инсулину. Однако переход на НП, так же как терапия метформином, не оказал существенного влияния на показатели HOMA-β. В группе НП не было выявлено никаких метаболических нарушений, в группе НП и МЕТ добавление препарата не повлияло на уровень метаболических биомаркеров (см. рис. 1).
Помимо метаболических маркеров в работе изучался состав МК. В группе ПСЖ отмечалось уменьшение количества Bacteroidetes до 43,79 ± 22,35% и увеличение численности Firmicutes до 50,73 ± 19,2%. В группе НП, наоборот, количество Bacteroidetes увеличилось до 79,4 ± 10,0%. В группе ПСЖ и МЕТ после добавления препарата численность Bacteroidetes повысилась до 77,45 ± 8,73%. Кроме того, возросло количество Verrucomicrobia до 12,4 ± 5,26%, Akkermansia muciniphila до 12,4 ± 5,26% и Clostridium cocleatum до 0,1 ± 0,09% в отличие от группы ПСЖ и группы ПСЖ и НП. Прием МЕТ также повлиял на состав микробиоты мышей, получавших НП. Численность семейств Rikenellaceae, Ruminococcaceae и Verrucomicrobiaceae, а также Alistipes spp., Akkermansia spp. и Clostridium spp. в группе НП и МЕТ была выше, чем в группе НП.
В исследовании выявлены особенности состава МК в зависимости от гендерной принадлежности. Так, в группе ПСЖ численность Bacteroidetes оказалась выше у самок, в группе ПСЖ и НП количество Tenericutes было больше у самцов, в группе НП – Parabacteroides spp. – у самок, в группе ПСЖ и МЕТ – Coprobacillus spp. – у самцов, а Clostridium spp., Bacteroides spp., семейства Lactobacillaceae, класса Bacteroidia – у самок. Различий в составе МК между самцами и самками в группе НП и МЕТ не обнаружено (рис. 2).
В другом экспериментальном исследовании на мышах выявлено, что МЕТ влияет на представленность бактерии A. muciniphila и улучшает гликемический контроль. На фоне терапии также увеличилось количество бокаловидных клеток, производящих муцин. Последний является источником питания для Akkermansia [17].
В 2016 г. проанализированы численность и состав МК у 112 колумбийских женщин [18]. 84 из них не страдали СД 2 типа (БСД). Среди пациенток с СД 2 типа 14 принимали МЕТ (МЕТ+), 14 – нет (MЕТ-). В группе СД 2 типа и МЕТ- одна участница исследования находилась на инсулине, две – на глибенкламиде, 11 ранее не получали медикаментозного лечения.
Статистически значимых различий по демографическому, антропометрическим, клиническим параметрам между группами не выявлено.
В отличие от группы БСД группа СД 2 типа и МЕТ+ имела более высокие показатели гликемии натощак, гликированного гемоглобина (HbA1c) и HOMA-IR, а также более низкий уровень инсулин-сенсибилизирующего гормона адипонектина (р < 0,05).
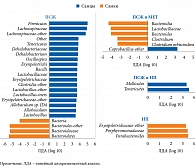
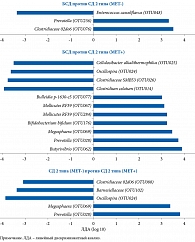
После проведения секвенирования гена 16S рРНК обнаружена связь между СД, составом и численностью МК, которая была модифицирована на фоне терапии МЕТ (рис. 3 и 4).
Сравнительный анализ между группами СД 2 типа и МЕТ- и БСД выявил, что бактерии, относящиеся к группе Clostridiaceae (Firmicutes/Clostridiaceae) и Prevotella (Bacteroidetes/Prevotellaceae), больше представлены у пациентов с СД 2 типа, не получавших МЕТ, тогда как Enterococcus casseliflavus (Firmicutes/Enterococcaceae) – у пациентов без СД. Сравнительный анализ групп СД 2 типа и МЕТ+ и БСД показал, что бактерии Butyrivibrio (Firmicutes/Lachnospiraceae), а также разные таксономические группы Prevotella (Bacteroidetes/Prevotellaceae), Megasphaera (Firmicutes/Veillonellaceae), Bifidobacterium bifidum (Actinobacteria/Bifidobacteriaceae), в том числе две таксономические группы Mollicutes (Tenericutes) и Bulleidia p-1630-c5 (Firmicutes/Erysipelotrichaceae), в большей степени представлены в первой группе. В группе пациентов, не страдавших СД 2 типа, более распространенными были группы Clostridiales, включая Clostridiumcelatum (Firmicutes/Clostridiaceae), Clostridiaceae SMB53 (Firmicutes/Clostridiaceae), Oscillospira (Firmicutes/Ruminococcaceae) и Cellulosibacter alkalithermophilus (Firmicutes/Ruminococcaceae). Численность Prevotella (Bacteroidetes/Prevotellaceae) и Megasphaera (Firmicutes/Veillonellaceae) в группе СД 2 типа и получавших МЕТ оказалась выше, чем в группе СД 2 типа и не принимавших препарат, тогда как Oscillosira (Firmicutes/Ruminococcaceae), Barnesiellaceae (Bacteroidetes), Clostridiaceae 02d06 (Firmicutes/Clostridiaceae) – в последней.
После объединения муцин-деградирующих и бутират-продуцирующих бактерий обнаружено, что в группе пациентов с СД 2 типа, принимавших МЕТ, численность бактерий А. muciniphila и Butyrivibrio была выше, чем в группе, не получавшей указанный препарат, – в 3,4 и 4,4 раза соответственно. Различия были статистически значимыми для A. muciniphila (F1, 109 = 9,46, p = 0,003, q = 0,01), но не для Butyrivibrio (F1, 109 = 3,03, p = 0,08, q = 0,21) (см. рис. 4Ж и З). Других существенных различий в группах бутират-синтезирующих бактерий МК больных СД 2 типа, принимавших и не принимавших МЕТ, не выявлено. Для Roseburia – F1, 109 = 1,44 (p = 0,23, q = 0,39), Subdoligranulum – F1, 109 = 0,001 (p = 0,97, q = 0,97), Faecalibacterium – F1, 109 = 0,53 (p = 0,47, q = 0,59). Существенных различий в отношении этих бактерий при сравнении МК пациентов с СД 2 типа и без такового не отмечено (все значения p > 0,1 и q > 0,2).
В 2017 г. H. Wu и соавт. [19] провели первое двойное слепое рандомизированное исследование по оценке эффектов метформина на МК у пациентов с СД 2 типа. В исследование включено 40 пациентов с впервые выявленной патологией. Участников рандомизировали на две группы: первая (n = 22) получала МЕТ 1700 мг/сут, вторая (n = 18) – плацебо. Длительность терапии – четыре месяца.
Пациенты обеих групп находились на диете с ограничением калорийности.
Через шесть месяцев от начала наблюдения часть пациентов группы плацебо была переведена на МЕТ.
Как и ожидалось, за четыре месяца в результате снижения калорийности пищи масса тела значительно уменьшилась как в группе плацебо (с 85,4 ± 5,6 до 81,5 ± 5,4 кг), так и в группе МЕТ (с 96,5 ± 4,1 до 91,4 ± 3,9 кг). В группе плацебо не отмечалось снижения уровня гликемии натощак и HbA1c, однако фиксировалось значительное уменьшение уровня общего ХС (р < 0,05), липопротеинов низкой плотности (р < 0,05) и гамма-глутамилтрансферазы (р < 0,01). В группе МЕТ наблюдалось значительное снижение уровня HbA1c, гликемии натощак, HOMA-IR (р < 0,05), уровня гамма-глутамилтрансферазы (р < 0,05) и увеличение ЛПВП (р < 0,05).
Индекс массы тела (ИМТ) не уменьшился в подгруппе плацебо, которая через шесть месяцев была переведена на МЕТ, однако уровни HbA1c и гликемии натощак в ней достоверно снизились (рис. 5).
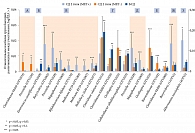
Метагеномный анализ с помощью секвенирования гена 16S рРНК показал, что терапия МЕТ значительно увеличивает представительство бактерий Escherichia coli, Bifidobacterium adolescentis (р = 0,01) и A. muciniphila (р = 0,008), при этом снижает количество Intestinibacter (рис. 6). Исследователи также обнаружили, что метформин in vitro способствует увеличению количества B. adolescentis и A. muciniphila. Достоверных корреляций между уровнем HbA1c и A. muciniphila выявлено не было, следовательно, нельзя сделать вывод о том, что A. muciniphila является основным фактором положительного влияния МЕТ.
H. Wu и соавт. также провели трансплантацию МК пациентов, получавших МЕТ, стерильным мышам. После нее у мышей улучшилась толерантность к глюкозе. Масса тела, жировые отложения и концентрация инсулина не изменились.
Эффект на глюкагоноподобный пептид 1
Гомеостаз макроорганизма поддерживается благодаря продукции разнообразных микробных соединений, которые регулируют скорость и выраженность физиологических функций, метаболических и поведенческих реакций.
Полифункциональная роль принадлежит короткоцепочечным жирным кислотам. Основную их массу составляют уксусная (ацетат), пропионовая (пропионат), изомасляная, масляная (бутират), изовалериановая, валериановая (валерат), изокапроновая и капроновая (гексанат) кислоты. Они образуются в толстой кишке путем ферментации углеводов, жиров и белков. Бутират – основной источник энергии аденозинтрифосфата. Ацетат и пропионат в гепатоцитах участвуют в глюконеогенезе и липогенезе [20].
В 2014 г. проведено исследование на крысах, подтвердившее, что бутират напрямую активирует экспрессию генов, задействованных в глюконеогенезе в клетках кишечника, посредством циклического аденозинмонофосфат-зависимого механизма, в то время как пропионат – через взаимодействие с рецепторами свободных жирных кислот 3 (FFAR3), расположенными в клетках нервной системы. Следовательно, короткоцепочечные жирные кислоты влияют на углеводный обмен через регулирование глюконеогенеза в клетках кишечника [21].
В 1987 г. был открыт человеческий глюкагоноподобный пептид 1 (ГПП-1), который состоит из 30 аминокислотных остатков, представлен двумя биологически активными формами – ГПП-1-(7-37) и ГПП-1-(7-36)NH2 (80% всего пула ГПП-1), синтезируется L-клетками, локализованными преимущественно в слизистой оболочке дистального отдела тонкой кишки, а также толстой кишки.
В норме синтез основных инкретинов – гастроингибирующего пептида и ГПП-1 происходит в ответ на поступление пищи или глюкозы в кишечник. Основными эффектами ГПП-1 считаются стимуляция глюкозозависимой секреции инсулина, увеличение массы β-клеток поджелудочной железы, ингибирование высвобождения глюкагона, опорожнение желудка и снижение аппетита.
Установлено, что секреция ГПП-1 обусловлена взаимодействием короткоцепочечных жирных кислот с рецепторами, связанными с G-белками свободных жирных кислот 2 и 3 (GPR41 (FFAR3) и GPR43 (FFAR2)) [22]. FFAR2 обеспечивает сохранение энергии за счет стимуляции липогенеза, ингибирование липолиза и уменьшение расхода энергии. В толстой кишке FFAR2 и FFAR3 регулируют перистальтику кишечника и насыщение через ГПП-1.
В исследовании H. Lin и соавт., проведенном в 2012 г. [22], установлено, что короткоцепочечные жирные кислоты, введенные мышам, влияют на синтез кишечных гормонов через рецепторы FFAR2 и FFAR3, защищая от индуцированного диетой ожирения и инсулинорезистентности.
Установлено, что бутират и пропионат стимулируют выработку кишечных гормонов и сокращают общее насыщение независимо от FFAR3. Эти данные указывают на новый механизм влияния МК на метаболизм макроорганизма.
В 2014 г. выдвинута теория о прямой связи бактерий Bifidobacterium с синтезом ГПП-1 [23]. Следовательно, если в кишечнике уменьшается численность Bifidobacterium, снижается количество ГПП-1.
Аналогичным образом на синтез ГПП-1 влияет Lactobacillus. В экспериментальном исследовании F. Duan и соавт. [24] применение пробиотика типа Lactobacillus, штаммы которого являются существенной частью здоровой МК, у крыс с СД в течение 90 дней привело к снижению уровня гликемии на 30% больше, чем у крыс с диабетом, не получавших пробиотика.
В 1998 г., еще до открытия влияния бактерий на синтез ГПП-1, R. Lugari и соавт. обнаружили, что у пациентов с СД 2 типа применение МЕТ способствует повышению концентрации постпрандиального уровня ГПП-1 [25]. В дальнейшем указанный эффект был подтвержден в многочисленных клинических исследованиях [26–28].
В 2001 и 2004 гг. E. Mannucci и соавт. [26, 27] изучали эффекты МЕТ на концентрацию ГПП-1 и лептина у пациентов с ожирением. В исследование 2001 г. были включены 20 пациентов с ожирением (ИМТ > 30,0 кг/м2) без СД 2 типа. Участников рандомизировали на две группы, одна из которых принимала МЕТ 2550 мг/сут (по 850 мг три раза в день) в течение 14 дней.
Исходно и на 15-й день исследования оценивали уровень ГПП-1 и лептина до и после ПГТТ. Для исключения метформин-индуцированных изменений уровня гликемии и инсулинемии ПГТТ проводился на фоне эугликемического гиперинсулинемического клэмп-теста.
На 15-й день исследования при проведении ПГТТ в группе МЕТ зафиксировано значительное (р < 0,05) увеличение концентрации циркулирующего ГПП-1 (ГПП-1 (7-36)амид и ГПП-1 (7-37)) по сравнению с исходными показателями. Сравнительный анализ групп выявил достоверное повышение уровня ГПП-1 (р < 0,05) в группе терапии МЕТ по сравнению с контрольной группой через 30 (63,8 ± 29,0 против 50,3 ± 15,6 пмоль/л) и 60 минут (75,8 ± 35,4 против 46,9 ± 20,0 пмоль/л). Через 90 минут достоверного повышения концентрации ГПП-1 относительно исходного уровня не отмечалось. В контрольной группе через 15 дней существенных изменений уровня ГПП-1 от исходного в указанные временные промежутки не зафиксировано (рис. 7).
Уровень лептина в группе МЕТ исходно составлял 14,3 ± 6,6 нг/мл, в контрольной группе – 15,8 ± 6,9 нг/мл. Через 15 дней до и после проведения ПГТТ он значительно не отличался от исходных показателей (14,8 ± 6,4 и 15,2 ± 6,3 нг/мл соответственно).
В 2004 г. E. Mannucci и соавт. [26] продолжили изучение эффектов МЕТ на ГПП-1 у пациентов с ожирением и СД 2 типа. 34 участника исследования были рандомизированы на две группы. В первую группу включены лица с СД 2 типа (n = 22), во вторую – без указанной патологии (n = 12).
Всем пациентам назначен МЕТ в дозе 850 мг в первый день исследования и 2550 мг (по 850 мг три раза в день) в течение следующих четырех недель.
Уровень ГГП-1 в обеих группах определяли при проведении ПГТТ в первый день и через четыре недели.
Установлено, что однократный прием МЕТ не влиял на уровень ГПП-1. По окончании терапии значения ГПП-1 у пациентов с СД 2 типа увеличились с 3,8 до 4,9 пмоль/л (р < 0,05). После проведения ПГТТ уровень ГПП-1 у них был значительно ниже. В то же время инкрементная площадь под кривой (AUC) ГПП-1 значительно увеличивалась как у пациентов с СД 2 типа (с 93,6 (45,6–163,2) до 151,2 (36,0–300,5) пмоль × мин/л (p < 0,05)), так и у пациентов без СД 2 типа (с 187,2 (149,4–571,8) до 324,0 (238,2–744,0) пмоль × мин/л (p < 0,05)).
Таким образом, исследования, проведенные E. Mannucci и соавт. [26, 27], продемонстрировали, что МЕТ увеличивает уровень ГПП-1 как у пациентов с СД 2 типа, так и у пациентов с нормальной толерантностью к глюкозе.
В настоящее время предложены две гипотезы о механизмах влияния МЕТ на уровень ГПП-1. Препарат действует как прямой и/или косвенный секретагог ГПП-1 или как ингибитор дипептидилпептидазы 4, продлевая период полувыведения активного ГПП-1 [28, 29].
Заключение
С развитием молекулярно-генетических технологий появились новые данные о связи измененной кишечной микробиоты не только с заболеваниями желудочно-кишечного тракта, но и с метаболическим синдромом, сахарным диабетом 2 типа. Последние данные свидетельствуют о потенциальной роли МК как патогенного фактора, ассоциированного с метаболическими нарушениями. Очевидно, что поддержание гомеостаза и нормального обмена веществ невозможно без восстановления качественного состава микроорганизмов кишечника.
В настоящее время в научной литературе помимо диетотерапии и применения пре- и пробиотиков активно обсуждаются эффекты МЕТ на модуляцию микробиоты и макроорганизм. Установлено, что МЕТ влияет на синтез ГПП-1, и не исключено, что указанный эффект реализуется через микробиоту и синтез короткоцепочечных жирных кислот. В этой связи представляется актуальным изучить влияние агонистов рецепторов ГПП-1 на микробиоту кишечника не только с целью коррекции метаболических нарушений, но и возможного улучшения качественного и количественного состава микробиоты.
N.E. Khachaturyan, L.V. Egshatyan
A.I. Yevdokimov Moscow State University of Medicine and Dentistry
A.S. Loginov Moscow Clinical Scientific Practical Center
National Medical Research Center of Endocrinology
Contact person: Lilit Vanikovna Egshatyan, lilit.egshatyan@yandex.ru
Recently data appeared on the role of the gut microbiota in obesity-related metabolic disorders and diabetes mellitus type 2 pathogenesis. Therefore, it is relevant to identify drugs aimed at hyperglycemia and metabolic disorders correction and influencing by the way of gut microbiota modulation. Their use can have positive effect on the macroorganism.
The article presents the literature review on the impact of oral antihyperglycemic therapy, particularly metformin, on gut microbiota. Metformin is commonly used as the first line of medication for the treatment of prediabetes and type 2 diabetes. The effect of metformin on the gut microbiota has been reported; however, the relationship between the gut microbiota and the mechanism of action of metformin in elderly individuals is unclear. Recently, metformin-induced changes in the abundance of Akkermansia muciniphila were shown to be associated with metabolic improvement. Metformin has also been reported to increase levels of glucagon-like peptide 1 in humans and it is possible that this effect is also realized through the modulation of gut microbiota. Metformin increase synthesis of short chain fatty acids by bacteria. It becomes relevant to study the influence of glucagon-like peptide 1 receptor agonists on gut microbiota and improvement of the qualitative composition of the microbiota.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.