Направленное подведение радиосенсибилизатора метронидазола с помощью салфеток «Колетекс» при лучевой терапии больных раком кожи
- Аннотация
- Статья
- Ссылки




Благодаря достижениям современной клинической радиобиологии в последнее время наметились 3 основных перспективных направления повышения эффективности лучевой терапии:
- использование нетрадиционных режимов фракционирования дозы;
- применение различных радиомодификаторов, в первую очередь радиосенсибилизаторов гипоксических клеток, а также радиопротекторов;
- комбинированное использование лучевой и химиотерапии.
Однако широкому внедрению в клиническую практику этих достижений препятствует ряд нерешенных проблем, связанных с разработкой новых способов подведения уже известных радиомодификаторов, повышающих их эффективность и снижающих побочное токсическое действие; разработкой оптимальных схем фракционирования дозы, способствующих усилению радиосенсибилизирующего действия; поиском новых перспективных радиомодификаторов; поиском эффективных сочетаний лучевой и химиотерапии; поиском достоверных и доступных в клинике критериев проспективного прогнозирования эффективности лучевого лечения.
По всем этим направлениям в радиологическом отделении МОНИКИ им. М.Ф. Владимирского ведутся научные исследования. В настоящей статье представлены результаты разработки и применения нового способа радиомодификации на основе местного направленного подведения химических препаратов к опухоли и нормальным тканям, включенным в зону облучения.
В рамках Всесоюзной межведомственной программы «Модификатор» (1985 г.) было показано, что одним из реальных способов повышения эффективности лучевой терапии злокачественных опухолей является использование метронидазола (МЗ) – радиосенсибилизатора гипоксических клеток опухоли, не уступающего по эффективности ГБО: коэффициент повышения эффективности лучевой терапии для ГБО и МЗ составляет соответственно 1,87 и 1,77 [1].
Широкому применению МЗ в клинической практике препятствует его плохая растворимость и как следствие недостаточная для оказания высокого радиосенсибилизирующего эффекта концентрация препарата в опухоли, а также высокое побочное токсическое действие при пероральном способе введения.
Эти обстоятельства побудили нас к необходимости усовершенствования способов подведения уже известных радиомодификаторов (радиосенсибилизаторов и радиопротекторов), повышающих их эффективность и снижающих побочное токсическое действие. В этой связи наиболее перспективным представляется использование местных методов их направленного подведения к опухоли или окружающим ее нормальным тканям, попадающим в облучаемый объем.
Цель исследования
Повышение эффективности лучевой терапии на основе разработки и внедрения в практику нового способа радиомодификации за счет направленного подведения МЗ в качестве радиосенсибилизатора.
Материал и методы
С целью повышения концентрации МЗ в опухоли и преодоления его токсического эффекта нами разработана новая методика радиосенсибилизации за счет местного подведения препарата к опухоли в виде аппликатора.
В основу положен разработанный в ООО НПО «Текстильпрогресс» способ получения текстильных материалов с заданными лечебными свойствами. Он позволяет наносить на текстильные материалы практически любые лекарственные препараты, в том числе такие малорастворимые, как МЗ, в концентрациях, недостижимых другими методами. МОНИКИ совместно с ООО НПО «Текстильпрогресс» разработаны и получены текстильные аппликаторы, содержащие МЗ в высокой концентрации – до 20 мкг/см2. Под названием салфеток «Колетекс–М» эти изделия разрешены к клиническому применению Минздравом соцразвития РФ и выпускается серийно.
Особенностью новой лекарственной формы является пролонгированный дозированный выход препарата в ткани в течение 1–3 суток.
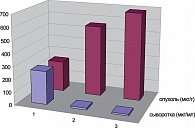
Исследование концентрации МЗ показало (риc. 1), что через 1 сутки после наложения аппликатора она составляла в опухоли в среднем 688 мкг/г, что почти втрое превышает таковую при оральном способе введения (243 мкг/г) и не уступает прямому внутриопухолевому введению (559 мкг/г), существенным недостатком которого является быстрый выход препарата из тканей. При этом в сыворотке крови определялись только следы препарата, что позволило полностью избежать побочного токсического действия. Через 3 суток средняя концентрация МЗ в опухоли составляла 274 мкг/г, что дает основание рассчитывать на выраженный радиосенсибилизирующий эффект (по радиобиологическим предпосылкам для его достижения концентрация МЗ должна быть не ниже 100–150 мг/г [1, 2].
Изучение радиосенсибилизирующего эффекта при аппликационном применении МЗ проведено на модели злокачественных новообразований кожи (ЗНК).
В исследование включено 465 больных с базальноклеточным (БКР) и плоскоклеточным раком (ПКР) кожи Т2–3N0M0 в возрасте от 37 до 83 лет.
Морфологически БК рак кожи выявлен у 361 (77,6%), ПК – у 104 (22,4%) больных.
У 75,9% больных БК раком кожи первичная опухоль соответствовала символу Т2, у 24,1% – Т3. У всех больных ПК раком кожи первичная опухоль расценивалась как Т3.
Как при БКР, так и при ПКР преобладала клинически наиболее неблагоприятная инфильтративно-язвенная форма роста опухоли – 86,7% и 76,3%.
Известно, что радиосенсибилизирующий эффект хорошо изученных в клинике сенсибилизаторов гипоксических клеток, таких как МЗ, реализуется только при применении небольшого числа укрупненных фракций. Поэтому в нашем исследовании были разработаны и применены новые нетрадиционные схемы фракционирования дозы, а именно, динамическое фракционирование, характеризующееся сочетанным использованием укрупненных и сниженных фракций.
При лучевой терапии (ЛТ) в сочетании с МЗ и применялись дистанционная гамматерапия (ДГТ), близкофокусная рентгенотерапия (БРТ) и сочетанная лучевая терапия с использованием нетрадиционных режимов фракционирования в суммарных очаговых дозах, изоэффективных 72–73 Гр.
При БРТ в сочетании с МЗ подводили первые 6 укрупненных фракций по 5 гр., при ДГТ – 3 укрупненные фракции по 4 Гр
в начале каждой половины расщепленного курса (всего 6 фракций); при ДГТ в качестве первого этапа сочетанной лучевой терапии – 3 укрупненные фракций по 4 Гр.
Салфетку с МЗ накладывали на поверхность опухоли с захватом 1,5–2 см нормальной кожи за 1 сутки до начала лучевого лечения.
В соответствии с задачами исследования все 465 больных ЗНК были разделены на 3 группы, при этом, учитывая известную зависимость эффекта радиосенсибилизации гипоксических клеток от размера опухоли, мы разделили больных БКР кожи Т2 на подгруппы, в одну из которых вошли пациенты с наибольшим размером опухоли – от 2 до 4 см, а в другую – от 4 до 5 см.
273 больным лучевое лечение проводилось с применением аппликаций с метронидазолом, 192 больным контрольной группы – без него (таблица 1).
Эффективность использования МЗ в качестве радиосенсибилизатора при лучевой терапии рака кожи оценивалась по непосредственным результатам лечения, количеству рецидивов и переносимости лечения, степени выраженности лучевых реакций.
Полученные результаты и их обсуждение
Все три примененных методики лучевой терапии ЗНК в сочетании с МЗ удовлетворительно переносились больными, при этом не отмечено усиления частоты и степени выраженности местных лучевых реакций (таблицы 2, 3) и проявления побочного токсического действия МЗ.
При близкофокусной рентгенотерапии БК рака кожи в сочетании с МЗ намечается тенденция к уменьшению степени выраженности лучевых реакций за счет уменьшения числа больных с влажным эпидермитом, что можно объяснить еще и противовоспалительным действием этого препарата, но это различие недостоверно (p>0,1).
Непосредственные результаты лечения представлены в таблице 4.
Результаты лучевого лечения БКР кожи Т2–Т3 в сочетании с МЗ выявили явную зависимость его радиомодифицирующего эффекта от размеров опухоли. При БРТ больных с БКР кожи Т2 с размером опухоли менее 4 см получены одинаково высокие непосредственные результаты независимо от применения МЗ: 94,8 ± 2,2% и 89,8 ± 3,9%. При сочетанной лучевой терапии БКР кожи Т2 с размером опухоли от 4 до 5 см за счет использования МЗ удалось статистически достоверно повысить показатель непосредственной излеченности с 73,2 ± 6,9% в контрольной группе до 88,2 ± 3,7% (р < 0,05). За счет применения МЗ при ДГТ БКР кожи Т3 показатель непосредственной излеченности достоверно повысился по сравнению с контрольной группой с 70,5 ± 6,8% до 88,4 ± 4,8% (р < 0,05).
Полученные нами данные подтверждают общепринятое мнение, что при БКР кожи существует определенный порог в размере опухоли в диапазоне 3–4 см, после которого результаты лучевого лечения существенно ухудшаются. Очевидно, это связано с увеличением фракции гипоксических клеток по мере увеличения размеров опухоли. За счет использования МЗ эту разницу в результатах лечения удалось нивелировать.
Радиосенсибилизирующий эффект МЗ проявился и при ДГТ ПКР кожи Т3: непосредственная излеченность достигнута у 85,9 ± 4,6% больных, что достоверно выше по сравнению с пациентами контрольной группы, при лечении которых радиомодификаторы не использовались – 66,0 ± 6,9% (р < 0,05).
В целом при лучевом лечении рака кожи Т2–3 за счет использования МЗ результаты лечения оказались достоверно выше по сравнению с контрольной группой: этот показатель соответственно составил 90,1 ± 1,9% и 75,5 ± 3,1% (р < 0,005).
Наблюдения за больными велись не менее 3 лет.
Хотя частота рецидивов после лучевого лечения БКР и ПКР кожи с применением МЗ была на 5–11% меньше по сравнению с облучением без радиомодификаторов, достоверного различия по этому критерию не выявлено (таблица 5).
При лучевом лечении рака кожи Т2 частота рецидивов составила 10,7 ± 2%, а Т3 – 16,1 ± 2,6%. Сводные литературные данные свидетельствуют, что число рецидивов лучевого лечения рака кожи для Т2 составляет от 8 ± 1% до 24 ± 1%, а для Т3 – от 27 ± 2 до 58 ± 4% (3). Полученные нами результаты для Т2 согласуются с данными литературы, а для Т3 – превосходят их.
Приступая к исследованию, мы отдавали себе отчет в том, что лучевое воздействие даже в сочетании с радиосенсибилизаторами не меняет сути метода лучевой терапии, остающегося средством локального противоопухолевого воздействия неэтиопатогенетического характера. Поэтому мы были вправе ожидать от присоединения к лучевой терапии радиосенсибилизаторов большей повреждаемости опухолевых клеток. Это должно было привести к существенному улучшению непосредственных результатов лечения, которые рассматривались нами в качестве одного из основных критериев оценки эффективности применения радиосенсибилизаторов. По этому критерию нам удалось подтвердить преимущество использования лучевой терапии в сочетании с радиосенсибилизаторами при лечении местно-распространенных форм рака кожи. По-видимому, радиосенсибилизаторы гипоксических клеток, достоверно повышая результаты непосредственной излеченности опухолей, в дальнейшем не оказывают существенного влияния на процессы их рецидивирования. Аналогичные данные были получены нами ранее при использовании ГБО и МЗ при лучевом лечении рака орофарингеальной зоны [4].
Заключение
Лучевая терапия больных раком кожи Т2–3 с аппликационным применением радиосенсибилизатора метронидазола при помощи салфеток «Колетекс» обладает высокой лечебной и социально-экономической эффективностью и может рассматриваться как метод выбора при лечении этого контингента больных.
Выводы
- Применение МЗ в виде аппликаций при самостоятельной лучевой терапии рака кожи Т2–3 по сравнению с лечением без радиомодификатров достоверно повышает показатель непосредственной излеченности с 70,5–73,2% до 88,4% и не сопровождается побочными токсическими эффектами и усилением степени выраженности местных лучевых реакций.
- Степень радиосенсибилизирующего эффекта МЗ зависит от объема опухолевого поражения и возрастает по мере его увеличения.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.