Нарушения липидного обмена и метаболический синдром: особенности клинических проявлений и подбор лекарственной терапии
- Аннотация
- Статья
- Ссылки

В 2007 г. были опубликованы рекомендации Европейского общества кардиологов и Европейской ассоциации по изучению диабета, в которых анализируется роль метаболического синдрома (МС) в развитии сердечно-сосудистых заболеваний (ССЗ) и их осложнений. МС является сочетанием инсулинорезистентности, артериальной гипертонии, дислипидемии (гипертриглицеридемия, повышение холестерина ЛНП, низкий уровень холестерина ЛВП), микроальбуминурии, гиперурикемии, нарушения системы гемостаза и хронического субклинического воспаления. В настоящее время существует по крайнем мере 5 определений, предложенных: ВОЗ в 1998 г., Европейской группой по изучению инсулинорезистентности (ЕГИР) в 1999 г., Советом экспертов национальной образовательной программы по холестерину (ATP III NCEP) в 2001 г., Американской ассоциацией клинических эндокринологов в 2003 г. и Международной федерацией диабета в 2005 г. Критерии ВОЗ и ЕГИР были предназначены для исследовательских целей, а критерии NCEP и Международной федерации диабета нацелены на клиническую практику. В нескольких европейских проспективных исследованиях было показано, что МС ассоциируется с увеличением сердечно-сосудистой и общей смертности. Однако в американском исследовании NHANES II с участием 2341 взрослых американцев в возрасте 30-75 лет МС сопровождался умеренным увеличением риска сердечно-сосудистой смерти, но не оказывал достоверного влияния на риск смерти от любых причин или инсульта. Мета-анализ проспективных исследований показывает, что МС по сравнению с отдельными факторами риска ССЗ имеет более выраженный атерогенный потенциал, что способствует высокому риску развития ССЗ (2).
Особенности нарушений липидного обмена при МС
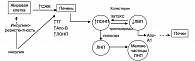
Термин дислипидемия более точно характеризует нарушения липидного обмена при МС, которые проявляются в виде увеличения апо-В-содержащих частиц, таких, как триглицериды, холестерин ЛОНП, мелкие и плотные частицы холестерина ХС ЛНП и снижения апо-А1-содержащих частиц холестерина ХС ЛВП. Эти нарушения имеют определенную последовательность или патогенетическую цепь развития (рисунок 1). При инсулинорезистентности в жировой клетке происходит липолиз, что приводит к выбросу большого количества свободных жирных кислот в кровоток через воротную вену. Они служат субстратом для синтеза триглицеридов печенью и избыточной продукции липопротеидов очень низкой плотности (ЛОНП). Под воздействием фермента печеночная липаза, ЛОНП превращаются в мелкие и плотные частицы ЛНП. Такие частицы подвергаются быстрому окислению и проникают в субэндотелиальное пространство, что усиливает процесс развития атеросклеротического поражения. В то же время увеличение активности белка, переносящего эфиры холестерина, приводит к переходу триглицеридов от ЛОНП к ЛВП (взамен на холестерин). В результате этого уменьшается концентрация ЛВП – основных частиц, осуществляющих обратный транспорт холестерина. Более того, они изменяются качественно (более мелкие частицы), что является причиной их быстрого выведения из кровообращения (9). Таким образом, нарушения липидного обмена при СД отличаются изменением соотношения «плохого» (ХС ЛНП и ХС ЛОНП) и «хорошего» (ХС ЛВП) холестерина, а также увеличением концентрации триглицеридов. В практической медицине эти нарушения именуется как липидная триада (3).
В 2007 г. завершено одномоментное российское исследование по выявлению МС в случайной выборке взрослой популяции в отдельно взятом городе Приволжского федерального округа (г. Чебоксары). В исследовании участвовали 1800 мужчин и женщин в возрасте 30-69 лет. Отклик составил 88,7% (n = 1718). Было показано, что 20,6% лиц имеют МС, причем у женщин он встречается в 2,4 раза чаще, а с возрастом число больных увеличивается. Так, в возрастном диапазоне 30-39 лет МС выявлен у 1%, в 40-49 лет – у 3,6%, в 50-59 лет – у 9%, а в возрасте 60-69 лет – у 7% респондентов. Для диагностики метаболического синдрома использовали критерии NCEP (наличие 3 и более компонентов, включая гипертриглицеридемию и низкий уровень холестерина ЛВП). В целом, у 78% пациентов с МС выявлен низкий уровень холестерина ЛВП, тогда как гипертриглицеридемия диагностирована у 44%. Несмотря на то, что гиперхолестеринемия не включена в критерии диагностики, у 76% пациентов с МС диагностирована мягкая и умеренная гиперхолестеринемия (52 и 24% соответственно) (4).
По данным Британского проспективного исследования по диабету (UKPDS), прогностическая значимость факторов риска в плане развития ИБС (стенокардия напряжения и/или инфаркт миокарда) составляет следующую последовательность: холестерин ЛНП, холестерин ЛВП, гликированный гемоглобин, систолическое АД. В исследовании определяли влияние на риск развития ИБС повышения уровней ключевых факторов риска на одну ступень. Так, повышение уровня холестерина ЛНП на 1 ммоль/л вызывало увеличение риска развития ИБС на 57%, а повышение уровня холестерина ЛВП на 0,1 ммоль/л приводило к снижению риска на 15% (5).
Учитывая сложное взаимодействие триглицеридов и других липопротеидов и вариабельность концентрации триглицеридов, очевидно, что подтвердить их прогностическое значение с помощью математических методов сложно. При мета-анализе популяционных исследований было показано, что при увеличении уровня триглицеридов на 1 ммоль/л сердечно-сосудистый риск повышается на 32% у мужчин и 76% у женщин. С поправкой на уровень холестерина ЛВП степень повышения сердечно-сосудистого риска уменьшилась вдвое, но сохранила статистическое значение (2).
Таким образом, повышенный уровень холестерина ЛНП и низкая концентрация холестерина ЛВП в крови является сильным предиктором развития ИБС у больных с МС.
Принципы лекарственной терапии при дислипидемии и МС
Поиск эффективных методов лечения дислипидемии берет свое начало с 70-х гг. XX в. Применение секвестрантов желчных кислот, никотиновой кислоты и в дальнейшем фибратов (в частности, гемфиброзил) показало, что имеется достоверная корреляция между снижением уровня холестерина и уменьшением частоты сердечно-сосудистых осложнений. По различным причинам эти группы препаратов не нашли широкого применения для коррекции дислипидемии у больных с метаболическими нарушениями и высоким сердечно-сосудистым риском. С появлением статинов открылись новые возможности эффективного и безопасного снижения смертности от сердечно-сосудистых заболеваний. Американский ученый W. Roberts определил значение статинов при лечении атеросклероза таким, каким было значение пенициллина в лечении инфекционных болезней. Основным механизмом действия статинов является умеренное снижение содержания холестерина в клетках печени за счет обратимого подавления ключевого фермента синтеза холестерина – ГМК-КоА редуктазы, что приводит к увеличению количества рецепторов для ЛНП и повышению выведения их из кровотока. В экспериментальных исследованиях было показано, что статины способствуют стабилизации атеросклеротической бляшки за счет уменьшения объема липидного ядра, укрепления оболочки (противовоспалительный эффект) и улучшения локальной функции эндотелия. В 90-х гг. были проведены масштабные клинические исследования, в которых изучалось влияние терапии статинами на различные конечные точки, характеризующие сердечно-сосудистую заболеваемость и смертность, обусловленных атеросклерозом (6). Мета-анализ результатов 4 крупных проспективных исследований показал, что применение статинов у больных с умеренной и выраженной гиперхолестеринемией привело к достоверному снижению сердечно-сосудистой и обшей смертности (таблица 1) (7-10). В большинстве исследований также отслеживалась эффективность статинов у больных СД типа 2 и метаболическими нарушениями (примерно 10-15% общего числа участников). Несмотря на одинаковые исходные уровни холестерина ЛНП, в субгруппе пациентов с СД риск сердечно-сосудистых осложнений снижается достоверно на 7% (от 2 до 10%) больше по сравнению с общей группой больных. Эти данные свидетельствуют о том, что применение статинов у больных СД в сочетании с гиперхолестеринемией приводит к заметному снижению общего риска сердечно-сосудистых осложнений. Более того, эти результаты превосходят таковые по сравнению с общей группой больных (с наличием или без ИБС) без СД. Эксперты Европейского общества кардиологов и Европейской ассоциации по изучению диабета на основании проспективных исследований с твердыми конечными точками статины рекомендуют средством первого ряда в лечении высокого уровня холестерина ЛНП у больных СД и метаболическими нарушениями (класс I, уровень А) (2).
Российский опыт применения статинов у лиц с МС
Одной из актуальных проблем первичной и вторичной профилактики ССЗ является выявление и коррекция нарушений липидного обмена в реальной клинической практике. По сравнению с европейскими странами (по данным исследования REALITY, 58223 пациентов из 10 стран Европы) в России липидснижающая терапия (в частности, статины) назначаются в 5-6 раз реже. В 2006 г. были представлены результаты двух российских исследований (MCC – Московское исследование по статинам и ОСКАР – Эпидемиология и особенности терапии пациентов высокого риска в реальной клинической практике), которые дали представление об адекватности терапии гиперлипидемии в учреждениях первичного здравоохранения. В частности, в исследовании ОСКАР, состоявшего из 2 этапов, было показано, что в клинической практике только 5,3% больных среди пациентов, имеющих факторы риска ССЗ, получают гиполипидемическую терапию статинами, причем только 4,3% достигают целевых уровней липидов. Во второй части программы ОСКАР всем 7098 пациентам рекомендована статинотерапия: большинство пациентов принимали симвастатин (Вазилип, 20 мг в сутки), 20% пациентам был рекомендован аторвастатин (Аторис, 10 мг в сутки). Через 8 недель терапии удалось достичь снижения уровня холестерина на 23%, при этом целевые уровни холестерина (< 2,6 ммоль/л) достигли 17% пациентов. Положительная динамика липидных изменений способствовала снижению общего риска развития ССЗ на 34% (11).
В двух крупных исследованиях, посвященных первичной профилактике ССЗ (ASCOT-LLA, n = 2532 и CARDS, n = 2838), показано, что терапия с применением аторвастатина в дозе 10 мг на протяжении не менее 3 лет способствует снижению кумулятивного показателя сердечно-сосудистых событий на 36 и 37% соответственно.
Недавно опубликованы результаты клинического исследования А.Л. Хохлова и соавт., посвященного изучению эффективности применения аторвастатина у лиц с дислипидемией и МС. В исследование были включены 40 пациентов в среднем возрасте 54,4 ± 5,0 лет с МС (АГ I-II ст., абдоминальное ожирение, СД типа 2 и дислипидемия). Исходно пациенты имели умеренную гиперхолестеринемию (7,5 ± 1,1 ммоль/л) и мягкую гипертриглицеридемию (2,4 ± 0,9 ммоль/л), при этом коэффициент атерогенности составил 6,1 ± 1,2. На фоне терапии с применением аторвастатина (Аторис, 10 мг в сутки) продолжительностью 5 месяцев общий холестерин снизился на 32%, холестерин ЛНП на 44%, триглицериды на 22,5%, а холестерин ЛВП увеличился на 15%. На фоне терапии целевые уровни общего холестерина достигнуты у 20%, ХС ЛНП у 25% и триглицериды у 55% пациентов с МС. Наряду с этим начальные дозы аторвастатина способствуют снижению уровня гликированного гемоглобина на 1,1%. По данным исследования UKPDS, снижение HbA1с на 1% сопровождается снижением риска ССЗ на 25%. В результатах исследования представлены данные о динамике уровня С-реактивного белка – маркера хронического воспаления. Так, высоко чувствительный С-реактивный белок снизился на 37% (12). Плеотропные эффекты аторвастатина доказаны в крупном российском исследовании ФАРВАТЕР. В частности, применение Аторис 10-20 мг у лиц с документированными ИБС и гиперлипидемией на протяжении 24 недель способствовало снижению С-реактивного белка на 20%, улучшение эндотелий-зависимой вазодилатации на 52%, увеличению растяжимости на 45% и уменьшение жесткости сосудистой стенки на 25% (13).
В целом применение аторвастатина у лиц с МС и ИБС, стенокардией напряжения приводит к снижению частоты ангинозных приступов (1,95 ± 1,76 до исследования и 0,8 ± 0,7 после лечения, p < 0,05). Терапия с применением Аториса способствует улучшению состояния физического и психического здоровья.
Таким образом, включение аторвастатина в среднесуточной дозе в стандартную терапию пациентов с МС снижает уровень аторогенных частиц, снижает коэффициент атерогенности, а также достоверно уменьшает уровни гликированного гемоглобина и высоко чувствительного С-реактивного белка, что способствует снижению суммарного показателя сердечно-сосудистого риска.
Заключение
Таким образом, атерогенная дислипидемия является важным фактором развития сердечно-сосудистых осложнений у больных с метаболическими нарушениями.
Данные доказательной медицины убедительно показывают, что статины являются препаратами первого ряда для первичной и вторичной профилактики ССЗ. У больных с СД и ССЗ статины назначают независимо от исходного уровня холестерина ЛНП. У взрослых больных с СД и метаболическими нарушениями статины применяются, если уровень холестерина ЛНП превышает 3,5 ммоль/л.
В рекомендациях Европейского общества кардиологов целевые уровни липидов при первичной профилактике у больных с метаболическими нарушениями и СД соответствуют таковым у больных с ССЗ: общий холестерин < 4,5 ммоль/л, ХС ЛНП < 2,5 ммоль/л, триглицериды < 1,7, ХС ЛВП > 1 ммоль/л у мужчин и > 1,2 ммоль/л у женщин.
В некоторых случаях для снижения уровня холестерина не ЛВП требуется применение высоких доз статинов или комбинированная терапия с использованием эзетимиба, никотиновой кислоты или фибратов.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.


