Нарушения сна и головная боль: соотношение и взаимовлияние
- Аннотация
- Статья
- Ссылки
- English


Сон – неотъемлемая часть жизни и одна из основных потребностей человека, а расстройства сна – значимая клиническая проблема. Почти 50% населения страдает теми или иными нарушениями сна. Парадигма медицины сна предполагает изучение различных патологических феноменов в цикле «сон – бодрствование». И с этой точки зрения большой интерес представляют головные боли, входящие в число самых распространенных жалоб: по данным Всемирной организации здравоохранения, ими страдают 50–75% взрослого населения. Именно поэтому и головная боль, и нарушения сна приобрели статус глобальной проблемы здравоохранения.
В Международной классификации головной боли третьего пересмотра (2018) сон упоминается 38 раз [1]. А в Международной классификации нарушений сна головная боль указывается среди симптомов расстройств сна [2]. Головную боль, ассоциированную со сном, Американская академия медицины сна называет одним из характерных симптомов при головной боли (мигрени или другого типа) [3].
Отношения между головной болью и нарушениями сна сложны и многогранны. У пациента, страдающего расстройством сна и головной болью, трудно установить, что является причиной, а что следствием. Тем более что головная боль и нарушения сна – обоюдно направленный процесс. Будучи коморбидными, синдромы способствуют хронизации и утяжеляют течение друг друга, обусловливают ухудшение состояния и качества жизни пациента, увеличивают частоту осложнений и снижают эффективность терапии.
Исторические сведения
Тесная и сложная взаимосвязь сна и головной боли беспокоила многих клиницистов на протяжении веков. Еще в 1853 г. M. Romberg писал, что «приступ (мигрени) обычно заканчивается глубоким и освежающим сном» [4]. А в 1873 г. E. Liveing в книге «Влияние сна на облегчение головной боли» указал на то, что приступы мигренозной головной боли коррелируют со сном [5]. В качестве наиболее ранних публикаций можно отметить следующие: концепция S. Freud о головной боли во сне и ее психодинамическая интерпретация (1926) [6], упоминание R. Bing (1945) о головных болях, возникающих при пробуждении от сна [7], данные M. Gans (1951) о снижении приступов мигрени после селективного лишения сна [8], особенно глубокого [9], и открытие J. Dexter и E. Weitzman (1970) о связи ночных болей со стадиями сна [9].
Одну из первых работ, направленных на системный многосторонний анализ соотношения головной боли и сна, выполнили в 1990 г. P.K. Sahota и J.D. Dexter [10]. В дальнейшем акцент на взаимовлиянии сна и головной боли был сделан во втором издании Международной классификации расстройств сна (руководстве по диагностике и кодированию) 2005 г. [2].
В 2014 г. в Дании проведено первое масштабное эпидемиологическое исследование, которое оценивало частоту коморбидности головной боли и нарушений сна [11]. Согласно полученным результатам, 18,1% человек жаловались на головную боль и инсомнию одновременно, 16,3% страдали только от головной боли, а 21,1% имели только проблемы со сном. Коморбидная патология чаще наблюдалась у женщин и лиц среднего возраста. Среди факторов риска отмечались низкий уровень социально-экономического статуса, нездоровый образ жизни (лишний вес/ожирение), высокий уровень стресса, тревога и депрессия. Авторы пришли к выводу о высокой степени коморбидности головных болей и нарушений сна, необходимости активного выявления в клинической практике пациентов с данными состояниями с целью своевременной терапии, а также о важности профилактических мер. Среди них изменение образа жизни, снижение влияния стресса, скрининг на депрессию и тревогу, которые могут иметь большое значение для лечения и профилактики сочетания головной боли и нарушений сна [3, 12, 13].
Нейробиологические механизмы соотношения головной боли и сна
Сон и болевая перцепция
Переход из состояния бодрствования в состояние сна сопровождается развитием своеобразной деафферентации, когда повышается порог реагирования на звуковые, тактильные и проприоцептивные стимулы [14]. Было показано, что такая модуляция осуществляется на уровне таламуса. При этом таламокортикальные нейроны, обеспечивающие передачу сенсорной информации к соответствующим соматотопическим зонам, демонстрируют урежение частоты импульсации с переходом в пачечный режим, что, по-видимому, позволяет ограничить объем пропускаемой информации и обеспечить увеличение порога пробуждения на афферентные стимулы [15]. Предполагается, что модификация афферентной информации осуществляется и на стволовом, и на спинальном уровне: чувствительных тригеминальных ядер, ядер одиночного пути и задних рогов спинного мозга. Это подтверждается данными оценки компонентов ноцицептивного флексорного рефлекса при переходе от бодрствования ко сну [16]. Исследования, проводившиеся на здоровых добровольцах, продемонстрировали снижение болевых порогов при сокращении времени сна [17] и чувствительности к боли на фоне увеличения времени сна [18]. Аналогичные результаты были получены в экспериментах на животных [19].
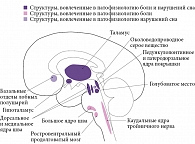
Многие из структур, путей и нейромедиаторов, участвующих в формировании нарушений сна, также вовлечены в патофизиологию головной боли. Конвергенция между путями сна и головной болью в первую очередь локализуется в диэнцефальных и стволовых структурах головного мозга (рис. 1) [20]. Ключевой структурой, связывающей головную боль и сон, является гипоталамус – релейная станция всех видов чувствительности и вместе с тем циркадианный пейсмекер. Изучение патофизиологии и функции гипоталамуса одновременно при головной боли и расстройствах сна может объяснить, как восприятие боли с участием тройничного нерва коррелирует с индукцией сна. Тригемино-цервикальный комплекс, играющий важную роль в формировании головной боли, соединен с целым рядом стволовых структур. Ноцицептивная информация поступает в ядра таламуса, активация которого имеет большое значение в развитии мигрени и кластерной головной боли. Тройничный нерв отправляет афферентные импульсы в интра- и экстракраниальные структуры и кровеносные сосуды, спинальный тригемино-цервикальный комплекс [21]. При переходе ко сну орексинергическая система активирует вентролатеральное преоптическое ядро. Прямое торможение системы и снижение орексинергической поддержки состояния сна определяют быстрые переходы от сна к бодрствованию и наоборот. Орексинергическая система, включающая нейропептиды (орексины, или гипокретины, А и В), представлена в заднем, латеральном и паравентрикулярном гипоталамусе [22]. Орексиновые рецепторы располагаются в префронтальной коре, таламусе и подкорковых областях и участвуют не только в обеспечении бодрствования, но и в модуляции болевой чувствительности, терморегуляции, нейроэндокринных и вегетативных функциях [23]. Эти зоны задействованы и в модуляции ноцицептивной активации тригемино-васкулярного комплекса [24]. Нарушение деятельности центров сна в переднем гипоталамусе приводит к нестабильной работе таламической «релейной станции», причем естественная для сна блокада проведения по чувствительным путям оказывается не столь эффективной, и порог боли снижается [15, 25].
Среди других структур, участвующих в двух рассматриваемых патофизиологических процессах, можно выделить голубоватое место, вентральную часть околоводопроводного серого вещества и дорсальное ядро шва. Эти клеточные структуры посылают моноаминергические проекции к таламическим ядрам, латеральному гипоталамусу, базальному переднему мозгу и коре головного мозга. Они важны для поддержания возбуждения и активны в часы бодрствования [25, 26]. Кроме того, вентролатеральная часть околоводопроводного серого вещества играет специфическую роль в выключении быстрого сна (то есть это зона быстрого сна) и иннервируется орексинергическими нейронами латерального гипоталамуса [21]. Эти структуры ствола мозга имеют важное значение не только для возбуждения, но и для модуляции восприятия головной боли, действуя как эндогенная «антиноцицептивная система» [27].
Говоря о нейрохимии взаимодействия «головная боль – нарушения сна», необходимо отметить особую роль прежде всего таких нейрогормонов, как орексин и мелатонин.
Орексин – возбуждающий нейропептидный гормон, который способствует бодрствованию и подавляет быстрый сон [21]. Дефицит орексина отмечается при нарколепсии. Вместе с тем до 80% пациентов с нарколепсией жалуются на головную боль, особенно часто на головную боль напряжения и мигрень [28]. Исследования показывают, что орексин участвует в модуляции болевой активности, в том числе в каудальном ядре тройничного нерва. Полиморфизм гена рецептора орексина 2 связывают с кластерной головной болью [29].
Мелатонин – нейрогормон, продуцируемый преимущественно шишковидной железой и регулируемый супрахиазматическим ядром. Он играет решающую роль в регулировании циркадианных ритмов, включая инициацию сна и поддержание его ритмов. Секреция мелатонина подвержена суточному циклу: она усиливается в темное время суток и подавляется в присутствии света, процесс регулируется посредством супрахиазматических ядер гипоталамуса. Одновременно с этим мелатонин обладает обезболивающими свойствами, а нарушение секреции мелатонина может привести к головной боли. Механизмы, лежащие в основе связи мелатонина и головной боли, могут включать потенцирование ГАМКергического ингибирования болевых путей, модуляцию 5-НТ-сигнализации, снижение продукции провоспалительных цитокинов, ингибирование синтазы оксида азота, антиоксидантные эффекты и индукцию цитокинов, действующих на опиоидные рецепторы (мелатонин-индуцированные опиоиды) [27, 30]. У пациентов с хронической мигренью и коморбидной бессонницей в дополнение к задержке фазы сна был значительно снижен уровень мелатонина [31].
Имеются данные, показывающие задержку и снижение секреции мелатонина у пациентов с кластерной головной болью и менструальной мигренью, а также высокую распространенность неспецифических головных болей у пациентов с нарколепсией [32]. Снижение секреции мелатонина предложено рассматривать в качестве патофизиологического объяснения того факта, что гипническая головная боль возникает исключительно в среднем и пожилом возрасте [25, 27].
Еще одним нейромедиатором, играющим роль в патофизиологии как головной боли, так и расстройств сна, является аденозин, действующий на рецепторы A1 и A2A в центральной нервной системе. Стимулирование А1-рецепторов характеризуется антиноцицептивным эффектом, А2А-рецепторов – вызывает боль. Эффекты аденозина, связанные с регуляцией сна, в основном опосредованы активацией рецептора A1, с некоторым вкладом активации рецептора A2A [33]. Введение аденозина может вызвать мигрень у восприимчивых пациентов [26]. Вместе с тем во время приступов мигрени были зарегистрированы повышенные циркулирующие уровни аденозина [34].
Головную боль и сон могут связывать также аномальные серотониновые сигналы в стволе мозга. Основным серотонинергическим ядром центральной нервной системы является дорсальное ядро шва – ключевая антиноцицептивная структура, которая тоже участвует в стимулировании бодрствования [35]. Кроме того, уже давно высказываются предположения о важной роли серотонина в патофизиологии мигрени [36, 37].
Психологические факторы
Взаимовлияние головной боли и нарушений сна опосредовано не только биологическими, но и психологическими факторами. Прежде всего их связывают общие эмоционально-личностные предпосылки: тревожность, уязвимость к воздействию стресса, заниженная самооценка, дезадаптивный тип отношения к болезни.
По результатам недавнего датского кросс-секционного популяционного исследования [11], установлено, что головная боль, коморбидная нарушениям сна, значительно повышала уровень тревоги, депрессии и ухудшала качество жизни. M. Engstrøm и соавт. показали, что повышение уровня тревожности ассоциировалось с более поверхностным сном как у больных мигренью, так и у здоровых лиц, но в достоверно большей степени у пациентов с мигренью [38].
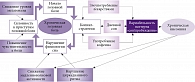
Была предложена биоповеденческая модель механизмов связи хронической инсомнии и хронической головной боли [39]. Она предполагает, что попытки преодоления головной боли могут ускорять и усиливать нарушения сна, а нарушение физиологии сна увеличивает склонность к головной боли. Со временем эти циклы начинают влиять друг на друга, результатом чего становится преобразование или переход эпизодической головной боли в хроническую (рис. 2) [3].
Хроническая головная боль может рассматриваться как условие для развития нарушений сна также потому, что побуждает к использованию дезадаптивных стратегий, например увеличение дневного сна, проведение большего количества времени в спальне во время бодрствования и приступа боли, прием снотворных медикаментозных препаратов перед сном и стимулирующих напитков в дневное время [40, 41].
Боль еще в большей степени ухудшает сон, становясь источником стресса и создавая «порочный круг» [40]. Нарушения сна способны изменить отношение пациентов к своей головной боли в сторону драматизации и катастрофизации [42]. Как нарушение сна, так и хроническая боль значительно увеличивают риск депрессии и тревоги, что еще больше влияет на сложные отношения сна и головной боли.
Варианты взаимовлияния головной боли и нарушений сна
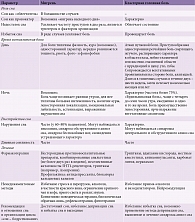
Расстройство сна и боль нередко выступают в качестве сочетанной патологии, серьезно ухудшая здоровье и снижая качество жизни пациентов (табл. 1) [1, 42–50]. Во многих исследованиях отмечена положительная корреляция между интенсивностью боли и степенью нарушения сна [51]. Кроме того, показано, что структура нарушения сна при хронической боли и первичной инсомнии похожа [52].
Рассматриваются различные варианты взаимосвязи головных болей и нарушений сна. Во-первых, оба явления могут развиваться на общей почве системной патологии (анемии, гипоксемии), быть независимо коморбидными с целым рядом обменных расстройств (ожирением, сахарным диабетом второго типа), иметь общие причины и провокаторы (эмоциональный стресс, тревожно-депрессивные расстройства).
Во-вторых, оба состояния могут влиять друг на друга, однако нет единого мнения о том, в какой степени. Одни исследователи считают, что нарушения сна в большей мере увеличивают риск развития головной боли, нежели болевой синдром провоцирует нарушение сна. Типичный пример – гипническая головная боль [53]. У пациентов с инсомнией в два-три раза повышается риск развития мигрени и головной боли напряжения [47, 54, 55], а также хронической ежедневной головной боли [48]. Другие полагают, что боль воздействует на процесс сна сильнее, чем нарушение сна на развитие болевого синдрома [56, 57]. По данным P.H. Finan, при хроническом болевом синдроме расстройства сна регистрировались у 67–88% пациентов, а при инсомнии жалобы на боль предъявляли только 50% участников [58]. Показано, что степень проявления нарушений сна коррелирует с увеличением распространенности головной боли [46]. Однако сами по себе болевые раздражители не объясняют нарушения сна в той степени, в какой о них сообщают пациенты с головной болью. Это обусловлено тем, что болезненные стимулы во время сна у здоровых людей приводят только к кратковременным корковым возбуждениям и постуральным корректировкам без значительного нарушения сна или воспоминания о плохом сне на следующий день. Хроническая боль ассоциируется с повышенной активностью систем, модулирующих восходящую активацию и ноцицепцию, а также нарушает микроархитектонику сна [40, 59, 60]. Немаловажный аспект – нарушения сна, вызванные приемом препаратов для лечения головной боли [61].
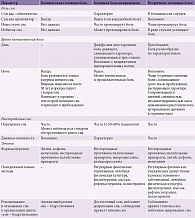
Сон по отношению к головной боли может выступать в качестве «облегчителя», провокатора и модификатора (табл. 2 и 3). Наиболее ярким примером «облегчительного» эффекта сна в отношении головных болей служит мигрень, атака которой купируется, если пациенту удается заснуть. Однако существует особая форма мигрени – «мигрень выходного дня», когда головная боль, возникающая после пробуждения, развивается в результате избытка сна. Недостаток же ночного сна, неудовлетворенность им часто приводят к утренним головным болям. Провоцирующая роль сна отчетливо просматривается у пациентов с кластерными головными болями, поскольку сон является основной причиной их возникновения. При таких симптомах пациентам показана депривация (кратковременное лишение) сна, что приводит к улучшению их состояния и отсутствию болевых симптомов примерно в течение пяти суток.
Известен вариант головной боли, развивающейся только во сне, – так называемая гипническая головная боль [53], на долю которой приходится 0,07–0,35% в структуре головных болей, наблюдаемых в специализированных клиниках. Она развивается у людей старше 50 лет и прогрессирует с возрастом. Большинство пациентов отмечают единичный эпизод головной боли, который возникает в середине или второй половине сна (с двух до четырех часов утра) в одно и то же время и приводит к пробуждению.
Авторы, изучавшие головные боли сна, рассматривают их различные варианты по времени возникновения по отношению ко сну: во время сна [7], после сна [62, 63] и в различных стадиях сна [53, 64]. Одни варианты головных болей сна (гипническая головная боль) связаны со сном напрямую, а другие (кластерная головная боль) – через общие нейробиологические механизмы.
При головной боли больные видят сны драматического и устрашающего характера, но без сцен собственной смерти. Вместе с тем сновидения с подобными сюжетами не служат триггерами для мигренозных атак. Как правило, сами приступы головных болей прерывают сон только на момент атаки, но не лишают сна на всю ночь, поэтому жалобы пациентов, страдающих головными болями, на полное отсутствие сна – определенный признак других заболеваний (тревоги и депрессии), которые и служат причиной нарушения сна. Другие нарушения, например синдром обструктивного апноэ сна, могут стать причиной вторичных головных болей и в свою очередь влиять на проявление первичной головной боли.
Следовательно, такие коморбидные состояния, как головная боль и нарушения сна, воздействуя одно на другое, способны модифицировать, утяжелять течение и приводить к хронизации друг друга.
Терапия
Взаимосвязь головной боли и нарушений сна должна учитываться при выборе терапевтической тактики.
Во-первых, рекомендации по режиму дня должны формироваться с учетом специфики головной боли. При одних формах цефалгии (мигрени, головной боли напряжения) недопустимо провоцировать боль депривацией сна, при других формах (кластерной головной боли) – избытком сна.
Во-вторых, назначая лечение пациентам с головной болью и нарушениями сна, необходимо руководствоваться пониманием степени и характера взаимоотношений этих состояний. Нельзя недооценивать значение мер по восстановлению сна в реабилитации пациентов с головной болью, с одной стороны, и важность купирования цефалгии для улучшения сна – с другой. Следовательно, терапевтическая программа для таких пациентов должна быть комплексной, учитывать специфику сочетания данных синдромов у конкретного пациента, а также нюансы влияния каждого рекомендуемого метода лечения на коморбидные синдромы (см. табл. 2).
Сказанное справедливо прежде всего в отношении фармакотерапии. В связи с этим приоритет имеют лекарственные средства, позитивно воздействующие на сон и одновременно с этим оказывающие противоболевой эффект, в частности препараты мелатонина. Ввиду того что на фоне их приема нормализуется циркадианный ритм и повышается продолжительность сна, они могут назначаться пациентам с различными вариантами головной боли (мигренью, кластерной головной болью, гипнической головной болью) как дополнительное средство медикаментозной терапии. Применение мелатонина в течение трех месяцев у пациентов с нарушениями сна и коморбидной головной болью позволило уменьшить интенсивность и частоту приступов [65]. У пациентов с мигренью прием мелатонина способствовал снижению выраженности болевого синдрома [66]. По результатам пилотного исследования с участием взрослых пациентов, страдающих мигренью и головной болью напряжения, после шестимесячного лечения мелатонином частота приступов головной боли и уровень влияния головной боли на качество жизни статистически достоверно снизились по сравнению с исходным уровнем [67].
Особая роль нейромедиаторов серотонина и аденозина в патогенезе и головной боли, и нарушений сна открывает дополнительные перспективы для использования препаратов, воздействующих на их метаболизм. С учетом связи между аденозином, сном и ноцицепцией, было изучено терапевтическое применение как агонистов аденозина, так и его антагонистов при первичных головных болях [68].
Уже давно известен противоболевой эффект антидепрессантов. Предполагают, что он вызван усилением активности норадренергических и серотонинергических систем, тормозящих проведение болевых импульсов по ноцицептивным путям в центральной нервной системе. Препараты из группы трициклических антидепрессантов обладают более выраженной противоболевой активностью, в то время как селективные ингибиторы обратного захвата серотонина и селективные ингибиторы обратного захвата серотонина и норадреналина вызывают меньше побочных эффектов. При этом антидепрессанты с двойным механизмом действия демонстрируют более длительный обезболивающий эффект, чем те, что влияют только на одну из аминергических систем [69, 70].
Доказано, что антидепрессанты улучшают сон и обладают психомодулирующим эффектом, что особенно важно с учетом особой роли тревожно-депрессивных расстройств в этиопатогенезе как цефалгий, так и расстройств сна [71].
Антиконвульсанты (топирамат и вальпроаты) применяются при профилактическом лечении мигрени и в терапии кластерных головных болей. Их действие связывают с влиянием на альфа-2-дельта-субъединицу потенциалзависимых кальциевых каналов типа N, выражающимся в уменьшении высвобождения глутамата и норадреналина. Препараты оказывают анальгетический эффект, снижая интенсивность боли непосредственно, а также опосредованно через улучшение сна [61].
Препараты для лечения головных болей сна и бодрствования идентичны, однако их прием должен быть по-разному распределен в течение суток. Это прежде всего касается не купирования приступа, а систематического профилактического лечения. С целью профилактики ночных приступов головных болей рекомендуется сдвигать время приема препаратов ко второй половине дня, постепенно увеличивая дозу.
Следует уделить особое внимание противоболевым препаратам, фармакокинетика которых позволяет эффективно использовать их для купирования ночных приступов, в частности анальгетикам пролонгированного действия. Одним из таких препаратов является нестероидный противовоспалительный препарат Бруфен СР. Его противоболевой эффект реализуется за счет неизбирательной блокады циклооксигеназы 1 и 2 и ингибирующего влияния на синтез простагландинов. Бруфен СР с пролонгированным действием достаточно принимать один раз в сутки (рекомендуется раннее вечернее время – 20:00 часов). В результате продолжительной фазы абсорбции в системном кровотоке дольше поддерживаются плазменные концентрации ибупрофена, что позволяет сохранить противоболевой эффект на протяжении всего ночного сна с последующей пролонгацией в дневное время. В результате улучшается качество сна и обеспечивается поддержание достаточной активности днем.
По данным клинических исследований, препарат Бруфен СР привел к значительному снижению показателя ночной боли (у 78% пациентов) и превзошел по эффективности ибупрофен немедленного высвобождения (58% пациентов, результаты достоверны) [72]. Кроме того, препарат Бруфен СР показал себя с более выгодной стороны по сравнению с диклофенаком замедленного высвобождения и по степени улучшения качества ночного сна (рис. 3) [73], и по уровню дневной активности. Следует также отметить хорошую переносимость препарата: о нежелательных явлениях со стороны желудочно-кишечного тракта сообщили значительно меньше пациентов, принимавших Бруфен СР, по сравнению с теми, кто получал диклофенак (13 и 50% соответственно, р = 0,002) [74].
В то же время некоторые препараты, проявляя эффект при одном состоянии, могут негативно влиять на другое. Так, бета-блокаторы, которые относятся к препаратам первой линии профилактической терапии частых приступов мигрени, снижают секрецию эндогенного мелатонина, что приводит к подавлению сигнала ко сну и может вызвать нарушения сна и его фрагментацию. Поэтому их прием ассоциируется с тяжелыми сновидениями и ночными пробуждениями. Трициклические антидепрессанты (амитриптилин), применяемые в терапии частых приступов мигрени, не только сокращают общую продолжительность сна, но и увеличивают утреннюю и дневную сонливость, а также нередко провоцируют ночные кошмары. Триптаны (например, Амигренин) – селективные специализированные препараты для купирования приступов мигрени – могут приводить к повышенной сонливости, что, по-видимому, является результатом прямого влияния на серотонинергическую систему. Бензодиазепины, назначаемые при нарушениях сна, могут не только усиливать головную боль, но и быть причиной ее возникновения. Головная боль из-за злоупотребления лекарственными средствами усиливается при применении препаратов, действующих на центральную нервную систему [61].
Наряду с фармакологическими препаратами существуют другие методы, с одной стороны, снижающие частоту и степень выраженности боли, с другой – нормализующие сон. Так, показано положительное влияние метода поведенческой модификации (правила гигиены сна) у пациентов с мигренью [75]. Метод подразумевает соблюдение следующих основных правил:
- планирование времени сна;
- исключение просмотра телепередач, чтения или музыки в постели;
- использование метода визуализации;
- ограничение приема пищи и жидкости перед сном;
- исключение дневного сна.
Улучшение гигиены сна способствовало сокращению частоты мигренозных приступов (трехкратному снижению) у детей дошкольного и школьного возраста [76].
Положительную роль при головных болях могут сыграть рекомендации об изменении образа жизни, соблюдении четкого графика сна – бодрствования (см. табл. 2), необходимости уменьшить употребление алкоголя и стимулирующих напитков [77].
Среди методов, эффективных в комплексной терапии рассматриваемых коморбидных синдромов, необходимо выделить психотерапию, что подтверждается многочисленными исследованиями, проведенными на группах пациентов с различными вариантами головных болей и нарушений сна [78, 79]. Данный метод считается основным методом лечения инсомнии и эффективен в терапии головных болей, в частности мигрени, головной боли напряжения, хронической боли. Когнитивно-поведенческая психотерапия подразумевает использование специфических методик, направленных на изменение поведения, связанного со сном/головной болью (поведенческая терапия) и представлений о своем сне/головной боли (когнитивная терапия). Это обусловлено тем, что техники, применяемые и в том, и другом случае, направлены, по сути, на одни и те же мишени: уменьшение уровня мышечного напряжения и стрессовых реакций, определение дисфункциональных убеждений в отношении проблемы и устранение катастрофизации и т.д. Эффективность когнитивно-поведенческой психотерапии наиболее высока и имеет высокий уровень доказательности, подтвержденный результатами многочисленных исследований и метаанализов.
В качестве других нелекарственных методов лечения можно отметить рефлексотерапию, фототерапию, массаж, дозированную физическую нагрузку.
Заключение
Нарушения сна и головной боли взаимообусловлены и могут инициировать развитие и/или усугублять течение друг друга, что во многом определяется общностью нейробиологического субстрата, а также опосредуется эмоционально-личностными расстройствами. Общие вызывающие их и сопутствующие заболевания (в частности, тревожно-депрессивные расстройства) еще больше видоизменяют и усложняют эту взаимосвязь, приводя к снижению качества жизни больных. Это диктует необходимость выявлять и учитывать коморбидность головных болей и нарушений сна в клинической практике и при подборе терапии. Развитие новых медикаментозных стратегий, воздействующих на таргетные специфические рецепторы, может дать новое понимание одновременно механизмов регуляции сна и отношений между системами сна и бодрствования и системами, генерирующими головную боль.
Е.A. Korabelnikova, MD, PhD, Prof., М.V. Zhuravleva, MD, PhD, Prof.
I.M. Sechenov First Moscow State Medical University
Scientific Centre for Expert Evaluation of Medicinal Products, Moscow
Contact person: Elena A. Korabelnikova, e_korabel@mail.ru
The review provides information on the comorbidity of headaches and sleep disorders. Pathophysiological and psychological mechanisms of their mutual influence on each other are considered. The characteristic of different types of headaches in the continuum of the cycle ‘sleep-wakefulness’ is given. Drug and non-drug approaches to treatment with indication of biochemical bases of action of drugs are considered in detail.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.