Некоторые вопросы ведения пациентов со скелетно-мышечными болевыми синдромами
- Аннотация
- Статья
- Ссылки
- English
Введение
Боль в нижней части спины является значимым симптомом и распространенной жалобой, с которой пациенты обращаются к врачам общего профиля, терапевтам, неврологам, ортопедам. Более 90% людей испытывали боль в нижней части спины хотя бы раз в жизни, у 13,8% длительность болей достигала двух недель за последние шесть месяцев, у 17% боли в спине стали хроническими, 11% испытывали социальную дезадаптацию из-за болевого синдрома.
Постоянный болевой синдром даже с интенсивностью до 4 баллов по визуальной аналоговой шкале (ВАШ) ограничивает трудовую деятельность, существенно снижает качество жизни, ведет к социальной дезадаптации [1–3]. В процессе хронизации боли в нижней части спины на первое место выходят психосоциальные факторы и неадаптивные стратегии поведения у пациентов.
Вопросы терминологии
Боль в нижней части спины включена в Международную классификацию болезней 10-го пересмотра (код М54.5) не как нозологический диагноз, а как широко распространенное состояние, нозологическую причину которого сложно установить.
В российской терминологии принято обозначать синдромологический диагноз латинскими терминами, не дающими представления о причинах формирования болевого синдрома. Например, термин «люмбалгия» – это всего лишь перевод вербализированной жалобы пациента на латинский язык. В англоязычных странах в подобных ситуациях применяется термин low back pain.
Описанная разница в терминах приводит к различиям в понимании причин болевого синдрома. В российской традиции пациенты связывают развитие у себя болевого синдрома с хроническими заболеваниями и неправильной трактовкой описания рентгенографической или нейровизуализационной картины (остеохондроз, «грыжа диска»). К сожалению, нередко специалисты также объясняют возникновение болевых синдромов имеющимися хроническими заболеваниями или структурными изменениями в опорно-двигательном аппарате. В свою очередь пациент с диагнозом low back pain («боль в нижней части спины») имеет представление, что болен исключительно «болью». Следовательно, лечение и все его действия будут направлены исключительно на купирование болевого синдрома, что может существенным образом снизить вероятность хронизации болевого синдрома.
Врач должен осознавать терминологические сложности как минимум для того, чтобы понимать самому и уметь объяснить пациенту основные постулаты:
-
боль в нижней части спины – не болезнь, а синдром;
-
боль в нижней части спины встречается при большом количестве заболеваний, вероятность установления точного нозологического диагноза при первичном обращении пациента не превышает 10–15%;
-
одна из основных диагностических задач врача, осуществляющего прием пациента с болью в нижней части спины, – это исключение серьезной патологии, требующей незамедлительного диагностического поиска.
Патогенез
Выдвигались различные концепции причин и патогенеза боли в нижней части спины. В настоящее время известно, что нет прямой зависимости между формированием болевого синдрома в нижней части спины и изменениями, в том числе в межпозвоночных дисках, выявляемыми при магнитно-резонансной томографии (МРТ). Такие МРТ-находки характерны не только для пациентов с острой болью в спине, но и для пациентов без болевого анамнеза [4]. Кроме того, дегенеративные изменения не коррелируют с возникновением боли в нижней части спины ни хронологически, ни анатомически и не считаются предиктором эффективности проводимой терапии.
На первый взгляд, кажется логичным и бесспорным влияние статических нагрузок, неудобной позы, подъема тяжести и скручиваний на развитие боли в нижней части спины. Однако анализ данных восьми систематических обзоров наличие подобной связи не подтвердил [5]. Популяционное исследование, проведенное голландскими клиницистами, выявило U-образную зависимость между физической нагрузкой и болью в нижней части спины. Риск развития боли в нижней части спины одинаково высок как у лиц, ведущих сидячий, малоподвижный образ жизни, так и у тех, кто регулярно получает выраженную физическую нагрузку [6].
Дегенеративно-дистрофические изменения опорно-двигательного аппарата, которые обнаруживаются посредством дополнительных методов обследования, являются не более чем фоном для развития болевого синдрома, но никак не его основной причиной. Они снижают функциональные возможности позвоночника, фасеточных суставов и сухожильно-мышечного аппарата, эластичность межпозвоночных дисков, а также ведут к изменению физиологических изгибов, преимущественно в области шейного и поясничных отделов позвоночника, несущих максимальные нагрузки в статичном положении. В результате нагрузка распределяется неоптимально, развивается рефлекторный мышечный ответ, компенсирующий нагрузку на суставы и связки позвоночника.
Мышечный спазм – это еще одна причина возникновения болевого ощущения, которая дополняет имеющиеся источники – суставы позвоночника, связки. Возникает патологический болевой круг – мышечный спазм усугубляет имеющуюся связочно-суставную патологию. Следствием болевого ощущения становится фобическое ограничение двигательной нагрузки и нарушение функционирования сложившегося привычного двигательного стереотипа. Если человек продолжает выполнять движения в прежнем объеме и имеет факторы риска, то нагрузка перераспределяется на «неподготовленные» связки, суставы и мышцы, что при многократном воспроизведении приводит к «расползанию» области боли [3, 4].
Боль в нижней части спины – это многофакторное состояние, которое развивается вне зависимости от возраста и социального статуса, уровня двигательной активности и степени выраженности факторов риска боли в нижней части спины. Наличие сопутствующих поражений суставов позвоночника, факторов риска и степень их выраженности в рамках какой-либо патологии влияют только на риск хронизации болевого синдрома.
Болью в нижней части спины проявляются остеоартроз и другие ревматологические заболевания (например, ревматоидный артрит), сопровождающиеся поражением фасеточных суставов позвоночника. Остеоартроз – это группа заболеваний, имеющих различную этиологию, но приводящих к однотипному биологическому, морфологическому и клиническому исходу. В основе остеоартроза лежит поражение гиалинового хряща и субхондральных отделов костей, хотя гипертрофии подвергаются и все остальные ткани внутри и вокруг пораженных суставов. Обычно первые клинически асимптомные изменения возникают во втором или третьем десятилетии жизни, а к 70-летнему возрасту они отмечаются практически у 100%. В активном трудоспособном возрасте почти у всех людей имеются патологические изменения в опорных суставах, хотя клинические симптомы наблюдаются у немногих. Заболеванию одинаково подвержены и мужчины, и женщины, но у мужчин оно дебютирует раньше [2]. Остеоартроз начинается незаметно и постепенно как невоспалительное заболевание, обычно поражается только один или небольшое число суставов. Самый ранний симптом – боль, обычно усиливающаяся при нагрузке на суставы. Отмечается также утренняя скованность после периода покоя, но она длится недолго (не более 15–30 минут) и ослабевает в результате движений.
Диагностика
Вторичный генез боли – «красные флажки»
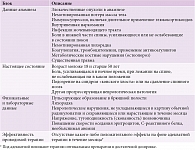
В настоящее время различают специфический и неспецифический болевой синдром в нижней части спины, радикулярную боль. По разным данным, на так называемые неспецифические болевые синдромы в нижней части спины приходится от 75 до 85%. Для исключения возможного вторичного генеза болевого синдрома и его развития на фоне имеющегося сопутствующего заболевания на первичном приеме необходимо обратить внимание на так называемые красные флажки (red flags). «Красные флажки» – это клинические признаки возможных серьезных заболеваний, которые необходимо целенаправленно выявлять при расспросе и осмотре пациента. Для удобства практического врача они делятся на блок анамнестических данных, данных настоящего обследования/расспроса и объективного осмотра, отдельно выделен пункт оценки эффективности адекватной проводимой терапии (таблица). При наличии у пациента перечисленных симптомов врач должен прежде всего определить источник болевого синдрома и только потом его купировать. Выполнить поставленную задачу возможно путем поиска чего-то большего, чем неспецифические дегенеративные изменения, которые могут быть выявлены посредством простой рентгенографии [1].
Факторы хронизации боли – «желтые флажки»
Один из главных принципов терапии – это применение адекватного и эффективного обезболивания, поскольку болевой синдром в течение длительного времени приводит к усилению факторов хронизации боли. Анализ факторов хронизации болевого синдрома, или так называемых желтых флажков (yellow flags), – важная составляющая диагностики на ранних этапах помощи пациенту с болью в нижней части спины. При поиске «желтых флажков» учитывают собственное представление пациента о значимости и важности его болевого синдрома, о причинах, приведших к боли. Оценивают правильность представлений пациента о болевом синдроме, отношение пациента к боли, есть ли повышенная катастрофизация. Проводят оценку двигательного стереотипа пациента, адекватности его действий и механизма передвижения – использование при перемещении вспомогательных средств (трость, костыль, кресло-каталка) и обоснованность их применения. Выделяют признаки кинезиофобии и патологического болевого поведения. Оценивают социально-средовые факторы – заинтересован ли пациент в нетрудоспособности, есть ли рентные установки. Наконец, проводят оценку эмоционального состояния пациента, обнаруживая значимые в клиническом плане нарушения.
Дополнительные диагностические методы, такие как компьютерная и магнитно-резонансная томография, рентгенография, денситометрия, информативны исключительно для диагностики «красных флажков» при соответствующих показаниях. Учитывая несовершенную правовую систему, зачастую дополнительные методы обследования призваны подтвердить выставленный диагноз. В то же время высокий процент «случайных находок» и неспецифических изменений, роль которых в развитии болевого синдрома неочевидна для пациентов, существенным образом увеличивает стоимость лечения. Дефицит времени у лечащего врача для разъяснения механизма формирования болевого синдрома, а также бытующие среди пациентов неправильные представления повышают риск хронизации болевого синдрома.
Лечение
Международные профессиональные сообщества и общества по изучению болевых синдромов (Международная ассоциация по изучению боли (International Association for the Study of Pain), Российское межрегиональное общество по изучению боли) рекомендуют применять комплексную терапию. Она должна включать лекарственные средства, купирующие болевой синдром, – нестероидные противовоспалительные препараты (НПВП), препараты, снижающие выраженность рефлекторного мышечно-тонического синдрома, – миорелаксанты, а также препараты, действующие на центральное звено антиноцицепции, – антидепрессанты.
При острой неспецифической боли в нижней части спины важно информировать пациента о причинах возникновения болевого синдрома, прогнозе и достаточности проведенных методов обследования. Кроме того, необходимо обучить больного приемам лечебной гимнастики, рекомендовать избегать гиподинамии и сохранять повседневную активность. Из лекарственной терапии на данном этапе возможно назначение НПВП для проведения максимально быстрого обезболивания и возвращения к нормальной повседневной активности до начала формирования болевых поведенческих реакций. По той же причине в период до 12 недель (острая боль) не рекомендовано применение в виде монотерапии физиолечения, массажа, мануальной терапии [1].
НПВП: механизм действия, побочные эффекты, формы выпуска
Одним из основных постулатов международных рекомендаций по ведению пациентов с болью в нижней части спины является эффективное обезболивание, достигаемое назначением анальгетических средств, чаще всего препаратов из группы НПВП. Механизм действия НПВП связан с блокированием фермента циклооксигеназы (ЦОГ), регулирующего образование простагландинов из арахидоновой кислоты.
Изоформа ЦОГ-1 обладает функциональной активностью структурного (housekeeping) фермента, экспрессируется в большинстве клеток, регулирует продукцию простагландинов, участвующих в обеспечении нормальной (физиологической) функциональной активности клеток.
Изоформа ЦОГ-2 в норме отсутствует в большинстве тканей, но ее экспрессия существенно увеличивается на фоне воспаления, главным образом под влиянием «провоспалительных» цитокинов, и подавляется «антивоспалительными» медиаторами (кортизолом) и цитокинами (интерлейкином 4).
Согласно современным представлениям положительные терапевтические эффекты НПВП (противовоспалительное, анальгетическое и жаропонижающее действие) связаны со способностью препаратов ингибировать ЦОГ-2, в то время как наиболее часто встречающиеся побочные эффекты (поражение желудочно-кишечного тракта, почек, нарушение агрегации тромбоцитов) – с подавлением активности ЦОГ-1.
Нежелательные эффекты, опосредуемые через ЦОГ-1, не ограничиваются слизистой органов желудочно-кишечного тракта. Известно, что применение аспирина может приводить к бронхообструкции. Снижение простагландина Е2 и простациклинов в почках ведет к ухудшению почечного кровотока, ишемии и снижению скорости клубочковой фильтрации. Даже краткосрочное применение НПВП может ускорять дегенерацию хрящевой ткани. В то же время НПВП – высокоселективные ингибиторы ЦОГ-2, действие которых предположительно должно было ограничиваться очагом воспаления, по данным крупномасштабных рандомизированных исследований, приводило к риску развития сердечно-сосудистых осложнений. Так, в исследовании VIGOR (n = 8076) было показано, что в группе, принимавшей селективный ЦОГ-2-ингибитор, наряду с достоверным снижением частоты осложнений со стороны желудочно-кишечного тракта на более чем 50% отмечался четырехкратный рост инфаркта миокарда [7]. Таким образом, необходимо учитывать индивидуальные особенности пациентов и факторы риска, связанные с приемом НПВП.
Помимо выбора препарата из той или иной группы НПВП врач должен иметь представление о формах выпуска лекарственного средства и конкретно указать пациенту способ применения анальгетика. В повседневной практике регулярно встречаются пациенты, которые самостоятельно выбирают формы лекарственного средства на основании неадекватных представлений о безопасности и эффективности.
С инъекционными формами препаратов пациенты связывают надежды на большую эффективность и меньшее количество побочных реакций со стороны желудочно-кишечного тракта. Популярны и ректальные формы НПВП, также из-за ожиданий низких рисков побочных реакций со стороны желудочно-кишечного тракта, что, однако, зависит от механизма действия, а не от пути введения лекарственного средства.
Между тем при учете соотношения «риск – польза» возможные осложнения инъекционных форм всегда преобладают над таковыми пероральных форм. Риски внутримышечных инъекций очевидны: начиная с боли при введении, гематом, локального некроза кожи и подкожной жировой клетчатки, некротизирующего фасциита, местных инфекционных осложнений и заканчивая заражением гепатитами и вирусом иммунодефицита человека.
Во всем мире применение инъекционных форм оправданно при наличии тошноты и рвоты, невозможности глотания и нарушениях сознания. Однако общая статистика применения инъекционных форм НПВП свидетельствует о слишком широких показаниях к их назначению, подверженности «мифам» не только пациентов, но и врачей, которые так же, как и больные, верят в безопасность и эффективность инъекционных и ректальных форм. К сожалению, статистика назначения инъекционных форм в Российской Федерации соответствует уровню Мексики и развивающихся стран Африки и демонстрирует доминирование инъекционных форм над пероральными, в том числе таблетированными (рисунок) [8].
Таким образом, очевидной становится необходимость назначения пациенту с болью в нижней части спины на первом этапе средства с быстрым развитием эффекта и удобной формой введения. Во-первых, применение препарата, отвечающего указанным характеристикам, приведет к снижению выраженности болевого синдрома. Во-вторых, адекватное обезболивание снизит риски развития хронического болевого синдрома и, кроме того, повысит авторитет врача. Назначая препарат, оказывающий выраженное противовоспалительное и обезболивающее действие, необходимо обязательно информировать пациентов о специфических побочных реакциях, свойственных каждой из групп НПВП.
Преимущества препарата Артрозилен
Одним из препаратов, отвечающих соответствующим требованиям, является производное пропионовой кислоты – кетопрофен, оказывающий выраженное обезболивающее, противовоспалительное и жаропонижающее действие [2]. В сравнении с классическими содержащими кетопрофен препаратами Артрозилен состоит из рацемической смеси, из компонентов которой только S-изомер ингибирует ЦОГ. Лизиновая соль кетопрофена имеет лучшие фармакокинетические и фармакодинамические характеристики, в том числе обладает большей растворимостью, что способствует ускоренной абсорбции препарата. Пиковая концентрация лизиновой соли кетопрофена (Артрозилен) в сыворотке крови достигается через 15 минут после приема пероральной формы, а не через 60 минут, как после применения кетопрофена. Достоверное снижение выраженности болевого синдрома по сравнению с плацебо возникает через 30 минут после перорального приема.
Особенностью Артрозилена является высокая растворимость, позволяющая создавать инъекционные формы с физиологическим уровнем рН с минимумом реакций раздражения и повреждения тканей в месте введения препарата (не показано значимого повышения креатинфосфокиназы при внутримышечном введении).
Лизиновая соль кетопрофена (Артрозилен) характеризуется периферическим эффектом, блокируя ЦОГ, угнетая синтез простагландина Е2. Помимо своего воздействия на циклооксигеназу кетопрофен ингибирует липоксигеназный путь прохождения каскада арахидоновой кислоты, ведущий к снижению синтеза лейкотриенов.
Препарат обладает также и центральным действием, что связано с подавлением синтеза оксида азота и ЦОГ в головном мозге. Показано, что после приема Артрозилена в крови повышается уровень бета-эндорфинов и достоверно снижается уровень субстанции Р, чего не происходит при приеме других НПВП (например, ацетилсалициловой кислоты).
Артрозилен имеет несколько форм выпуска: капсулы по 320 мг (прием один раз в сутки), свечи по 160 мг (один-два раза в сутки), ампулы с раствором для внутримышечного или внутривенного введения по 160 мг (один-два раза в сутки), местные формы – 5%-ный гель и 15%-ный спрей.
В третьем неврологическом отделении клиники нервных болезней Университетской клинической больницы № 3 Первого МГМУ им. И.М. Сеченова в течение восьми месяцев проводился анализ эффективности и безопасности применения Артрозилена. Препарат (320 мг один раз в день перорально или 160 мг внутримышечно один раз в день, коротким курсом в течение трех – семи дней) получали 445 пациентов, проходивших стационарное лечение. Соотношение мужчин и женщин составило 1:3,4, средний возраст – 57,71 ± 23,11 года, средняя длительность болевого синдрома, с которым пациент обратился в отделение, колебалась в диапазоне от нескольких месяцев до более чем десяти лет с периодическими обострениями. Длительность последнего обострения, которое послужило причиной госпитализации, составила 3,17 ± 1,83 недели.
Диагнозы пациентов были представлены следующими нозологиями: головная боль напряжения (n = 56), люмбоишиалгия (n = 221), люмбалгия (n = 24), торакалгия (n = 20), цервикалгия (n = 37), цервикобрахиалгия (n = 40), цервикокраниалгия (n = 21), другое (болезнь Бехтерева, туннельные невропатии, постгерпетическая невралгия, гонартроз, кокцигодиния, комплексный регионарный болевой синдром – n = 26).
При поступлении в отделение и по завершении курса стационарного лечения (на момент выписки) пациенты проходили обследование, включавшее оценку интенсивности болевого синдрома, которая составила 7,37 ± 2,41 и 2,79 ± 1,7 балла по ВАШ соответственно.
С учетом высокой гетерогенности группы нет возможности предоставить единые данные по всем группам, однако в группе пациентов с болями в нижней части спины помимо оценки интенсивности боли по ВАШ проводилась оценка выраженности инвалидизации по Освестри (Oswestry Disability Index). Для пациентов с болью в нижней части спины этот показатель составил 65,29 ± 19,44% при поступлении и 39,18 ± 9,15% при выписке.
Необходимо отметить, что пациентам проводилась комплексная терапия. Помимо Артрозилена в суточной дозе 320 мг перорально или 160 мг внутримышечно больные принимали миорелаксанты, антидепрессанты (трициклические антидепрессанты и селективные ингибиторы обратного захвата серотонина). Пациенты также получали физиотерапевтическое лечение, массаж, мануальную терапию и локальное лечение боли в виде инъекций в проекции триггерных точек и периартикулярно глюкокортикостероидов и местных анестетиков. Нескольким пациентам помимо введения глюкокортикостероидов и местных анестетиков были проведены локальные лечебно-диагностические блокады с Артрозиленом и местными анестетиками. Если интенсивность боли после окончания курса приема Артрозилена снижалась и сумма баллов по ВАШ составляла менее 4, то НПВП отменялся, если нет, то пациенты продолжали получать терапию умеренно-селективными НПВП. Все пациенты оценили эффективность препарата Артрозилен как «хорошую». В то же время надо отметить, что шесть пациентов сообщили о побочных реакциях – двое о тяжести и дискомфорте в эпигастральной области, не достигающих значимой выраженности, и четверо – о выраженной боли в месте введения препарата (двое из них отказались от продолжения курса лечения).
Другие методы лечения
При развитии хронических болей в нижней части спины или при приеме неселективных или суперселективных НПВП может возникнуть необходимость изменить схему лечения ввиду рисков развития групп-специфических для НПВП побочных реакций, а также изменения цели проводимой терапии. Если при остром болевом синдроме пациенты нуждаются в быстром и адекватном обезболивании, то при хроническом болевом синдроме основной задачей терапии становится поддержание уровня социальной и физической активности пациента. С этой целью проводится лечебная гимнастика, корректируется мышечный тонус путем назначения препаратов (миорелаксантов) или проведения реабилитационных мероприятий. Среди последних можно выделить массаж, мануальную и когнитивно-поведенческую терапию, купирование неадекватного болевого поведения и кинезиофобических нарушений при помощи антидепрессантов и/или разъяснения пациенту причин, приводящих к формированию болевого синдрома.
Хондропротекторы
Относительно новым разделом в лечении хронических болевых синдромов в нижней части спины является вопрос обоснованности и целесообразности назначения препаратов из группы хондропротекторов. Действие препаратов, вероятно, обусловлено восстановлением или замедлением распада структурных элементов хрящевой ткани. Предположительно хондропротекторы относятся к препаратам с патогенетическим влиянием на дегенеративно-дистрофические процессы в суставах.
При всем множестве препаратов из группы хондропротекторов, в том числе активно продвигаемых производителями, очень мало средств имеет хотя бы минимальную доказательную базу. Так, структурно-модифицирующий эффект доказан только для хондроитина сульфата, глюкозамина, неомыляемых соединений экстрактов масел бобов сои и авокадо, диацереина, гиалуроновой кислоты [9]. В то же время сотни исследований эффективности лекарственных средств из группы хондропротекторов, на основании которых опубликовано множество статей, имеют дизайн, не соответствующий критериям доказательной медицины. Так, регулярно сравниваются пациенты разных возрастных групп, с разными нозологическими формами заболевания, без плацебоконтроля или дополнительных методов обследования. В то же время в исследованиях, проводившихся с плацебоконтролем, не наблюдалось достоверной разницы, а объективизация при помощи дополнительных методов исследования не показывала нарастания хрящевой ткани. Однако построение дизайна клинического исследования – это очень сложный и дорогостоящий процесс, спорным остается вопрос выбора препарата для плацебоконтроля и метода объективизации. Все это только увеличивает стоимость и без того недешевого процесса разработки и производства препарата.
Учитывая вышесказанное, при выборе препарата имеет смысл опираться на средства, имеющие доказанный симптом- и структурно-модифицирующий эффект. Кроме того, можно руководствоваться рекомендациями авторитетных международных сообществ.
Так, среди препаратов, имеющих доказанную симптоматическую эффективность и оказывающих структурно-модифицирующее действие, можно выделить Пиаскледин (неомыляемые соединения бобов сои и авокадо) [2]. В экспериментах было доказано, что Пиаскледин ингибирует интерлейкин 1, стимулирует синтез коллагена и протеогликанов. В хондроцитах человека Пиаскледин угнетает синтез коллагеназы, стромелизина, интерлейкинов 6 и 8, а также простагландина Е2. Помимо стимуляции синтеза межклеточного вещества гиалинового хряща (протеогликанов и коллагеновых волокон), присущей и другим структурно-модифицирующим препаратам, Пиаскледин повышает экспрессию трансформирующего фактора роста бета-1 и бета-2, а также ингибитора активатора плазминогена 1. С одной стороны, трансформирующий фактор роста бета-1 входит в число самых мощных стимуляторов синтеза макромолекул хряща, с другой – тормозит их деградацию. Ингибитор активатора плазминогена 1 угнетает его продукцию и участие в повреждении хряща, которое осуществляется как через стимуляцию металлопротеиназ, так и вследствие прямого воздействия на хрящ, активируя деградацию протеогликанов [10, 11].
Пиаскледин выпускается в капсулах по 300 мг, в которых содержится 2/3 экстракта масла плодов сои и 1/3 экстракта авокадо. Пиаскледин принимают по одной капсуле в день в течение шести месяцев, курс лечения повторяют через полгода.
Необходимо отметить, что эффективность Пиаскледина, проявляющаяся в замедлении дегенерации суставного хряща у больных с артрозами, была показана в нескольких рандомизированных плацебоконтролируемых исследованиях [12, 13]. Вывод о структурно-модифицирующем действии Пиаскледина был сделан слепым методом по данным заключений независимых экспертов на основании динамики ширины суставной щели тазобедренных суставов в сравнении с исходными значениями.
F. Blotman и соавт. доказали эффективность Пиаскледина у 164 пациентов с коксартрозом и гонартрозом [14]. Аналогичные результаты были получены E. Maheu и соавт. и T. Appelboom и соавт. на 260 пациентах с гонартрозом. M. Lequesne и соавт. установили структурно-модифицирующий эффект Пиаскледина на 163 пациентах с коксартрозом, выраженность изменений у которых оценивалась рентгенологически [2]. Представленные данные позволили включить препарат в рекомендации Европейской антиревматической лиги (European League Against Rheumatism – EULAR) по лечению гонартроза и коксартроза.
Постмаркетинговые исследования безопасности применения Пиаскледина подтвердили его хорошую переносимость и безопасность. При сравнении Пиаскледина (режим приема однократно) с препаратами хондроитина сульфата (прием от одного до трех раз в день в зависимости от производителя) достоверных различий по выраженности положительного эффекта обнаружено не было [14, 15].
Заключение
В соответствии с международными рекомендациями пациенты с болями в нижней части спины прежде всего нуждаются в эффективном обезболивании. С этой целью допустимо применение препарата первой линии – кетопрофена лизиновой соли (Артрозилен) – кратким курсом с последующей заменой на препарат из группы умеренно селективных НПВП или отменой НПВП. При этом следует обязательно учитывать возможные побочные эффекты такого лечения, проводить их мониторинг и информировать о них пациентов.
В рамках продолжения терапии хронического болевого синдрома, учитывая сложность выделения нозологической формы у конкретного пациента, помимо проведения активной двигательной реабилитации, лечебной физической культуры, когнитивно-поведенческой терапии возможно добавление к лекарственной терапии хондропротектора Пиаскледина (неомыляемые соединения экстрактов масел бобов сои и авокадо). Пиаскледин – это один из немногих хондропротекторов, симптом- и структурно-модифицирующее действие которого доказано в плацебоконтролируемых исследованиях. Результаты оценки морфологических изменений позволили включить препарат в рекомендации EULAR.
A.V. Alekseyev, O.A. Chernenko, O.O. Drokonova, A.Yu. Emelyanova, N.D. Samkhayeva
Sechenov First Moscow State Medical University
Contact person: Aleksey Valeryevich Alekseyev, alekseevalexeyv@mail.ru
Practical aspects of managing patients with acute and chronic pain syndromes, rationale for selecting therapy in inpatient and outpatient setting are discussed. Methods for efficient anesthesia with ketoprofen lysine salt (Artrosilene) as well as feasibility and justification for applying avocado/soybean unsaponifiable components (Piascledine) are considered in the paper.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.
![Рисунок. Госпитальные закупки НПВП в 2010 г. (по В.Г. Барсковой) [8]](/upload/resize_cache/iblock/aef/195_350_1/dileo_pic.jpg)


