Нерешенные вопросы в лечении остеоартрита. IV Евразийский конгресс ревматологов. Симпозиум компании MSD
- Аннотация
- Статья
- Ссылки



Остеоартроз или остеоартрит: спор о терминологии и подходах к лечению
Остеоартрит (ОА) – мультифакторное хроническое прогрессирующее заболевание суставов, характеризующееся фокальным разрушением суставного хряща, изменениями в субхондральной кости, синовиальной оболочке, образованием остеофитов. Как отметила руководитель отдела метаболических заболеваний костей и суставов с центром профилактики остеопороза Научно-исследовательского института ревматологии им. В.А. Насоновой (НИИР), д.м.н., профессор Людмила Ивановна АЛЕКСЕЕВА, переименование остеоартроза в остеоартрит позволило подчеркнуть важную роль персистирующего воспаления в развитии заболевания, способствующего прогрессированию дегенеративных изменений в тканях.
Данное заболевание как дегенеративное и пролиферативное впервые было описано в 1839 г. профессором A. Colles. Длительное время ОА, или остеоартроз, рассматривался как следствие механической перегрузки сустава и уязвимости хрящевого матрикса. Представление об ОА как о дегенеративно-дистрофической патологии сформировалось в середине 1980-х гг. Научный прогресс позволил изменить парадигму развития ОА. В настоящее время основная роль в патогенезе данного заболевания отводится воспалению1.
Развитие ОА напоминает ответную реакцию организма на внедрение чужеродного агента вследствие травмы, инфекции и др. Активация Толл-подобных рецепторов (Toll-Like Receptor – TLR) с последующей активацией компонентов системы комплемента в суставе обусловливает возникновение синовита и эрозий хряща, а также повреждение других тканей сустава. Поскольку повреждение сустава начинается с воспаления синовиальной оболочки, синовит рассматривается как предиктор не только развития, но и прогрессирования остеоартрита2.
Острое или хроническое повреждение тканей сустава в свою очередь приводит к образованию матричных молекул, компонентов системы комплемента, высвобождающихся в синовиальную жидкость. В результате активируются TLR и каскад комплемента. Создается порочный круг воспалительного процесса.
Согласно последним данным, остеоартрит следует рассматривать как аномальное ремоделирование тканей сустава (костной, хрящевой, синовиальной), определяемое воспалительными медиаторами3–8.
Серьезным фактором риска развития ОА является ожирение. Увеличение массы тела ассоциируется не только с возрастанием механической нагрузки на сустав, но и с увеличенной продукцией адипокинов и провоспалительных цитокинов, вызывающих поражение хряща, костной ткани и синовиальной оболочки9.
На данный момент лечение ОА направлено на уменьшение боли, улучшение функции сустава и предупреждение прогрессирования патологического процесса.
В клинической практике среди фармакологических методов наиболее широко применяются нестероидные противовоспалительные препараты (НПВП). Согласно современным алгоритмам лечения, они могут назначаться как для курсового, так и для постоянного приема.
Селективный ингибитор циклооксигеназы (ЦОГ) 2 эторикоксиб (Аркоксиа®, компания MSD) обладает высокой биодоступностью, а также хорошей противовоспалительной и анальгетической активностью. Доказательная база в отношении последних двух эффектов эторикоксиба при ОА достаточно убедительная – восемь исследований с участием более 4400 больных.
Согласно результатам рандомизированного исследования, в котором сравнивали эффективность и переносимость эторикоксиба в дозе 60 мг/сут и напроксена в дозе 1000 мг/сут, в отношении первого показателя препараты оказались сопоставимыми, в отношении второго – зафиксировано достоверное преимущество эторикоксиба. Так, в течение 138 недель лечения эторикоксиб продемонстрировал более благоприятный профиль безопасности со стороны желудочно-кишечного тракта (ЖКТ) у пациентов с ОА по сравнению с напроксеном10.
В другом рандомизированном плацебоконтролируемом исследовании больные ОА в течение 12 недель получали эторикоксиб 30 мг/сут (n = 214), ибупрофен 2400 мг/сут (n = 210) или плацебо (n = 104). Эффективность в отношении уменьшения боли, скованности, улучшения функции суставов у эторикоксиба и ибупрофена была аналогичной. Однако терапия эторикоксибом переносилась лучше11.
Эторикоксиб и целекоксиб – два препарата, относящиеся к селективным ингибиторам ЦОГ-2. В исследовании C.O. Bingham и соавт. (2007) эффективность и безопасность эторикоксиба в минимальной дозе 30 мг/сут не отличались от таковых целекоксиба в дозе 200 мг/сут. Длительность лечения больных ОА составила 26 недель12.
В 2017 г. B.R. da Costa и соавт. (2017) провели метаанализ 76 рандомизированных исследований с участием более 58 тыс. больных ОА. Ученые оценивали эффективность разных классов НПВП и их доз. Парацетамол оказался клинически неэффективным. Лучший результат в отношении снижения боли и восстановления функции суставов зафиксирован на фоне терапии диклофенаком в максимальной дозе 150 мг/сут. Эторикоксиб в дозе 60 мг/сут купировал боль так же эффективно, как диклофенак13.
Согласно результатам метаанализа 2018 г., эторикоксиб, целекоксиб и ацеклофенак занимают самые высокие позиции среди НПВП по уменьшению болевого синдрома, оцениваемого с помощью индекса выраженности ОА Университетов Западного Онтарио и МакМастера (Western Ontario and McMaster Universities Osteoarthritis Index – WOMAC)14.
Большой интерес представляют результаты метаанализа, проведенного X. Feng и соавт. (2018). Установлено, что терапия эторикоксибом у больных ОА и РА не увеличивала риск развития нежелательных явлений (НЯ) со стороны ЖКТ. При этом в отличие от применения диклофенака и напроксена прием эторикоксиба ассоциировался с уменьшением такого риска15.
Изучению влияния эторикоксиба на периферическую и центральную сенситизацию у 37 пациентов с болевым синдромом при ОА коленных суставов было посвящено рандомизированное двойное слепое плацебоконтролируемое четырехнедельное перекрестное исследование, проведенное L. Arendt-Nielsen и соавт. Ученые оценивали порог болевой чувствительности в области коленного сустава, расширение зоны гипералгезии (изменение болевой чувствительности в области голени). В группе эторикоксиба по сравнению с группой плацебо в области коленного сустава и голени порог чувствительности достоверно повышался (восприимчивость болевых рецепторов к стимулам снижалась)16.
Согласно результатам исследования P. Moss и соавт. (2017), через 14 дней приема эторикоксиба в дозе 60 мг/сут у 80 пациентов с ОА коленных суставов выраженность боли по WOМAC уменьшилась на 32,6%, общий счет по опроснику Pain DETECT – на 23,6%. Кроме того, зафиксировано снижение других показателей нейропатической боли17.
Эффективность эторикоксиба доказана у 500 пациентов с ОА при недостаточном ответе на другие анальгетики (целекоксиб, мелоксикам, парацетамол, диклофенак и др.). Перевод этих больных на эторикоксиб (препарат Аркоксиа®) в дозе 60 мг/сут в течение четырех недель способствовал снижению боли при ходьбе по ровной поверхности на 30% и более по визуальной аналоговой шкале18.
Таким образом, результаты исследований подтверждают анальгезирующую и противовоспалительную эффективность и хорошую переносимость эторикоксиба в терапии остеоартрита и других воспалительных артритов, сопровождающихся болью.
Чем, сколько и как лечим остеоартрит
По словам заведующего лабораторией патофизиологии боли и клинического полиморфизма скелетно-мышечных заболеваний НИИР, д.м.н. Андрея Евгеньевича КАРАТЕЕВА, остеоартрит – заболевание с четкими клиническими проявлениями, важнейшим из которых считается болевой синдром.
Боль при ОА не только неприятный симптом, но и признак прогрессирования заболевания. Это подтверждено данными двух метаанализов. Один из них был посвящен оценке рентгенологического прогрессирования остеоартрита (79 исследований), другой – его клиническому прогрессированию (38 исследований). Авторы этих двух работ пришли к единому заключению: уровень боли является первостепенным фактором риска прогрессирования остеоартрита19, 20. Именно поэтому одним из важных направлений комплексной терапии является купирование основных симптомов, в первую очередь боли.
P.G. Conaghan и соавт. (2015) провели опрос 1187 больных ОА из шести стран Европы. Все опрошенные не менее 14 дней получали активную терапию по поводу ОА. Эффективность лечения оценивали по краткому опроснику оценки боли (Brief Pain Inventory – BPI). Терапия признавалась неадекватной при значениях более четырех баллов. Согласно полученным данным, 54% пациентов с ОА, несмотря на проводимую обезболивающую терапию, оказались неудовлетворены лечением21.
При ОА применяются препараты быстрого (НПВП, парацетамол, опиоиды, в/с глюкокортикостероиды) и замедленного действия (хондропротекторы, в/с гиалуронат, препараты аутологичной обогащенной тромбоцитами плазмы, антидепрессанты, антиконвульсанты), а также физиотерапия и реабилитация. С чего следует начинать терапию? По мнению докладчика, важно назначать быстро- и медленнодействующие средства в комплексе и использовать в дебюте препараты, которые быстро купируют боль. Их применение в начале лечения позволит добиться хорошей комплаентности.
При выборе терапии следует учитывать фенотип заболевания – локализацию поражения, происхождение боли и ее интенсивность, степень структурных и функциональных изменений, наличие синовита и т.д.
Выбирая препарат, необходимо также установить наличие коморбидных патологий, которые способны утяжелить течение остеоартрита. Так, в исследовании LOGICA при опросе 374 ревматологов в отношении наличия коморбидности у 3293 больных ОА установлено, что высокий и средний сердечно-сосудистый риск имел место у подавляющего большинства пациентов (44,2 и 28,5% соответственно). Высокий и средний риск в отношении патологий ЖКТ отмечен в 22,3 и 64,3% случаев22.
В рамках масштабного исследования КОРОНА-2, проведенного в России и восьми странах СНГ, были опрошены 21 185 больных, нуждавшихся в приеме НПВП. У них выявляли факторы риска развития осложнений со стороны органов ЖКТ и сердечно-сосудистой системы. Высокий и средний риск развития ЖКТ-осложнений зафиксирован у 67,4% пациентов (29,0 и 38,4% соответственно), сердечно-сосудистых событий – у 67,1% (23,0 и 44,1%), одновременно ЖКТ-осложнений и сердечно-сосудистых событий – у 35,2% респондентов (10,8 и 24,4%)23.
A. Mendy и соавт. оценивали риск летального исхода у 51 928 пациентов, 40,6% из которых страдали остеоартритом. У больных ОА риск летального исхода от сердечно-сосудистых заболеваний был выше на 43%, от диабета – на 50%24.
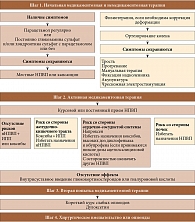
Согласно последним клиническим рекомендациям, лечение ОА должно быть ступенчатым (рис. 1).
Особое место в терапии ОА отводится НПВП. В настоящее время их можно назначать как для постоянного, так и курсового приема. Эффективность этих препаратов при ОА доказана результатами ряда исследований. При этом существует линейная зависимость эффекта от дозы НПВП13.
Каковы преимущества эторикоксиба перед другими НПВП? При пероральном приеме эторикоксиб имеет достаточно высокую, не связанную с белками крови фракцию (8%), способен проникать через гематоэнцефалический барьер, оказывать центральное действие (блокировать механизмы развития центральной сенситизации).
Терапия эторикоксибом 60 мг/сут в течение 14 дней существенно снижала интенсивность боли у пациентов с ОА, оцениваемую по шкале WOMAС, индексу гипералгезии и опроснику Pain DETECT16. Применение эторикоксиба в дозе 60 мг/сут в течение 138 недель позволяло уменьшать выраженность боли в два раза и удерживать достигнутый результат на протяжении всего периода исследования10.
Эторикоксиб является селективным ингибитором ЦОГ-2, поэтому в отличие от неселективных НПВП (нНПВП) характеризуется лучшим профилем безопасности в отношении развития осложнений со стороны ЖКТ.
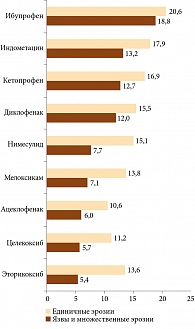
В подтверждение сказанному А.Е. Каратеев представил данные реальной клинической практики. Так, анализ результатов эзофагогастродуоденоскопии 6341 больного (82,9% женщины), проходившего обследование в НИИР с 2007 по 2016 г., продемонстрировал хороший профиль безопасности эторикоксиба (препарат Аркоксиа®). За указанный период только у 5,4% пациентов, принимавших препарат, были выявлены эндоскопические язвы и множественные эрозии. Кроме того, в отличие от диклофенака терапия эторикоксибом реже приводила к развитию язв и множественных эрозий ЖКТ, даже у пациентов с такими факторами риска, как язвенная болезнь в анамнезе, прием низких доз ацетилсалициловой кислоты, возраст старше 65 лет. Частота указанных событий в группах эторикоксиба и диклофенака составила 5,4 и 12% соответственно (рис. 2).
Завершая выступление, А.Е. Каратеев отметил, что лечение больным ОА необходимо подбирать в соответствии с их индивидуальными особенностями и клинической ситуацией, это в равной степени относится и к выбору конкретного НПВП, и к определению длительности его использования.
Сердечно-сосудистая безопасность НПВП: проблема или просто разговоры
Согласно данным, представленным заведующей лабораторией ревмокардиологии НИИР, д.м.н. Дианой Сергеевной НОВИКОВОЙ, наиболее частой коморбидной патологией у пациентов с сердечной недостаточностью, фибрилляцией предсердий является артрит25. Реальность такова, что почти 50% больных артритом страдают сердечно-сосудистой патологией. Поэтому практически ежедневно приходится решать вопросы, связанные с выбором наиболее оптимального препарата для контроля болевого синдрома у пациентов с высоким сердечно-сосудистым риском.
В последние годы появилась еще одна категория риска – очень высокий сердечно-сосудистый риск. Что это означает? Согласно обновленным рекомендациям Европейского общества кардиологов и Европейского общества гипертонии (2018), для такового характерны наличие ишемической болезни сердца, инфаркта миокарда, острого коронарного синдрома, ишемического инсульта/транзиторной ишемической атаки, аневризмы аорты, заболевания периферических артерий. Кроме того, при очень высоком сердечно-сосудистом риске имеет место значимая атеросклеротическая бляшка любой локализации (стеноз артерии > 50%), сахарный диабет с поражением органов-мишеней, хроническая болезнь почек тяжелой степени (скорость клубочковой фильтрации менее 30 мл/мин/1,73 м2), десятилетний риск фатального исхода сердечно-сосудистого заболевания по шкале оценки суммарного риска смерти от сердечно-сосудистого заболевания (Systematic COronary Risk Evaluation – SСORE) более 10%.
Далее докладчик кратко проанализировала эффекты ингибирования ферментов ЦОГ при приеме НПВП. Ингибирование ЦОГ-1 приводит к снижению активности тромбоцитов, опосредованной тромбоксаном А2. Как следствие, уменьшается риск развития инфаркта миокарда и инсульта. Однако параллельно возрастает риск желудочно-кишечных осложнений и почечной дисфункции. Ингибирование ЦОГ-2 обусловливает активацию тромбоцитов, вазоконстрикцию. В результате отмечается увеличение риска инсульта, инфаркта миокарда, но при этом реализуются противовоспалительные эффекты26. Ингибирование ЦОГ-2 оказывает отрицательное влияние на эндотелиальные и гладкомышечные клетки, кардиомиоциты и почки. Активация тромбоцитов, вазоконстрикция, эндотелиальная дисфункция, проаритмогенные эффекты, окислительный стресс, повышение артериального давления (АД) в конечном итоге приводят к коронарному тромбозу, развитию сердечной недостаточности и увеличению количества сердечно-сосудистых осложнений.
Для того чтобы подавить активность тромбоксана, необходимо полностью заблокировать ЦОГ-1 в тромбоцитах. Большинство НПВП может вызвать лишь преходящее ингибирование ЦОГ-1 в тромбоцитах (кроме ацетилсалициловой кислоты в дозе от 30 мг/сут и напроксена в высоких дозах)27.
В то же время все НПВП в той или иной степени являются ингибиторами ЦОГ-2. Установлено, что для реализации их анальгетического и противовоспалительного эффектов необходимо ингибировать активность ЦОГ-2 на 50–90%. Однако умеренная ЦОГ-2-селективность, измеренная в условиях in vitro, может быть утеряна в условиях in vivo. Это обусловливается повышением дозы НПВП и/или особенностями индивидуального ответа на такую терапию28.
Для того чтобы ответить на вопрос о том, играет ли степень ингибирования ЦОГ-1 и ЦОГ-2 роль в повышении риска тромботических осложнений, было проведено масштабное когортное исследование. В течение пяти лет под наблюдением находилось 716 395 пациентов в возрасте 50–84 лет29. Установлено, что все НПВП увеличивали риск инфаркта миокарда, причем он повышался при длительном применении НПВП и увеличении их дозы. У неселективных и селективных НПВП (сНПВП) (коксибов) указанный риск был сопоставим. Достоверно высокий риск был зафиксирован только у рофекоксиба и диклофенака.
Взаимосвязь между развитием тромботических осложнений и селективностью НПВП до сих пор не выявлена. Однако чем выше была степень ингибирования ЦОГ-2 (критическая – 90%), тем выше был риск развития инфаркта миокарда. Эторикоксиб ингибирует ЦОГ-2 менее чем на 90%. Поэтому он ассоциируется с меньшим риском развития инфаркта миокарда, чем препараты, которые ингибируют ЦОГ-2 более чем на 90% (диклофенак, индометацин, рофекоксиб).
Полученные результаты позволили сделать следующие выводы:
- необходимо разделять понятия «селективность НПВП» и «степень ингибирования ЦОГ»;
- более благоприятным профилем сердечно-сосудистой безопасности обладают НПВП, которые ингибируют ЦОГ-1 более чем на 95% или ЦОГ-2 менее чем на 90%;
- более высокая степень ингибирования ЦОГ-1 ассоциируется с увеличением риска ЖКТ-осложнений;
- эторикоксиб ингибирует ЦОГ-2 менее чем на 90% и практически не оказывает влияния на ЦОГ-1.
Сердечно-сосудистая безопасность нНПВП и сНПВП сравнивалась в метаанализе, включавшем 754 исследования. Согласно его результатам, все классы НПВП увеличивали риск развития сердечно-сосудистых осложнений (кроме напроксена), в том числе сердечной недостаточности. У коксибов и нНПВП (диклофенака, ибупрофена, напроксена) риск был сопоставимым30.
Оценка риска развития инфаркта миокарда на фоне применения НПВП проводилась и в условиях реальной клинической практики. Использование любой дозы диклофенака, напроксена, целекоксиба, ибупрофена в течение недели, месяца и более ассоциировалось с риском развития инфаркта миокарда. Наибольший риск отмечался в первый месяц использования НПВП31.
Наиболее крупным и длительным было изучение эторикоксиба и диклофенака в программе MEDAL. В исследование были включены свыше 34 тыс. пациентов с ОА и РА в возрасте старше 60 лет. У большинства пациентов выявлены факторы риска развития сердечно-сосудистых осложнений. Так, 47% участников исследования страдали артериальной гипертензией (АГ), у 38% – отмечали два и более факторов риска развития сердечно-сосудистых заболеваний или сердечно-сосудистые заболевания в анамнезе, порядка 60% пациентов принимали антигипертензивные препараты.
Частота сердечно-сосудистых катастроф у получавших данные препараты составила менее чем 4% и была сопоставима как по артериальным тромботическим явлениям, так и по инфаркту миокарда, инсульту, внезапной коронарной смерти. Если по частоте НЯ со стороны почек группы эторикоксиба и диклофенака были сопоставимы, то общая частота желудочно-кишечных осложнений при использовании эторикоксиба оказалась существенно ниже, как и частота случаев отмены терапии из-за ЖКТ-осложнений32, 33.
В этом результаты программы MEDAL совпадают с результатами исследования PRECISION, в котором сравнивалась общая кардиобезопасность НПВП. Напроксен и ибупрофен обладали менее благоприятным профилем кардиобезопасности по сравнению с коксибами34.
Длительность применения НПВП в программе MEDAL составляла не менее полутора лет. Согласно полученным результатам, прием и эторикоксиба, и диклофенака оказывал влияние на развитие АГ. Однако в группе эторикоксиба негативный эффект был несколько более выраженным, при этом среднее максимальное повышение АД составляло не более 4,5 мм рт. ст. Максимальное повышение АД регистрировали в первый месяц терапии эторикоксибом 60–90 мг/сут и диклофенаком 150 мг/сут. Факторами риска повышения АД были АГ в анамнезе, возраст 65 лет и старше, ожирение35.
«При наличии указанных факторов риска следует более тщательно контролировать артериальное давление», – прокомментировала Д.С. Новикова.
J.A. Pope и соавт. провели метаанализ клинических исследований (n = 1324), чтобы оценить изменение АД на фоне приема НПВП у нормотензивных и гипертензивных пациентов. У пациентов без АГ повышение АД на фоне приема НПВП было незначительным36.
В этой связи представляет интерес оценка гипертензивного эффекта эторикоксиба и диклофенака у больных ОА и РА, проведенная H. Krum и соавт. по результатам программы MEDAL. Через четыре месяца терапии эторикоксибом у пациентов, принимавших блокаторы кальциевых каналов, бета-блокаторы и диуретики в качестве монотерапии, не отмечалось достоверного повышения систолического АД37.
Согласно результатам двойного слепого плацебоконтролируемого исследования с параллельными группами, эторикоксиб не уменьшал антиагрегантный эффект ацетилсалициловой кислоты38.
В исследованиях по безопасности терапии НПВП в сочетании с антикоагулянтами при инфаркте миокарда продемонстрировано, что все НПВП ассоциируются с дозозависимым увеличением абсолютного риска серьезных кровотечений. Однако на фоне применения коксибов в сочетании с варфарином риск желудочно-кишечных кровотечений был меньше, чем при приеме ибупрофена, индометацина, напроксена39.
На основании анализа результатов исследования RE-LY A.P. Kent и соавт. (2018) сделали вывод, что комбинация пероральных антикоагулянтов и НПВП увеличивает риск кровотечений, мозгового инсульта и тромбоэмболических осложнений у пациентов с мерцательной аритмией. Следует уточнить, что коксибы в спектре принимаемых НПВП отсутствовали40.
Исходя из оценки сердечно-сосудистой безопасности НПВП, было сделано заключение: риск развития сердечно-сосудистых осложнений при длительном приеме нНПВП и сНПВП сопоставим. На сегодняшний день имеющейся информации для определения более высокого или низкого риска развития сердечно-сосудистых заболеваний для конкретного НПВП недостаточно. Все препараты данной группы могут вызывать развитие и дестабилизацию АГ, инфаркта миокарда, инсульта, мерцательной аритмии, сердечной недостаточности, почечной недостаточности. Риск увеличивается с первых недель терапии, независимо от исходного сердечно-сосудистого риска, при этом относительное его увеличение выше у пациентов, страдающих сердечно-сосудистыми заболеваниями. Безопасного терапевтического окна нет41, 42.
Поскольку на фоне приема НПВП отмечается снижение эффективности почти всех основных классов гипотензивных препаратов (ингибиторов ангиотензинпревращающего фермента, сартанов, мочегонных средств, бета-адреноблокаторов), за исключением антагонистов кальция, при АГ предпочтение следует отдавать блокаторам кальциевых каналов. Некоторые НПВП (в частности, ибупрофен), но не эторикоксиб, блокируют антиагрегантное действие ацетилсалициловой кислоты. Комбинация антикоагулянтов и НПВП увеличивает риск кровотечений и инсульта/тромбоэмболических осложнений. Однако терапия коксибами в сочетании с антикоагулянтами ассоциируется с меньшим риском кровотечений. Необходимо также помнить, что комбинация мочегонных препаратов, ингибиторов ангиотензинпревращающего фермента/антагонистов рецепторов ангиотензина и НПВП увеличивает риск острой почечной недостаточности41, 42.
По словам Д.С. Новиковой, у пациентов с ревматическими заболеваниями, как правило, исходно уже отмечается высокий сердечно-сосудистый риск. Они чаще умирают от инфаркта миокарда, инсульта и сердечной недостаточности. В связи с этим в рекомендациях Европейской антиревматической лиги по лечению пациентов с воспалительными артритами и сердечно-сосудистыми осложнениями указано, что назначать нестероидные противовоспалительные препараты и глюкокортикостероиды следует с осторожностью, особенно пациентам с диагностированными сердечно-сосудистыми заболеваниями или высоким риском развития таковых.
В связи с этим особый интерес представляют результаты систематического обзора 22 метаанализов43. G. Zingler и соавт. анализировали только наиболее крупные исследования, включавшие более 1000 пациенто-лет. Все исследования были разделены на три группы по выраженности системного воспаления: высокий, средний и низкий.
Следует отметить, что риск сердечно-сосудистых осложнений при приеме НПВП обусловлен двумя факторами – уровнем системного воспаления, а также перекрестным взаимодействием простациклинов и тромбоксанов. При высоком уровне воспаления, который наблюдается при ревматоидном артрите, псориатическом артрите, анкилозирующем спондилите, НПВП могут даже снижать исходный сердечно-сосудистый риск. При умеренном уровне воспаления, который наблюдается при остеоартрите у пожилых пациентов, прием НПВП может не повышать сердечно-сосудистый риск. И только при низком уровне воспаления (колоректальная аденома, болезнь Альцгеймера и др.) применение НПВП приводит к существенному увеличению риска развития сердечно-сосудистых осложнений43.
Полученные в ходе системного анализа данные позволили сделать следующие выводы:
- увеличенная частота сердечно-сосудистых осложнений у пациентов с системным воспалением свидетельствует об уже имевшемся риске сердечно-сосудистых осложнений;
- НПВП – противовоспалительные препараты. Снижая воспаление, НПВП могут уменьшать риск развития сердечно-сосудистых заболеваний и смерти у пациентов с системными воспалительными заболеваниями;
- повышение сердечно-сосудистого риска характерно для ацетаминофена, опиоидов, глюкокортикостероидов;
- необходимость использования НПВП у пациентов с системными воспалительными заболеваниями должна оцениваться исходя из показаний для назначения обезболивающей терапии и наличия факторов риска развития НЯ.
«Мы не должны отказываться от НПВП, особенно при хроническом болевом синдроме. В случае с остеоартритом прием НПВП обычно длится две – четыре недели, поэтому вопрос кардиобезопасности стоит менее остро, чем при постоянном приеме. И если раньше мы рассматривали НПВП только как средства для симптоматического лечения ОА, то сегодня в ряде случаев – уже как базисные препараты для купирования воспаления», – подчеркнула докладчик, завершая выступление.
Заключение
Нестероидные противовоспалительные препараты, широко применяемые при ревматических заболеваниях, в том числе при остеоартрите, различаются по селективности ингибирующего воздействия на изоформы ЦОГ, выраженности противовоспалительного и анальгетического эффектов, спектру нежелательных явлений.
Эторикоксиб (Аркоксиа®) – селективный ингибитор ЦОГ-2. Результаты клинических исследований и продолжительный опыт применения свидетельствуют о его высокой противовоспалительной и анальгетической активности, хорошей переносимости при длительном применении у пациентов с ОА. Эторикоксиб (Аркоксиа®) характеризуется более низким риском развития осложнений со стороны желудочно-кишечного тракта, а по профилю сердечно-сосудистой безопасности не уступает традиционным (неселективным) НПВП. Важными преимуществами Аркоксиа® являются удобство приема (один раз в сутки) и возможность сочетания с низкими дозами ацетилсалициловой кислоты, что может быть особенно актуальным у пациентов пожилого возраста.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.