Гипотиреоз и неврологические нарушения
- Аннотация
- Статья
- Ссылки
- English
Тиреоидные гормоны (ТГ) имеют критическую важность для энергетического метаболизма. Недостаток ТГ при гипотиреозе оказывает существенное влияние на функционирование нервной системы, что приводит к манифестации различных неврологических расстройств.
Гипотиреоз может быть первичным (вследствие патологии щитовидной железы (ЩЖ)) или вторичным (вследствие дефицита тиреотропного гормона (ТТГ)). У взрослых более 99% случаев приходится на первичный приобретенный гипотиреоз.
Распространенность первичного гипотиреоза составляет 4,6% [1]. Основными причинами первичного гипотиреоза являются дефицит йода и аутоиммунный тиреоидит. К другим, менее частым причинам его развития относятся врожденные, лекарственные, ятрогенные и инфильтративные заболевания [2].
Центральный гипотиреоз – редкое заболевание, которое может быть связано со вторичным гипотиреозом (патологией гипофиза) или третичным гипотиреозом (патологией гипоталамуса) и быть врожденным или приобретенным. Наиболее частые причины развития центрального гипотиреоза у взрослых включают аденому гипофиза, инфильтративное заболевание и лучевую терапию. Более широкое использование ингибиторов иммунных контрольных точек в лечении рака за последнее десятилетие привело к росту распространенности центрального гипотиреоза, связанного с патологией гипофиза, хотя точные механизмы этого феномена не вполне изучены [3].
При дефиците ТГ происходят изменения во всех без исключения органах и системах, что определяет полисистемность и многообразие его клинических проявлений. На клеточном уровне уменьшается потребление кислорода, интенсивность процессов окислительного фосфорилирования и синтеза аденозинтрифосфата, возникает дефицит энергии, снижается синтез ферментов, подавляются процессы клеточного метаболизма [1]. Это определяет множественность симптомов разной степени тяжести [4].
Изменения уровней трийодтиронина (Т3) и тироксина (Т4) могут привести к цереброваскулярным изменениям и изменениям гематоэнцефалического барьера. Тиреоидные гормоны влияют на нейротрансмиссию и метаболические процессы, а также на транскрипцию генов. При недостатке ТГ отмечаются воспаление и окислительный стресс [5]. В центральной нервной системе тиреоидные гормоны влияют на нейрональный и глиальный метаболизм, модуляцию апоптоза, нейропластичность и ангиогенез, гемостаз, локальный и системный иммунный ответ. В основе эффектов гормонов ЩЖ лежат различные геномные и негеномные механизмы, регулирующие митохондриальную функцию, ионные каналы, активацию и экспрессию специфических белков [6]. ТГ участвуют в различных процессах, включая регуляцию пластичности нейронов, стимуляцию ангиогенеза и нейрогенеза, модуляцию динамики цитоскелета и внутриклеточный транспорт в нейронах и популяциях глиальных клеток. Астроциты, отвечающие за обеспечение нейронов метаболическими веществами, считаются отправной точкой действия ТГ в центральной нервной системе [7].
Почти все проявления гипотиреоза обусловлены либо генерализованным снижением метаболических процессов, либо накоплением матриксных гликозаминогликанов в тканевых интерстициальных пространствах. В первом случае речь идет о таких симптомах, как утомляемость, непереносимость холода, брадикардия и увеличение массы тела, во втором – жесткости волос и охриплости голоса, снижении слуха. Симптомы гипотиреоза могут варьироваться от легких, особенно при субклиническом гипотиреозе, до очень тяжелых, включая гипотиреоидную кому.
В большинстве случаев начало гипотиреоза скрыто. Симптомы и признаки могут быть нечеткими и разнообразными, что затрудняет диагностику. Одним из наиболее распространенных симптомов признана утомляемость. С жалобами на утомляемость больные могут обращаться к врачам разных специальностей. Большинство симптомов и признаков гипотиреоза неспецифичны и не подтверждают диагноз. Ряд общих симптомов широко распространен у взрослых [8]. Чаще гипотиреоз субклинический, диагностируется случайно при исследовании функции ЩЖ [9]. Иногда больные с гипотиреозом годами наблюдаются по поводу различных заболеваний, таких как ишемическая болезнь сердца, атеросклероз, анемия неясного генеза, полиартрит, шизофрения, болезнь Альцгеймера. Особенно трудна диагностика гипотиреоза у лиц пожилого возраста, что зависит от неспецифичности его проявлений и наличия других сопутствующих заболеваний. Несвоевременные диагностика и, соответственно, терапия могут привести к летальному исходу [10].
Врожденный гипотиреоз считается одной из наиболее распространенных причин предотвратимой умственной отсталости. Поскольку у большинства младенцев с этим заболеванием отсутствуют явные клинические проявления и отягощенный семейный анамнез, выделить группу повышенного риска не представляется возможным. Благодаря программам скрининга новорожденных, доступным во многих странах, удается достичь нормальных или почти нормальных нейрокогнитивных результатов у большинства младенцев с врожденным гипотиреозом [11].
Явный гипотиреоз у взрослых может способствовать возникновению невропатий защемления, таких как синдром запястного канала, и метаболических полиневропатий, нарушению памяти, концентрации внимания, появлению скелетно-мышечных симптомов, апноэ во сне, депрессии и других психических расстройств [12]. Кроме того, гипотиреоз может привести к снижению качества жизни, связанного со здоровьем [13].
Аутоиммунные заболевания щитовидной железы могут ассоциироваться с неврологическими симптомами [14]. Наиболее распространенной формой аутоиммунной тиреопатии признан тиреоидит Хашимото (аутоиммунный тиреоидит – АИТ) [15], ассоциированный с повышением уровня антител к тиреопероксидазе и в меньшей степени к тиреоглобулину и обычно проявляющийся субклиническим или манифестным гипотиреозом [16].
Сообщалось о дисфункции щитовидной железы, связанной с COVID-19. Гипотиреоз в основном описывался как следствие подострого тиреоидита, хотя точный механизм еще неясен [17].
Гипотиреоз в исходе АИТ часто встречается у пациентов с другими аутоиммунными заболеваниями, особенно с сахарным диабетом 1 типа, аутоиммунной патологией желудка и глютеновой болезнью, возникающей, например, как часть аутоиммунных полиэндокринопатий [2]. Аутоиммунные заболевания ЩЖ нередко являются следствием аутоиммунной предрасположенности и могут быть связаны с широким спектром аутоиммунных неврологических расстройств, вызванных различными аутоантителами [18]. Аутоиммунный полигландулярный синдром 3 типа помимо аутоиммунной патологии щитовидной железы включает миастению и синдром ригидного человека [19].
Для больных миастенией характерно наличие сопутствующих аутоиммунных заболеваний, из которых патология щитовидной железы является наиболее распространенной [20].
Синдром ригидного человека характеризуется прогрессирующей мышечной ригидностью и болезненными спазмами, преимущественно вовлекающими аксиальную мускулатуру. Сопутствующая аутоиммунная эндокринная патология определяется в 70% случаев [21]. Хорошо известна связь данной нозологии с АИТ [22, 23].
В ряде случаев у пациентов развивается энцефалопатия Хашимото [24–26], известная как стероид-чувствительная энцефалопатия, связанная с аутоиммунным тиреоидитом. Ее распространенность оценивается как 2:100 000. Средний возраст начала заболевания – 50–60 лет [27, 28]. Почти четверть случаев приходится на лиц женского пола в возрасте от 18 до 30 лет [29]. Спектр клинических признаков энцефалопатии Хашимото включает поведенческие изменения, снижение когнитивных функций, спутанность сознания, инсультоподобные эпизоды и судороги [24, 30]. У значительной части пациентов развиваются поздние осложнения, в основном эпилепсия. В отсутствие специфической клинической картины заболевания своевременная его диагностика затруднительна, что приводит к позднему назначению терапии. Примечательно, что вопрос выделения нозологической единицы энцефалопатии Хашимото остается широко обсуждаемым [25].
Гипотиреоз и инсульт
У взрослых до 65 лет субклинический гипотиреоз связан с развитием сосудистой деменции и инсульта [5], сердечно-сосудистой смертью и острым нарушением мозгового кровообращения [31]. Однако не все исследователи подтверждают этот факт [32]. Анализ агрегированных опубликованных данных не позволяет оценить подгруппы с дифференцированным риском. В этой связи показательны результаты исследования влияния субклинического гипотиреоза на развитие инсульта у пациентов разного возраста. Согласно данным метаанализа в отношении 47 573 взрослых, скорректированным по возрасту и полу, для пациентов с субклиническим гипотиреозом по сравнению с лицами с эутиреозом относительный риск (ОР) инсульта (комбинированный фатальный и нефатальный) составил 1,05 (95%-ный доверительный интервал (ДИ) 0,91–1,21), фатального инсульта – 1,07 (95% ДИ 0,80–1,42). ОР инсульта для лиц в возрасте 18–49 лет составил 3,32 (95% ДИ 1,25–8,80). ОР фатального инсульта в возрастных группах 18–49 и 50–64 лет был выше – 4,22 (95% ДИ 1,08–16,55) и 2,86 (95% ДИ 1,31–6,26) соответственно. Повышение риска для лиц старших возрастных групп не обнаружено. Так, в возрастных категориях от 65 до 79 лет или старше 80 лет ОР составил 1,00 (95% ДИ 0,86–1,18) и 1,31 (95% ДИ 0,79–2,18) соответственно. Риск фатального инсульта увеличивался при более высоких концентрациях ТТГ. Таким образом, на этапе субклинического гипотиреоза у лиц моложе 65 лет отмечается существенно повышение риска инсульта, в том числе фатального [33].
Необходимо отметить, что более низкие уровни свободного Т3 (св. Т3) обнаружены в группе с худшим исходом. Установлена отрицательная связь между уровнем св. T3 и риском неблагоприятного прогноза при инсульте (отношение шансов (ОШ) 0,58 (95% ДИ 0,42–0,79); р = 0,0007) [34].
Масками тяжелого гипотиреоза могут быть дисфагия и симптоматика стволового инсульта. Один из вариантов нетипичной клинической картины декомпенсированного гипотиреоза – гипотиреоидный делирий, протекающий в виде острого психоза на фоне тяжелых расстройств памяти и мышления [35].
Гипотиреоз и болезнь Паркинсона
Болезнь Паркинсона (БП) представляет собой прогрессирующее нейродегенеративное заболевание, характеризующееся брадикинезией с тремором покоя, скованностью и замедлением движений. Классические симптомы заболевания часто сопровождаются немоторными симптомами, такими как нарушения сна, депрессия, когнитивные нарушения (КН). Основной причиной БП является избирательная утрата дофаминергических нейронов в черной субстанции, которая может распространяться и на другие области мозга. Причинами заболевания также считаются аномалии сворачивания, агрегации и удаления белков, а также нарушения убиквитин-протеасомной системы и функции митохондрий, окислительный стресс. Связь между гипотиреозом и БП обсуждается, количество исследований не слишком велико [36–38]. При гипотиреозе БП сопровождается общим снижением мозговой активности, что подтверждается визуализацией головного мозга. Как было показано в одном исследовании с участием десяти пациентов c БП, перенесших тиреоидэктомию по поводу рака щитовидной железы, регионарный мозговой кровоток снижается на 24%, церебральный метаболизм глюкозы – на 12% (при тяжелом гипотиреозе) [39].
Описана корреляция между концентрациями ТГ и подтипами БП. У пациентов с тремор-доминантным и смешанным типами БП уровень Т4 был значительно выше, чем у лиц с акинетико-ригидным типом. Более низкие уровни ТТГ наблюдались при треморном типе БП по сравнению с акинетико-ригидным типом. Более высокие уровни Т3 были связаны с меньшей тяжестью заболевания. Дегенерация дофаминергических нейронов может привести к нарушению регуляции уровня ТГ у пациентов с БП. Более того, как гипотиреоз, так и гипертиреоз способствуют окислительному стрессу, который также приводит к нарушениям передачи дофамина и ускорению гибели нейронов [7].
Описаны общие клинические признаки и БП, и гипотиреоза [36, 40]. Например, у пациентов с микседемой лицо может казаться невыразительным, маскоподобным и апатичным, как при БП [41], которая характеризуется редким миганием, уменьшением улыбки и приоткрыванием рта. Речь при манифестном гипотиреозе может быть замедленной, грубой, с низким тембром и затрудненной артикуляцией, наподобие речи при БП. Это может привести к трудностям в диагностике [37] и задержке в постановке правильного диагноза [36]. Пациентов с лекарственно-устойчивой БП следует обследовать на наличие сосуществующего гипотиреоза и наоборот [14].
Гипотиреоз и двигательные расстройства
Генетические нарушения, вызывающие врожденный гипотиреоз и двигательные расстройства, в основном хорею и дистонию, встречаются редко. Описаны синдром «мозг – легкие – щитовидная железа», при котором лечение гипотиреоза может улучшить неврологические симптомы [42], а также синдром Аллана – Херндона – Дадли. Мутации в гене SLC30A10, кодирующем переносчик марганца, связаны с «наследственной токсичностью марганца с дистонией», что приводит к повышению уровня марганца в крови и головном мозге и последующей нейротоксичности. Клиническая картина включает цирроз печени, дистонию (петушиную походку), полицитемию и гипермарганцемию. Повышенный уровень марганца в ЩЖ блокирует выработку тироксина, что клинически проявляется гипотиреозом [14].
Атаксия может иметь место у 5–10% пациентов с гипотиреозом. Поражение мозжечка характерно и при гипотиреозе, и при энцефалопатии Хашимото. Отмечено поражение червя и более частое поражение полушарий мозжечка. Данных об особенностях заболеваний мозжечка, связанных с патологией щитовидной железы, очень мало. Атрофию червя и обоих полушарий мозжечка обнаруживают как при гипотиреозе, так и при энцефалопатии Хашимото. Для этого используют нейровизуализацию. У больных с гипотиреозом заместительная тиреоидная терапия способна привести к полной или частичной ремиссии атаксии. Из-за высокой распространенности заболеваний ЩЖ и возможности их лечения мозжечковый синдром, ассоциированный с патологией ЩЖ, следует рассматривать как важную, недостаточно оцененную клиническую единицу [43].
Дисфункция ЩЖ может проявляться или быть связана с различными гипо- и гиперкинетическими двигательными расстройствами. Патофизиология двигательных нарушений вследствие гипотиреоза остается малоизученной. Ввиду потенциальной курабельности таких двигательных расстройств важны своевременная диагностика и адекватная терапия гипотиреоза [14].
Гипотиреоз и периферическая нервная система
Гипотиреоз может осложняться развитием диффузной периферической и/или туннельной невропатии.
Риск развития карпального туннельного синдрома повышен у больных гипотиреозом [44]. Признаки компрессионных невропатий обнаруживаются примерно у 35% пациентов с гипотиреозом. Наиболее распространенным вариантном является синдром запястного канала. Хирургическая декомпрессия при ущемлении срединного нерва в таких случаях обычно не требуется, поскольку симптомы постепенно исчезают после достижения эутиреоза [45].
Периферическая полиневропатия при гипотиреозе обычно носит сенсорный характер. Может отмечаться снижение сухожильных рефлексов. Нарушения вибрационной чувствительности и проприоцепции, как правило, выражены слабо. Пациенты могут предъявлять жалобы, характерные для нейропатической боли. Частота периферической невропатии при гипотиреозе варьируется от 9 до 60%, а нейрофизиологических признаков полиневропатии достигает 72% [46]. Патологические изменения, описанные при гипотиреоидной невропатии, включают сегментарную демиелинизацию, дегенерацию аксонов, увеличение числа митохондрий и отложение мукополисахаридов в эндоневральном интерстиции и периневрально.
Декомпенсированный гипотиреоз следует учитывать при обследовании пациентов с нарушением чувствительности и сниженными показателями жизнедеятельности [47].
Синдром POEMS
Синдром POEMS (Peripheral neuropathy, Organomegaly, Endocrinopathy, M protein elevation, and Skin changes), или синдром Такацуки, – редкое мультисистемное заболевание, природа которого еще не вполне изучена. Оно характеризуется пятью компонентами: периферической невропатией, органомегалией, эндокринопатией, повышением уровня белка М и кожными изменениями. Эндокринные нарушения наблюдаются у 67–84% больных и могут проявляться гипотиреозом, гипогонадизмом и надпочечниковой недостаточностью [48, 49].
Нарушение слуха и дисфония
Нарушения слуха и шум в ушах часто встречаются у пациентов с гипотиреозом. Аудиометрия позволяет выявить изменение слуха в 85% случаев. Вызванные слуховые потенциалы ствола мозга регистрируют различия у лиц с гипотиреозом и здоровых людей. Снижение слуха у этой группы пациентов может быть обусловлено различной локализацией изменений. Описаны аномалии на уровне среднего и внутреннего уха. Результирующее нарушение слуха может иметь кондуктивный, невральный и центральные компоненты. Следует отметить, что слух может улучшиться при лечении гипотиреоза.
У больных гипотиреозом дисфония, по-видимому, возникает из-за местных микседематозных изменений в гортани, а не из-за поражения черепных нервов [46].
Гипотиреоидная миопатия
Мышечные симптомы (скованность, миалгии, судороги, утомляемость) отмечают у большинства больных с выраженным гипотиреозом. Мышечные симптомы могут быть преобладающими или единственными проявлениями гипотиреоза, что ставит вопрос о дифференциальной диагностике с другими причинами миопатии, что иногда может быть затруднено. Повышенный уровень креатинкиназы в сыворотке крови, который не обязательно коррелирует с тяжестью миопатических симптомов, указывает на поражение мышц. Редкими мышечными проявлениями гипотиреоза являются рабдомиолиз, синдромы Гофмана и Кохера – Дебре – Семильена. Хотя патогенез гипотиреоидной миопатии до конца неизвестен, предполагаемые механизмы включают изменение гликогенолиза и окисления, экспрессии сократительных белков и нейро-опосредованное поражение [50].
Гипотиреоз и психические расстройства
Связь между функцией ЩЖ и психическими расстройствами, особенно расстройствами настроения, давно известна. Эта ассоциация была описана около 200 лет назад. В 1825 г. C.H. Parry сообщил о повышенной частоте нервных поражений при заболеваниях щитовидной железы. В 1873 г. W.W. Gull установил связь между микседемой и психозом, что было подтверждено в 1888 г. Комитетом клинического общества. В 1949 г. R. Asher для описания психического состояния субъектов с гипотиреозом ввел термин «микседематозное безумие» [51].
На сегодняшний день установлено, что нарушения функции ЩЖ могут существенно влиять на психическое состояние, включая эмоции и когнитивные функции. Гормоны ЩЖ влияют на норадренергическую и серотонинергическую нейротрансмиссии, которые играют значительную роль в этиологии депрессии и являются мишенями для современных антидепрессантов [5]. Механизм, лежащий в основе изменений в ткани головного мозга, связанных с аутоиммунным заболеванием ЩЖ, сложен. Он может включать изменение активности нейронов, вариации клеточного метаболизма и гематоэнцефалического барьера, экспрессию генов в глиальных или нейрональных клетках, повышенный риск сосудистой деменции, а также церебральные воспалительные заболевания в условиях АИТ [5].
Как избыток, так и недостаток ТГ способны вызывать аномалии настроения, включая депрессию, которая обычно обратима при адекватном лечении патологии ЩЖ. У 1–4% пациентов с аффективными расстройствами обнаруживается явный гипотиреоз, у 4–40% таких больных – субклинический гипотиреоз [52].
При гипотиреозе к характерным изменениям со стороны центральной нервной системы относят сонливость, слабость, потерю интереса к окружающему, снижение памяти. При этом на первый план выступают расстройства памяти и интеллекта. Снижение интеллектуальных способностей при гипотиреозе существенно не отличается от такового при олигофрении другого генеза. Описаны делириозные и делириозно-галлюцинаторные состояния (с преобладанием слуховых галлюцинаций), а также тревожные и депрессивные расстройства [53].
Одними из распространенных психоэмоциональных нарушений у пациентов с манифестным и субклиническим гипотиреозом являются депрессия (82% случаев), тревога (78%) и астения (70%). Есть указания на то, что тяжесть депрессии коррелирует с уровнем ТТГ. У 85% больных гипотиреозом наблюдаются вегетативные нарушения, преимущественно кардиальные и гастроинтестинальные [54].
Психические расстройства могут иметь место как до выявления нарушения функции ЩЖ, так и после. Так, еще до постановки диагноза «гипотиреоз» ОШ психических расстройств составляло 1,51 (95% ДИ 1,12–2,04), лечения нейролептиками – 1,49 (ДИ 1,29–2,04), антидепрессантами – 1,50 (ДИ 1,35–1,67), анксиолитиками – 1,28 (ДИ 1,16–1,41). После постановки диагноза «гипотиреоз» риск диагностирования психического расстройства был более высокий – ОШ 2,40 (ДИ 1,81–3,18) [12].
Когнитивные нарушения
Все больше данных подтверждают связь дисфункции ЩЖ с развитием болезни Альцгеймера и других КН [55]. Именно поэтому измерение уровня ТТГ в сыворотке крови стало стандартным скрининговым тестом при обследовании пациентов со снижением когнитивных функций. В одних работах установлена положительная корреляция гипотиреоза с КН и деменцией [56–59], в других – такая ассоциация не прослеживалась [60–62]. Это может объясняться разными причинами, включая различные диагностические критерии КН или гипотиреоза, а также инструменты измерения, недостаточность выборки. Влияние субклинического гипотиреоза на КН продолжает изучаться [63, 64].
Гипотиреоз также повышает риск развития деменции, ассоциированной с сопутствующими заболеваниями и возрастом. Повышенный уровень ТТГ каждые шесть месяцев увеличивает риск возникновения деменции на 12%, что позволяет предположить увеличение риска КН при длительном гипотиреозе [59]. Это согласуется с данными о том, что гипотиреоз приводил к морфологическим изменениям ряда областей мозга и КН в исследованиях на моделях у животных [65].
Уровень Т3 в сыворотке крови может точно соответствовать таковому в большинстве тканей, за исключением тканей головного мозга и гипофиза [66]. Согласно результатам недавнего метаанализа, уровни общего и св. Т3 в сыворотке крови и общего Т3 в спинномозговой жидкости оказались значительно ниже у пациентов с болезнью Альцгеймера, чем у лиц контрольной группы [67]. Эти данные требуют патофизиологического и клинического обоснования, но еще раз подчеркивают важность ТГ для центральной нервной системы при различных нозологиях.
Мозговой кровоток, церебральный метаболизм глюкозы
Интерес представляют результаты клинико-нейровизуализационного исследования, проведенного у пациентов с тотальной тиреоидэктомией по поводу рака щитовидной железы, как при медикаментозном эутиреозе, так и при гипотиреозе после отмены тиреоидных гормонов. Исследователи использовали позитронно-эмиссионную томографию с меченной кислородом-15 водой и меченной фтором-18F 2-дезокси-2-фтор-D-глюкозой. При гипотиреозе наблюдалось генерализованное снижение регионарного мозгового кровотока на 23,4% (р < 0,001), церебрального метаболизма глюкозы на 12,1% (р < 0,001). Мозговая активность была глобально снижена при тяжелом транзиторном гипотиреозе без региональных изменений, обычно наблюдаемых при первичной депрессии [39]. Результаты последующих исследований на аналогичных категориях больных подтвердили, что гипотиреоз даже в течение короткого периода времени может вызывать аномальный региональный церебральный метаболизм глюкозы в различных отделах головного мозга и связанные с ним аффективные симптомы [68, 69], что обусловливает необходимость внимательного отношения к психоэмоциональному статусу больных, которым проводится временная плановая отмена терапии левотироксином.
Необходимо отметить, что гипотиреоз может проявлять себя моносимптомно, особенно у пожилых больных, в частности в виде гипотиреоидной церебральной дисфункции, психозов, что приводит к ошибкам в диагностике [10].
Гипотиреоидная кома
Гипотиреоидная, или микседематозная, кома – ургентное, крайне тяжелое осложнение длительно некомпенсированного гипотиреоза, способное привести к смертельному исходу в отсутствие лечения. Летальность при микседематозной коме, согласно одним данным, составляет 50–60%, согласно другим данным – 50–80%. Таким образом, ее раннее распознавание может быть жизненно важным [35, 70].
У пациента с гипотиреозом микседематозная кома может развиться de novo или, что более вероятно, быть спровоцированной рядом лекарств, системными заболеваниями (например, пневмонией) и др. Острое нарушение мозгового кровообращения также может провоцировать гипотиреоидную кому. В некоторых случаях, особенно у пожилых больных, ее развитию способствует длительный прием лекарственных средств, угнетающих центральную нервную систему (фенотиазины, транквилизаторы, барбитураты) [35]. Причиной развития микседематозной комы у пациентов с соответствующим нейрокогнитивным статусом, в частности после перенесенного инсульта, может стать неприверженность лечению, приводящая к резкому уменьшению суточной дозы препарата и прекращению заместительной терапии, что описано М.И. Балаболкиным и соавт. [10].
Микседематозная кома чаще наблюдается у пожилых женщин зимой и может проявляться типичными признаками тяжелого гипотиреоза, а также гипотермией, гипонатриемией и гипоксемией [70]. Развитию комы предшествует период значительного увеличения выраженности симптоматики гипотиреоза. Нарастание клинических проявлений обычно происходит в течение нескольких недель или месяцев. К характерным клиническим признакам следует отнести сухость кожи, значительное поредение волос, снижение тембра голоса, периорбитальный и микседематозный отек, макроглоссию и снижение сухожильных рефлексов, гипотермию. Помимо гипонатриемии и гипогликемии при лабораторном исследовании могут выявляться анемия, гиперхолестеринемия, повышенные значения лактатдегидрогеназы и креатинкиназы. Специфическим клиническим признаком гипотиреоидной комы служит гипотермия (ректальная температура менее 36 °С), хотя при сопутствующей патологии может иметь место субфебрильная температура. Гипотермия присутствует практически у всех пациентов и может быть ниже 26 °С. Обычно именно гипотермия является ключевым симптомом, позволяющим заподозрить и диагностировать гипотиреоз в качестве причины комы. Температура тела выступает и как основной критерий эффекта проводимой терапии и исхода [35].
Со стороны сердечно-сосудистой системы отмечается тяжелая сердечно-сосудистая недостаточность с прогрессирующей брадикардией и артериальной гипотонией. У пациентов имеют место урежение дыхания, гиповентиляция с гиперкапнией, что в сочетании со снижением мозгового кровотока усугубляет гипоксию мозга. Несмотря на многофакторность развития гипотиреоидной комы, в качестве ключевого механизма рассматривается угнетение дыхательного центра, поддерживаемое гиперкапнией [35].
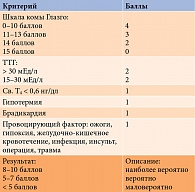
Для облегчения постановки диагноза G. Popoveniuc и соавт. предложили шкалу оценки микседематозной комы (таблица) [71]. С нашей точки зрения, данный инструмент является дискутабельным. В то же время учет приведенных в ней факторов позволяет систематизировать подход к диагностике гипотиреоидной комы и облегчить постановку диагноза.
В большинстве случаев диагностика гипотиреоидной комы затруднена, поскольку длительно текущий гипотиреоз часто не имеет специфической клинической картины, а его проявления могут напоминать различные заболевания, что привело к появлению термина «маски гипотиреоза».
Несмотря на широкое распространение скрининга нарушения функции ЩЖ, нередко отмечаются случаи несвоевременной диагностики на этапе прогрессирующего угнетения сознания.
М.И. Балаболкин и соавт. описали случай гипотиреоидной комы с летальным исходом. Пациентка в течение десяти лет наблюдалась у психиатра. Неоднократно проводилось стационарное лечение. Клиническая симптоматика характеризовалась аффектно-бредовыми и параноидальными расстройствами, идеями отношения. Состояние продолжало ухудшаться. Больная перестала выходить из дома, есть, ухаживать за собой. Госпитализирована в психиатрическую больницу в сознании. Была правильно ориентирована, но «тусклая, монотонная, апатичная, периодически состояние аффективной неустойчивости с раздражительностью, злобой, немотивированной агрессией». Несмотря на проводимую терапию, психосоматическое состояние ухудшилось: появились вялость, заторможенность, смазанность речи, нарушилась ориентация во времени и пространстве. Артериальное давление снизилось до 70/40 мм рт. ст. Возникло подозрение на декомпенсированный гипотиреоз. Начата терапия левотироксином. Однако состояние больной ухудшалось до крайне тяжелого. При осмотре кожные покровы бледные, сухие, холодные, лицо одутловатое, передняя стенка живота отечная, акроцианоз, температура тела 34 °С. В легких ослабленное везикулярное дыхание, частота сердечных сокращений – 60 в минуту, артериальное давление – 40/0 мм рт. ст., тоны сердца глухие. Гипотиреоз на этом этапе получил лабораторное подтверждение: ТТГ – 39,7 (норма 0,47–5,0) МЕ/мл, св. Т4 – 0,00 (9,14–23,81) нмоль/л, св. Т3 – 1,23 (2,58–5,44) нмоль/л. Угнетение сознания нарастало и на третьи сутки пребывания в отделении реанимации. Несмотря на проводимую терапию, наступила смерть. Патологоанатомический диагноз подтвердил тиреоидит, гипотиреоз, гипотиреоидную кому. В данном случае преобладающим в клинической картине гипотиреоза было нарушение психики [10].
Наибольшие трудности с диагностикой как гипотиреоза, так гипотиреоидной комы могут возникнуть у лиц пожилого и старческого возраста, имеющих различные соматические заболевания и ранее не обследованных по поводу патологии ЩЖ. Наличие сердечно-сосудистых заболеваний и выраженного отечного синдрома в клинической картине смещает диагностический поиск в сторону сердечной патологии и замедляет диагностику гипотиреоза у пациентов с микседематозной комой [72]. Отсутствие данных анамнеза о предшествующей терапии также существенно затрудняет постановку диагноза.
Лечение гипотиреоза
Заместительная терапия гипотиреоза осуществляется левотироксином натрия и рекомендуется при повышении уровня ТТГ в крови более 10 мЕд/л, а также в случае как минимум двукратного определения уровня ТТГ в интервале от 4 до 10 мЕд/л. У лиц старше 55 лет с сердечно-сосудистыми заболеваниями заместительную терапию проводят при хорошей переносимости и отсутствии данных о декомпенсации этих заболеваний на фоне приема препарата [1].
Следует помнить, что при назначении препаратов, влияющих на метаболизм или синтез транспортных белков, рекомендуется дополнительное исследование уровня ТТГ. К таким препаратам относятся фенобарбитал, фенитоин, карбамазепин, сертралин, большие дозы глюкокортикоидов, часто применяемые при терапии неврологических заболеваний. Их прием может привести к повышению или снижению потребности в левотироксине натрия [1].
У пациентов с психическими расстройствами и недостаточной функцией ЩЖ коррекция гипотиреоза препаратом левотироксина улучшает реакцию на нейролептики [73].
Широкий спектр неврологических симптомов, возникающих при гипотиреозе, подлежит обратному развитию при назначении терапии тиреоидными препаратами.
Заключение
Представленные данные свидетельствуют о роли тиреоидных гормонов в различных формах поражения центральной нервной системы, в первую очередь таких социально значимых, как инсульт и когнитивные нарушения, подтверждают важность проблемы снижения функции щитовидной железы в неврологии и открывают дальнейшие перспективные направления поиска новых путей нейропротекции.
K.V. Antonova, MD, PhD, M.M. Tanashyan, Corresponding member of the RASci., MD, PhD, Prof., N.E. Spryshkov, A.A. Panina
Research Center of Neurology
Contact person: Ksenia V. Antonova, kseniya.antonova@mail.ru
Hypothyroidism is one of the leading endocrine pathologies in terms of prevalence. Thyroid hormones (thyroid gland) play an important role in the regulation of energy metabolism. In the central nervous system they influence the survival, differentiation of neurons and energy consumption. There is a relationship between thyroid function and changes from the central nervous system, such as stroke, cognitive impairment, depression. The review describes the relationship between a wide range of neurological diseases and hypothyroidism.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.