Нейроэндокринные опухоли: мультидисциплинарный подход к диагностике и лечению
- Аннотация
- Статья
- Ссылки


До настоящего времени используется много синонимов НЭО: апудомы, карциноиды и т. д., но по современным представлениям наиболее точным является термин «нейроэндокринные опухоли». Впервые термин «карциноид» предложил Оберндорфер в 1907 году при описании менее агрессивного типа опухоли кишечника по сравнению с аденокарциномой. В настоящее время НЭО подразделяются по месту их возникновения, степени дифференцировки, функциональной активности и индексу пролиферации (Ki67). НЭО ЖКТ и поджелудочной железы могут продуцировать гормоны, и такие опухоли относятся к функционирующим. Новообразования, которые не выделяют гормоны, относят к нефункционирующим.
Функционирующие НЭО ЖКТ чаще всего проявляются карциноидным синдромом – это сочетание симптомов диареи, бронхоспазмов и приливов. Однако в чистом виде карциноидный синдром встречается только у 10% пациентов. Другие НЭО ЖКТ представляют собой довольно разнородную группу заболеваний, протекающую либо бессимптомно, либо с изменчивыми и часто слабо различимыми симптомами, которые могут маскировать другие клинические состояния: синдром раздраженного кишечника, аллергию, астму, сердечную недостаточность, климакс и т. д. Это часто затрудняет раннюю диагностику опухоли, и больные на протяжении многих лет посещают различных специалистов, не получая соответствующего лечения.
Функционирующие НЭО поджелудочной железы выделяют в особую группу в связи с продукцией специфических панкреатических пептидов: инсулиномы, гастриномы, ВИПомы, соматостатиномы, глюкагономы, которые могут сопровождаться соответствующими специфическими синдромами (Золлингера-Эллисона, Вернера-Моррисона и т. д.). Кроме того, НЭО поджелудочной железы могут являться частью наследственного синдрома МЭН-I (множественная эндокринная неоплазия – синдром Вернера), который имеет аутосомно-доминантный тип наследования [6]. При МЭН-I возникают множественные эндокринные опухоли, поражающие паращитовидные железы, эндокринную часть поджелудочной железы, переднюю долю гипофиза, кору надпочечников и диффузную эндокринную ткань в тимусе и бронхиолах. Нейроэндокринные опухоли 12-перстной кишки и поджелудочной железы занимают при МЭН-I второе место.
Широта клинических проявлений при НЭО обусловливает сложность постановки правильного диагноза. По данным Modlin с соавт. [2], рассчитанное время до установления диагноза составляет 5-7 лет. В настоящее время для диагностики НЭО активно используются КТ, МРТ, эндоскопическое УЗИ, ПЭТ, иммуногистохимические и биохимические исследования. Достижением последних лет стали сканирование с In¹¹¹-октреотатом, основанное на экспрессии соматостатиновых рецепторов, в основном II типа (применяется в России) [3], и ПЭТ с Ga⁶-DOTA-октреотидом (в России отсутствует). Последний метод приобретает все большую актуальность за рубежом, особенно в случае затрудненной диагностики опухолей без первично выявленного очага.
Основным методом лечения НЭО ЖКТ и поджелудочной железы является хирургическое вмешательство. К сожалению, из-за позднего выявления опухоли это часто оказывается невозможным, так как заболевание диагностируется уже при наличии метастазов. Однако и для этой группы пациентов в некоторых случаях целесообразно хирургическое лечение с целью снижения опухолевого объема (debulking surgery). Метастазы в печени являются главным фактором, определяющим выживаемость пациентов с эндокринными опухолями НЭО ЖКТ и поджелудочной железы. Для лечения этих больных используются химиоэмболизация, радиочастотная термоабляция, в редких случаях – пересадка печени.
При невозможности полного удаления опухоли и метастазов используются лекарственные методы лечения для контроля синдромов, остановки или торможения роста опухоли. Стандартом медикаментозного лечения при функционирующих НЭО являются аналоги соматостатина (Сандостатин ЛАР). Изучаются также возможности препарата при лечении нефункционирующих опухолей. Это связано с тем, что недавно был обнаружен противоопухолевый эффект Сандостатина ЛАР. По данным рандомизированного исследования PROMID, Сандостатин ЛАР в дозе 30 мг в 3 раза увеличивал время до прогрессирования у пациентов с опухолями тонкой и начальных отделов толстой кишки. При этом эффект зафиксирован как у пациентов с карциноидным синдромом, так и без него. В связи с этим можно говорить о более широких показаниях применения Сандостатина ЛАР – не только с целью купирования симптомов, но и для противоопухолевого эффекта – увеличения периода до прогрессирования.
α-интерфероны также могут вызывать биохимический и общий эффекты, но они более токсичны по сравнению с аналогами соматостатина, их применяют чаще в комбинации с последними.
Эффективность химиотерапии при НЭО ЖКТ и поджелудочной железы неоднозначна и зависит от степени злокачественности, индекса пролиферации (Ki-67), а также локализации опухоли [4]. Стрептозотоцин и дакарбазин традиционно используют в неоперабельных случаях. В России, в частности в РОНЦ им. Н.Н. Блохина РАМН, также активно изучается в качестве альтернативы стрептозотоцину сахаросодержащее нитрозопроизводное Араноза. 22 пациента получили лечение препаратами в следующей комбинации: араноза + кселода/5-фторурацил/доксорубицин. Объективный эффект отмечен у 18,2% пациентов, стабилизация – у 50%.
В последнее время при НЭО активно изучаются таргетные препараты с различным механизмом действия, такие как бевацизумаб, сунитиниб, эверолимус. На ASCO 2010 г. были представлены данные, свидетельствующие об эффективности сунитиниба при НЭО поджелудочной железы.
Эффективность эверолимуса при НЭО ЖКТ и поджелудочной железы была продемонстрирована в двух рандомизированных исследоваяниях – RADIANT-2 и RADIANT-3. Это самые крупные по количеству участвующих пациентов исследования при НЭО. Суммарно в них приняло участие более 800 пациентов.
В исследовании RADIANT-2 сравнивали комбинацию октреотида ЛАР + эверолимус с октреотидом ЛАР + плацебо у пациентов с распространенными НЭО различных локализаций (ЖКТ, поджелудочная железа, легкие). В группе комбинированного лечения преимущество по безрецидивной выживаемости составило 5 месяцев (16 мес. и 11 мес. соответственно). Полученные различия не достигли запланированной статистической достоверности
(p = 0,026, HR = 0,77) при централизованной оценке результатов, однако, по данным локальных отчетов, результаты оказались достоверными (p = 0,018).
В исследовании RADIANT-3 изучали монотерапию эверолимуса по сравнению с плацебо у пациентов с НЭО поджелудочной железы (n = 410). В группе лечения эверолимусом зафиксировано достоверное преимущество по безрецидивной выживаемости – 6,4 месяцев (p < 0,0001) и снижение риска рецидива на 65% (HR = 0,35).
Таким образом, эверолимус претендует на статус нового стандарта в лечении пациентов с НЭО различных локализаций. Следует заметить, что помимо высокой активности эверолимуса, исследователи отметили благоприятный профиль переносимости препарата в обоих протоколах.
Недавние клинические исследования продемонстрировали противоопухолевую активность эверолимуса в комбинации с темозоламидом и сунитинибом (Сутентом) – мультитаргетным агентом с анти-VEGF-активностью при панкреатических НЭО.
У больных с НЭО ЖКТ изучается также эффективность радионуклидной терапии (177Lu-DOTA – октреотат, 90Y-DOTA-октреотид). В России эти методики, к сожалению, недоступны.
Разнообразие клинического течения заболеваний НЭО и применяемых методов лечения диктует применение мультидисциплинарного подхода: создание специализированных консультативных и лечебных центров, разработку программ по информированию и обучению врачей.
Результаты диагностики и лечения пациентов НЭО по-прежнему остаются неудовлетворительными, что может быть обусловлено рядом причин:
- заболеваемость НЭО в мире резко увеличилась за последние годы;
- врачи мало осведомлены о НЭО;
- современные методы диагностики (хромогранин А, 5-ГИУК, сцинтиграфия рецепторов соматостатина – Октреоскан) не входят в стандарты диагностики;
- «смазанность» клинической картины приводит к поздней диагностике НЭО;
- отсутствует единая терминология и общепринятая классификация НЭО.
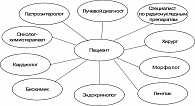
Для решения этих задач в Европе создано общество по лечению НЭО – ENETS, в США – NANETS. Наше представление о врачебном составе мультидисциплинарной команды для лечения НЭО продемонстрировано на рисунке 1.
Перспективы улучшения результатов лечения в специализированных центрах, применяющих такой мультидисциплинарный подход, можно продемонстрировать на примере центра по лечению нейроэндокринных опухолей в Швеции (Упсала) (табл. 1).
Актуальность проблемы НЭО в России обусловлена рядом факторов:
- Нет данных по истинной заболеваемости НЭО.
- Локальный регистр в РОНЦ создан только в 1992 году (сегодня 339 пациентов с верифицированным диагнозом НЭО), также начато создание российского регистра НЭО.
- Недостаточный уровень диагностических возможностей.
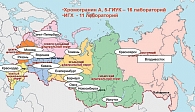
- Маркер хромогранин А определяют в Москве с 2005 г. только в двух лабораториях, в настоящее время эта ситуация улучшилась в результате оснащения ряда лабораторных центров в 16 городах России.
- Отсутствует ПЭТ с С11-5-гидрокси-L-триптофаном (5НТР), 18F-дигидрооксифенилаланином (DOPA), 68Ga-октреотидом. Радиоизотопная диагностика рецепторов соматостатина проводится с меченным индием. Клинические испытания отечественного препарата 111In-октреотида (Октреоскан) проведены в 2008 г., практическое использование начато с III-IV квартала 2009г. в РОНЦ им. Н.Н. Блохина РАМН и РНЦРР.
- Низкая осведомленность врачей о НЭО.
- Не выработаны стандарты диагностики и лечения НЭО.
- Недостаточно многопрофильных центров (всего 4).
- 2 октября 2009 г. было зарегистрировано Медицинское общество по лечению нейроэндокринных опухолей МОЛНЭО, основными целями и задачами которого являются:
- Создание единых подходов к вопросам оценки эпидемиологических данных и регистра НЭО в России.
- Разработка единой номенклатуры.
- Разработка оптимального диагностического алгоритма.
- Внедрение современных стандартов лечения нейроэндокринных опухолей.
- Изучение новых противоопухолевых препаратов.
С момента создания общества были проведены экспертные советы, NET-туры, конференция, мероприятия по улучшению обучения врачей, оснащены 16 лабораторий в разных городах России (рис. 1).
В 2010 г. европейское и американское общество объединились в альянс. Россия постепенно присоединяется к мировой программе по улучшению диагностики и лечения НЭО.
Таким образом, объединение врачей и внедрение мультидисциплинарного подхода – это реальная возможность улучшения качества диагностики и результатов лечения больных с нейроэндокринными опухолями.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.