Активация микроглии и синтез большого количества провоспалительных факторов вызывают отсроченные метаболические изменения в ишемизированной ткани. Появление областей с различной степенью повреждения (ядро инфаркта, ишемическая полутень) объясняется тем, что помимо некротического распада важную роль в регуляции клеточного гомеостаза при ишемии играет процесс программированной гибели (апоптоз) нейронов и нейроглии. Результаты морфологического изучения посмертного, а также экспериментального материалов позволяют достаточно определенно высказываться в отношении характера самых ранних структурных изменений в мозговом веществе при ишемии. Важно, что при гистологической и ультраструктурной оценке обнаруживаются признаки взаимно противоположных процессов – дегенерации и регенерации. Сложности разграничения этих процессов связаны с тем, что развиваются они под воздействием общего патологического «стимула» в одних и тех же структурах. Острую ишемию мозга всегда сопровождает «каскад» патобиохимических изменений в острой стадии ишемического инсульта [1, 2]:
- Снижение мозгового кровотока.
- Глутаматная «эксайтотоксичность» (повреждающее действие на нейроны повышенных концентраций возбуждающей аминокислоты – глутамата).
- Внутриклеточное накопление ионов кальция.
- Активация внутриклеточных ферментов.
- Повышение синтеза оксида азота и развитие окислительного стресса.
- Экспрессия генов.
- Отдаленные последствия ишемии – реакция местного воспаления, микроваскулярные нарушения, повреждения гематоэнцефалического барьера.
- Коррекция энергетического обмена путем снижения повреждающего действия гипоксии и уменьшения энергетической потребности нейронов.
- Стимуляция окислительно-восстановительных процессов и усиление утилизации глюкозы.
- Уменьшение интенсивности свободнорадикального и перекисного окисления липидов.
- Стимуляция системы нейротрансмиттеров и нейро-модуляторов.
- Торможение высвобождения возбуждающих медиаторов (глутамат, аспартат), обладающих эксайтотоксическим свойством.
Неэффективность клинического применения препаратов, которые дают положительный эффект в лабораторных условиях (у животных), может быть обусловлена рядом причин:
- назначение препаратов в эксперименте почти всегда происходит в течение нескольких минут от начала острой ишемии, а иногда и предшествует ей;
- подбор животных и дизайн эксперимента, как правило, стандартизированы;
- острое расстройство кровообращения мозга в большинстве моделей создается на фоне «соматического благополучия» животных, формируя тем самым монофакторную патологическую ситуацию.
- длительность страдания и особенности повреждения (диффузное, локальное, региональное) цереброваскулярного русла;
- характер изменений реологических и вязкостных свойств крови;
- сочетание поражений сосудов головы и паренхиматозных органов;
- наличие признаков поражения сердца и тип центральной гемодинамики, варианты изменения системного давления;
- степень выраженности предшествующей инсульту энцефалопатии и других отягощающих факторов (травма, интоксикация, длительная гипоксия).
- учет соотношения «риск – польза» у человека часто не позволяет достичь достаточной для реализации нейропротективного эффекта концентрации препарата в крови из-за существования значимых побочных эффектов;
- оценка эффективности нейропротективной терапии не может проводиться в режиме монотерапии, необходимо комбинирование ее с реопозитивной терапией (тромболизис), а также со всем необходимым объемом симптоматического, жизнеобеспечивающего вспоможения, ухода и восстановительного лечения.
Большинство используемых для нейропротекции соединений могут влиять на рецепторы или синапсы, некоторые оказывают нейромодулирующее действие. Это в свою очередь означает, что для реализации ноотропных свойств химических веществ необходим активно работающий мембранный рецептор, который можно активировать или ингибировать определенным лекарственным средством. Для каждого рецептора существует свой особый набор взаимодействующих веществ – лигандов. После ишемии, когда гибнет определенное количество нейронов, из поврежденных клеток выходят агрессивные биологически активные вещества, которые изменяют лиганд-рецепторные взаимосвязи. Лекарственное вещество первично взаимодействует с рецепторами биологических мембран нейронов. Они воспринимают сигналы лигандов, таких как нейромедиаторы, нейромодуляторы, нейротрофические вещества, которые в свою очередь осуществляют регуляцию функций нейронов. Часть биологически активных веществ регулируют ионные потоки и поддерживают электровозбудимость мембран за счет образования возбуждающих и тормозных потенциалов действия в них, другие осуществляют функции метаболической поддержки и обеспечивают химический синтез в цитоплазме. Таким образом, лиганд-рецепторные взаимодействия являются важнейшим фактором, обеспечивающим нормальное функционирование нервной системы, по крайней мере, в восприятии химических сигналов и формировании метаболических ответов на них.
Нейрометаболическая терапия острой стадии ишемического инсульта
С точки зрения клинической фармакокинетики для решения проблем острейшего периода инсульта терапевтическими средствами выбора считаются вещества, действующие на трофотропные рецепторные системы. Точнее всего этой задаче отвечают холинотропные препараты, что объясняется рядом факторов:
- холинореактивные системы способны оградить нейроны от избыточного воздействия катехоламинов;
- метаболиты медиатора ацетилхолина входят в состав клеточных мембран и обеспечивают их матричные функции;
- постсинаптические рецепторы нейронов холинергических систем способны оказывать метаболическое воздействие;
- холинергические факторы дифференцировки нейронов выполняют роль нейропоэтинов для нервных клеток головного мозга и способны осуществлять модулирующие функции.
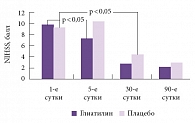
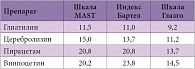
Было проведено несколько исследований препаратов доноров холина – холина альфосцерата – у пациентов с ишемическим инсультом. С.Н. Янишевский и соавт. сравнивали несколько препаратов, традиционно применявшихся в терапии острой стадии ишемического инсульта: Глиатилин, Церебролизин, пирацетам, винпоцетин [3]. Состояние пациентов оценивалось по шкале MAST (Multicentre Acutу Stroke Trial – Многоцентровое исследование острого инсульта), шкале комы Глазго (Glasgow coma scale, GCS), индексу Бартел и оригинальной шкале инсульта Е.И. Гусева и В.И. Скворцовой. Изучение общих тенденций в изменении состояния больных при различных видах нейрометаболической терапии с использованием оценочных шкал и статистической функции предсказания определило лучшие результаты у пациентов, принимавших Глиатилин (табл. 1). При этом следует отметить, что только два препарата – Глиатилин и Церебролизин – имели средний балл по индексу Бартел выше нижней границы инвалидизации легкой степени тяжести (75 баллов). За 21 день средний прирост в баллах по каждой шкале был выше у больных, получавших терапию Глиатилином.
После проведения кластерного анализа оказалось, что все результаты, полученные в ходе исследования с использованием всех шкал, разделяются на три группы (подвыборки): 1 – больные, принимавшие Глиатилин, 2 – больные, принимавшие Церебролизин, 3 – больные, принимавшие пирацетам и винпоцетин, причем данные достоверно различаются между 1-й и 3-й подвыборками. Аналогичный результат получен при применении критерия Холлендера для множественного сравнения (табл. 2). Таким образом, клиническое исследование продемонстрировало существенные различия результатов лечения больных в остром периоде ишемического инсульта при использовании препаратов с разными фармакологическими свойствами. Назначение этих препаратов в остром периоде ишемического инсульта по-разному способствовало возрастанию спонтанной двигательной активности больных, уменьшению афатических расстройств, активизации умственной деятельности, улучшению памяти, возрастанию критичности больных к собственному поведению. Положительная неврологическая динамика наступала заметно раньше в группе пациентов, получавших Глиатилин. У больных этой группы отмечалось максимальное сокращение сроков искусственной вентиляции легких и восстановления ауторегуляции мозговых сосудов.
В 2006–2008 гг. в России было проведено многоцентровое исследование эффективности применения Глиатилина в лечении пациентов с острым ишемическим инсультом [4]. В состав исследуемой группы вошли 122 пациента, получавших базисную терапию и Глиатилин в течение трех месяцев после развития инсульта. Глиатилин применялся по следующей схеме: внутривенно капельно на физиологическом растворе по 2000 мг в сутки в течение пятнадцати дней, затем внутримышечно по 1000 мг в сутки в течение пятнадцати дней, затем внутрь по 400 мг 2 раза в сутки (утром и днем) в течение шестидесяти дней. В ходе анализа результатов клинического обследования с использованием шкалы тяжести инсульта Национального института здоровья CША (National Institute of Health Stroke Scale, NIHSS), индекса Бартел, шкалы Рэнкина изучались показатели в первые, тридцатые и девяностые сутки после дебюта заболевания, их абсолютная и относительная динамика, а также частоты значений шкал менее пороговых уровней.
Для определения выборки, сопоставимой по неврологическому дефициту в дебюте инсульта с группой плацебо, были проанализированы пациенты с неврологическим дефицитом по NIHSS более 8, более 9 и более 10 баллов в дебюте заболевания. Наиболее целесообразной для сравнения явилась группа пациентов с неврологическим дефицитом по NIHSS более 9 баллов в дебюте заболевания (n = 46). В качестве сравнения была выбрана группа плацебо (n = 306) из исследования W.M. Clark и соавт. (1999) [5]. По степени выраженности неврологических симптомов в первые сутки заболевания пациенты были сопоставимы: в группе Глиатилина неврологический дефицит по шкале NIHSS составил 12,35 ± 4,2 балла, в группе плацебо – 11 ± 5 баллов (p > 0,1).
В результате проведенного анализа установлено, что к тридцатым суткам после дебюта инсульта у пациентов группы Глиатилина достоверно чаще отмечалась высокая способность пациентов к самообслуживанию (менее 2 баллов по шкале Рэнкина) (рис. 1). К 90-м суткам после дебюта инсульта у пациентов группы Глиатилина достоверно чаще отмечались умеренный неврологический дефицит (менее 2 баллов по NIHSS) и высокая способность пациентов к самообслуживанию (менее 2 баллов по шкале Рэнкина) (рис. 2). Таким образом, применение Глиатилина в лечении пациентов с ишемическим инсультом способствовало уменьшению неврологического дефицита и увеличению способности пациентов к самообслуживанию.
25 пациентам было выполнено расширенное нейровизуализационное исследование с целью определения динамики изменения зоны предполагаемого некроза мозговой ткани (диффузионно-взвешенная магнитно-резонансная томография, МРТ). Опираясь на дополнительные критерии, выделили группу пациентов (n = 15), которая оказалась однородной с группой плацебо-контроля по основным клинико-неврологическим и инструментальным показателям. При анализе результатов МРТ в качестве плацебо-контроля использовались результаты обследования пациентов плацебо-группы (n = 40) в исследовании S. Warach и соавт. (2000) [6].
Были проанализированы изменения в зоне ишемической полутени, определяемой при помощи диффузионно-перфузионной разницы на МРТ. Для оценки динамики объема необратимого повреждения нервной ткани использовалась относительная разница между объемом необратимого повреждения по данным диффузионно-взвешенной МРТ в первые сутки после дебюта инсульта по картам с коэффициентом взвешивания b = 1000 и объемом инфаркта мозга по данным Т2-взвешенной МРТ на тридцатые сутки после дебюта инсульта. В среднем конечный объем инфаркта мозга превысил объем необратимого повреждения нервной ткани у пациентов группы лечения Глиатилином на 13%, у пациентов группы плацебо – на 180% (p < 0,001). Таким образом, применение Глиатилина для лечения пациентов с ишемическим инсультом способствовало уменьшению конечных размеров инфаркта мозга.
В ходе исследования было зарегистрировано 7 случаев нежелательных явлений (пароксизм мерцательной аритмии, острые эрозии желудка и двенадцатиперстной кишки, пневмония, гидроторакс), не связанных с приемом препарата Глиатилин. Один пациент отказался от продолжения участия в исследовании. Проведенное исследование позволило установить, что применение Глиатилина для лечения пациентов с ишемическим инсультом способствует уменьшению неврологического дефицита. Полученные результаты также позволяют предположить, что большая степень восстановления нарушенных функций при использовании Глиатилина в лечении пациентов с ишемическим инсультом может быть связана, в том числе, с меньшим конечным объемом инфаркта мозга. В другом отечественном исследовании Глиатилин назначали в виде внутривенных инфузий 1000 мг в сутки в течение 12 дней на 1-м, 6-м, 11-м месяцах после дебюта инсульта [7]. Достаточное и полное восстановление неврологических функций и бытовой адаптации на фоне применения Глиатилина было достигнуто у 69,8% пациентов (в контрольной группе – у 24,8% пациентов).
Применение нейромедиаторов при геморрагическом инсульте
Интерес представляют данные, полученные в результате пилотного исследования применения Глиатилина у пациентов с геморрагическими инсультами, проведенное на базе клиники нервных болезней Военно-медицинской академии в 2009–2012 гг. В ходе анализа результатов клинического обследования с использованием шкал NIHSS, модифицированной шкалы Рэнкина (mRS), индекса Бартел изучались показатели в первые, пятые, тридцатые и девяностые сутки после дебюта заболевания, их абсолютная и относительная динамика, а также частоты значений шкал, отличающихся от пороговых уровней. Была выявлена сильная положительная корреляционная связь между объемом геморрагического очага и тяжестью состояния пациента, оцененной по шкале NIHSS: коэффициент корреляции Спирмена составил 0,9, p < 0,001. Статистически достоверных корреляций между объемом поражения и оценками по другим шкалам (шкала Рэнкина, индекс Бартел) не выявлено. В этой связи основная динамика оценивалась по шкале NIHSS.
Проверка однородности групп по признакам возраста и балла по шкале NIHSS при поступлении показала отсутствие влияния возраста на тяжесть состояния пациента в первые сутки инсульта. Не было также обнаружено различий по гендерному признаку во время неврологического осмотра при поступлении (p = 0,53). В основную группу были включены 11 человек (7 мужчин, 4 женщины), средний возраст – 65,0 ± 7,6 лет. Группу контроля составили 9 пациентов (6 мужчин и 3 женщины), средний возраст – 65,5 ± 5,6 лет. Различий по тяжести состояния на первые сутки между группами обнаружено не было. Неврологический дефицит в первые сутки после дебюта инсульта в группе Глиатилина составил 9,82 ± 1,29 балла по шкале NIHSS, в группе контроля – 9,33 ± 1,48 балла (р = 0,9).
В результате проведенного анализа установлено, что уже к пятым суткам (вторая точка наблюдения) наблюдалась статистически значимая (р = 0,01) разница в состоянии пациентов в основной группе, оцененном по шкале NIHSS, сохранявшаяся и при последующих осмотрах пациентов в контрольных временных точках (рис. 3). К тридцатым суткам и через три месяца после дебюта инсульта у пациентов основной группы достоверно чаще отмечалась высокая способность к самообслуживанию, определяющаяся по модифицированной шкале Рэнкина 2 баллами и ниже и по индексу Бартел > 60 баллов (p < 0,05).
Подсчитывалось отношение шансов (ОШ) иметь лучший балл, чем средний в общей группе пациентов. Отмечается устойчивая тенденция увеличения показателя ОШ в основной группе со временем. К 30-му дню ОШ достижения полной независимости от окружающих составляло для основной группы 1,64 (95% доверительный интервал (ДИ) 1,17–3,16, p < 0,05), ОШ умеренной зависимости – 3,64 (95% ДИ 1,92–6,54, p < 0,05) по отношению к контрольной группе. К 90-му дню ОШ достижения высокой степени независимости сохранялось выше 1 для основной группы и составляло 1,22 (95% ДИ 1,02–2,13, p < 0,05). Таким образом, применение Глиатилина для лечения пациентов с геморрагическим инсультом сопровождается более выраженным и полным восстановлением нарушенных неврологических функций и способности пациентов к самообслуживанию.
Заключение
Результаты исследований применения Глиатилина в остром периоде ишемического и геморрагического инсультов, во-первых, подтвердили безопасность применения препарата, а во-вторых, показали, что именно раннее назначение донора холина – Глиатилина – позволило добиться лучшей динамики регресса неврологической симптоматики и восстановления пациентов после инсульта по сравнению с другими нейропротекторами. Данные МРТ показали, что использование Глиатилина для лечения пациентов с ишемическим инсультом способствует уменьшению конечных размеров инфаркта мозга. Включение Глиатилина в комплексную терапию геморрагического инсульта повышало шансы пациентов на достижение функциональной независимости к исходу 30- и 90-дневного срока после инсульта.


![Рис. 1. Неврологический дефицит и способность пациентов к самообслуживанию на 30-е сутки после дебюта инсульта у пациентов, принимавших Глиатилин (в сравнении с результатами группы плацебо из исследования W.M. Clark и соавт. [5])](/upload/resize_cache/iblock/1c6/195_350_1/1c627ad9417ab6914b77333a331b7616.jpg)
![Рис. 2. Неврологический дефицит и способность к самообслуживанию на 90-е сутки после дебюта инсульта у пациентов группы Глиатилина (в сравнении с результатами группы плацебо из исследования W.M. Clark и соавт. [5])](/upload/resize_cache/iblock/483/195_350_1/48365395ec726d41ad8afcf3406fe8c0.jpg)