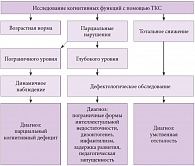
Алгоритм диагностики состояния когнитивной сферы включает проверку восприятия, памяти, аналитико-синтетических процессов, зрительно-моторной реакции. При осмотре ребенка следует обратить внимание как на впервые появившиеся жалобы, так и на усугубление имевшихся ранее симптомов. Необходимо уточнить, какие факторы риска присутствовали в анамнезе. Следует также установить соматический, физический, неврологический, психический, психологический и вегетативный статус ребенка. Исследование с помощью тестовых компьютерных систем (ТКС) (рис. 1) позволяет выявить соответствие когнитивных функций возрастной норме, наличие парциальных нарушений на пограничном или глубоком уровнях, возможно, тотальное снижение когнитивных функций.
Если у ребенка парциальные нарушения соответствуют пограничному уровню, то необходимо динамическое наблюдение за пациентом и проведение мероприятий, направленных на преодоление парциального когнитивного дефицита. При парциальных нарушениях глубокого уровня, как и при тотальном снижении когнитивных функций, проводят дефектологическое обследование ребенка, по результатам которого диагностируются пограничная форма интеллектуальной недостаточности, дизонтогенез, инфантилизм, задержка развития, педагогическая запущенность либо умственная отсталость.
Нарушение когнитивной деятельности ведет к трудностям в школьном обучении, девиантному поведению, психоэмоциональным нарушениям, социальной дезадаптации. В итоге снижение интеллектуального потенциала популяции вызывает снижение качества жизни. Согласно МКБ-10, нарушения когнитивной деятельности попадают в класс F00–F99 «Психические расстройства и расстройства поведения». Прямое отношение к нарушениям в когнитивной сфере имеют такие диагнозы, как F06.7 «Легкое когнитивное расстройство», F45 «Соматоформные расстройства», F45.3 «Соматоформная дисфункция вегетативной нервной системы».
Более тяжелые нарушения соответствуют диагнозам F70–F79 «Умственная отсталость» и F80–F89 «Расстройства психологического развития». В число последних входят расстройства речи, учебных навыков, а также синдром «неуклюжего ребенка». Раздел F90–F98 «Эмоциональные расстройства, расстройства поведения, начинающиеся в детском и подростковом возрасте» объединяет гиперкинетические расстройства поведения, тики, энурез, заикание, кусание ногтей (F98.8), сосание пальца (F98.8). При парциальной эпилепсии у детей в наибольшей степени страдает внимание, процессы анализа/синтеза и восприятия: их уровень составляет 53%, 55% и 60% от уровня здоровых детей соответственно. Меньше страдают психомоторная деятельность и память (75% и 91% от нормального уровня).
При синдроме дефицита внимания с гиперактивностью у детей резко нарушено внимание (только 21% от уровня контрольной группы), оказывается сильно затронута психомоторная деятельность (26%). Восприятие снижается в меньшей степени – до 58% от уровня контроля. Лучше всего у этой группы детей сохраняются память (78%) и процессы анализа и синтеза (79%). В отличие от двух приведенных выше диагнозов, при интеллектуальной недостаточности легкой степени тяжести все когнитивные функции (память, внимание, восприятие, пространственная координация, мелкая моторика, ритмическая сенсомоторная деятельность, оперативно-мыслительная деятельность) ослабевают по сравнению с контрольной группой примерно в одинаковой степени – на 19–29%.
Алгоритм лечения детей с когнитивными нарушениями включает лечение основного заболевания (различного генеза) и сопутствующих расстройств интеллектуально-мнестической сферы. Терапия этих расстройств может быть интенсивной (постоянной или временной), общей или специализированной, компенсаторно-восстановительной. Большое значение имеют методы коррекции и адаптации – социальной, психологической, педагогической, семейной. Особое внимание профессор О.И. Маслова уделила ноотропам, которые в неврологии применяются при задержке психического, речевого или моторного развития (а также их сочетании), осложненных формах олигофрении, сочетающихся с гиперактивностью, нарушении внимания и речи. Их используют также при психоорганических синдромах различного генеза, эпилепсии, тиках, гиперкинезах, коррекции и профилактике осложнений психофармакотерапии, неврозах, резистентных затяжных депрессивных состояниях, вегетативных кризах, логоневрозе, энурезе.
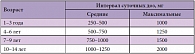
Длительность назначения и доза ноотропов зависят от диагноза и целей лечения. Желательна форма приема «по трапеции», когда доза сначала увеличивается, затем остается стабильной, после чего к окончанию лечения снижается. Между курсами терапии целесообразно делать паузы. Ноотропы обычно принимают утром или днем. Среди множества препаратов профессор О.И. Маслова выделила кальциевую соль гопантеновой кислоты (Пантогам) как препарат, наиболее положительно влияющий на восстановление мнестических функций. Она отметила, что Пантогам зарекомендовал себя эффективным и безопасным препаратом, к его преимуществам можно отнести наличие различных форм выпуска препарата (таблетки по 250 и 500 мг и сироп 10%), что обеспечивает комплаентность лечения у всех категорий пациентов (табл. 1). Пантогам назначают перорально через 15–20 минут после еды 3–4 раза в день. Разовая доза составляет 500–1000 мг для взрослых и 250–500 мг для детей. Суточная доза для взрослых – 1500–3000 мг, а для детей – 750–2000 мг. Курс лечения длится обычно 2–4 месяца (до полугода), повторные курсы – через 3–6 месяцев.
В заключение в качестве клинического примера профессор О.И. Маслова привела схему лечения 3-летнего ребенка с диагнозом «задержка психоречевого развития», которая предусматривает последовательное назначение ряда препаратов. В первые 10 дней назначается Пантогам (250 мг) – 2 таблетки утром и 1 – днем, следующие 10 дней – по 2 таблетки утром и днем, затем 20 дней – по 3 таблетки утром и 2 – днем. После этого дозировку опять постепенно снижают, давая в течение 10 дней по 2 таблетки утром и днем и еще 10 дней 2 таблетки утром и 1 – днем. В начале третьего месяца лечения следует начать прием поливитаминов. В первые 2 недели четвертого месяца лечения ребенку дают Семакс (0,1%, по 2 капли утром и 1 капле днем), а в последующие 2 недели – Глицин (0,1 г, по 2 таблетки утром и днем).
В течение пятого месяца ребенок опять получает поливитамины. На протяжении шестого месяца лечения ему дают Когитум – по 1 ампуле утром с соком. На седьмой месяц повторяют курс лечения четвертого месяца, но в обратной последовательности, то есть в первые две недели дают Глицин, а в последующие 2 – Семакс. Затем начинается курс лечения Пирацетамом (0,4 г): в первые 20 дней – по 1 таблетке утром и днем, следующие 20 дней – 2 таблетки утром и 1 таблетка днем, в последние 20 дней – снова по 1 таблетке утром и днем. На протяжении десятого месяца ребенок снова получает поливитамины. Наконец, в течение 11-го и 12-го месяцев лечения повторяется терапия Пантогамом.
Послеоперационная энцефалопатия включает различные проявления: делирий, аффективные расстройства (дисфория, тревога, депрессия), постоперационную когнитивную дисфункцию (ПОКД), астению. Д.м.н., профессор М.А. ЛОБОВ (руководитель клиники детской неврологии МОНИКИ им. М.Ф. Владимирского) привел следующее определение послеоперационной когнитивной дисфункции. Это когнитивное расстройство, развивающееся в ранний и сохраняющееся в поздний послеоперационные периоды. Клинически оно проявляется в виде нарушений памяти и других высших корковых функций (мышления, речи и др.). Расстройство подтверждается данными нейропсихологического тестирования в виде снижения его показателей не менее чем на 10% от дооперационного уровня. По продолжительности клинических проявлений ПОКД подразделяют на острую (продолжительность клинических проявлений до 1 недели после операции), промежуточную (до 3 месяцев) и долгосрочную (до 1–2 лет).
Распространение ПОКД в европейских странах было изучено у взрослых пациентов в ходе крупнейшего эпидемиологического исследования International Study of Postoperative Cognitive Dysfunction, проведенного в 2 этапа в 1994–1998 и 1998–2000 гг. Было установлено, что ранняя ПОКД имеет место у 19% больных моложе 40 лет и у 69% больных старше 60 лет. Промежуточная ПОКД (до 3 месяцев) отмечена у 6,7% лиц молодого возраста и у 24% пожилых людей. В течение 1–2 лет ПОКД сохраняется у 10,4% от общего числа больных, по истечении 2 лет – у 1–2%. ПОКД приводит к удлинению срока госпитализации, увеличению периоперационных осложнений и летальности, повышает стоимость лечения и ведет к ухудшению качества жизни. Пристальный интерес к проблеме обусловлен высокой частотой ПОКД, нерешенностью вопроса о возможности ее предотвращения, увеличением (в западных странах) числа и размеров судебных исков по поводу последствий анестезии. Выделены следующие предикторы послеоперационной когнитивной дисфункции:
- отягощенный соматический и неврологический анамнез;
- хронические цереброваскулярные заболевания;
- исходное нарушение когнитивных функций в дооперационном периоде;
- возраст пациента (наиболее уязвимы пожилые люди и дети);
- уровень образования (при низком уровне образования угроза ПОКД выше);
- продолжительность общей анестезии более 3,5–4 часов.
Распространенность ПОКД у детей в большой степени зависит от применяемого способа анестезии. При использовании комбинированной анестезии на основе тиопентала натрия, тотальной внутривенной анестезии Кетоналом или при ингаляционной анестезии Фторотаном ПОКД у детей возникает в 100% случаях. Если применять Пропофол, который до недавнего времени считался «золотым стандартом» в анестезии, то вероятность ПОКД, по данным исследований, составит 63%. Нейропсихологическое тестирование 69 детей, перенесших тотальную внутривенную анестезию на основе Пропофола, показывает, что даже через месяц после операции у них не восстановился дооперационный уровень ни краткосрочной, ни долгосрочной памяти, несмотря на то что средняя продолжительность анестезии у них составила всего 64,2 минуты.
В периоперационном периоде при оперативных вмешательствах с использованием тотальной внутривенной анестезии на основе Пропофола развивается синдром ишемии/гиперфузии и «двухволновая» активация свободнорадикальных процессов. Через сутки после наркоза наблюдается диссоциация между параметрами свободнорадикальных процессов и антиоксидантной защиты, свидетельствующая о развитии окислительного стресса и ускорении генетически детерминированного апоптоза, что подтверждается иммунологическими данными. Морфологические исследования подтверждают повреждающее действие тотальной внутривенной анестезии на основе Пропофола на нейронную популяцию головного мозга экспериментальных животных.
Этиопатогенез послеоперационной когнитивной дисфункции формируется в результате воздействия общих анестетиков и гипнотиков, нарушений в системе холинергических и ГАМК-ергических взаимодействий в центральной нервной системе, системной воспалительной реакции. Определенную роль играют также социальная изоляция и иммобилизация пациента, генетическая предрасположенность, электролитные расстройства, нарушения КОС, эффекты микроэмболии и гипоперфузии вещества головного мозга во время искусственного кровообращения, быстрого либо неравномерного согревания в восстановительный период. Нельзя забывать об остаточном действии компонентов общей анестезии, прежде всего анестетиков, а также продуктов их биотрансформации, активных в отношении центральной нервной системы. Большое значение имеет глубина достигаемого во время операции угнетения сознания и антиноцицептивной защиты мозговых структур, несостоятельность которой приводит к перевозбуждению и истощению энергетического баланса нейронов коры большого мозга и подкорковых образований, обеспечивающих достаточный уровень сознания. Как отметил профессор М.А. Лобов, для профилактики ПОКД следует использовать следующий алгоритм действий, который включает:
- идентификацию пациентов с высоким риском развития ПОКД с учетом известных предикторов и проведение нейропсихологического тестирования в дооперационный и послеоперационный периоды;
- обеспечение интраоперационной профилактики ПОКД комплексом неспецифических мероприятий и назначением нейропротекторов; в случае развития ПОКД показано проведение ранней медикаментозной коррекции когнитивных нарушений.
К неспецифической профилактике относится нейромониторинг для оценки степени угнетения сознания во время общей анестезии, управление гемодинамикой (снижение систолического артериального давления ниже 90 мм рт. ст. считается фактором возможного вторичного повреждения головного мозга), обеспечение нормального метаболизма – газообмена, водного, электролитного и углеводного гомеостаза. Для медикаментозной профилактики и коррекции ПОКД у детей средствами выбора являются препараты с поливалентной активностью (антиоксидантной, антигипоксантной, ноотропной) либо комбинации нейропротекторов с различной направленностью действия. Церебропротекторы в возрастной дозировке назначают в течение всего периоперационного периода.
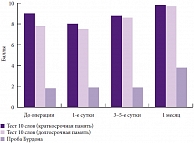
Продолжительность курса лечения диагностированной ПОКД составляет 1–2 месяца. В послеоперационном периоде эффективен препарат Пантогам (рис. 2). «Первые сутки мы давали препарат, на 3–5-е сутки было заметно улучшение, а через месяц показатели были зафиксированы даже выше, чем исходные», – указал профессор М.А. Лобов. В заключение профессор М.А. Лобов подчеркнул, что когнитивные расстройства, развившиеся в результате проведения оперативного вмешательства, и определение оптимального варианта их периоперационной профилактики и коррекции относятся к наиболее важным мультидисциплинарным проблемам современной медицины.
Вегетативная регуляция и латеральные нейропсихологические синдромы в детском возрасте
Заведующий кафедрой неврологии, нейрохирургии и медицинской генетики педиатрического факультета РНИМУ им. Н.И. Пирогова, д.м.н., профессор Н.Н. ЗАВАДЕНКО подчеркнул, что синдром дефицита внимания с гиперактивностью (СДВГ) – это наиболее распространенное психоневрологическое заболевание в детском возрасте, которое в школьные годы отмечается у 3–7% детей. По мере взросления симптоматика ослабевает, но тем не менее она сохраняется в подростковом и даже во взрослом возрасте у 50–60% пациентов, сопровождаясь различными проявлениями дезадаптации.
Нейропсихологическим механизмом развития СДВГ служит дефицит функций лобных и префронтальных отделов мозга. Префронтальные отделы отвечают за управляющие функции и поведенческое торможение. Характерные для СДВГ гиперактивность и импульсивность (или недостаточность поведенческого торможения, волевого контроля), нарушения внимания (или произвольности, саморегуляции) отражают дефицит (или незрелость) управляющих функций мозга (поддержание внимания, удерживание от отвлекающих факторов; торможение, контроль импульсов; прогнозирование, умение распределять время; планирование и управление психическими процессами и др.).
В соответствии с критериями диагноза СДВГ по МКБ-10, диагноз F90 «Гиперкинетическое расстройство» ставят в случае, если у пациента отмечается не менее 6 симптомов невнимательности, 3 – гиперактивности, 1 – импульсивности. По критериям DSM-IV-TR, для постановки этого диагноза достаточно 6 и более симптомов хотя бы по одной из двух групп – невнимательности и гиперактивности/импульсивности. Критерии СДВГ по DSM-IV-TR включают продолжительность (не менее 6 месяцев), возраст начала (первые симптомы в возрасте до 7 лет), нарушения адаптации в двух и более видах окружающей обстановки (например, в школе и дома), существенный характер нарушений (в обучении, социальных контактах, профессиональной деятельности). При этом должны быть исключены другие расстройства – симптомы не могут быть связаны исключительно с течением другого заболевания.
У разных возрастных групп эффекты СДВГ проявляются по-разному. У детей наибольшую роль играют трудности обучения и сложности во взаимоотношениях с другими людьми (и со взрослыми, и с ровесниками). Больные СДВГ не удерживают внимание на деталях, допускают много ошибок. Они с трудом сохраняют внимание при выполнении школьных и других заданий. Часто не слушают обращенную к ним речь, не могут придерживаться инструкций и доводить дело до конца. Такие дети неспособны самостоятельно спланировать, организовать выполнение заданий. Они избегают дел, требующих длительного умственного напряжения, часто теряют свои вещи, легко отвлекаются, проявляют забывчивость. У подростков СДВГ порождает агрессивность, проблемы поведения, повышает вероятность курения и употребления психоактивных веществ. Взрослые могут испытывать проблемы с трудоустройством и в профессиональной деятельности, они также чаще других попадают в автотранспортные происшествия и, главное, чаще других нарушают закон.
Проблемы в обучении, поведении и эмоциональной сфере могут быть связаны как с непосредственным влиянием СДВГ, так и с коморбидными расстройствами, которые должны быть своевременно выявлены. В процессе диагностики СДВГ и динамического наблюдения за пациентами важно оценивать не только выраженность основных симптомов, но также и показатели социально-психологического функционирования и качества их жизни. Коморбидность свойственна большинству пациентов с СДВГ. Лишь у 31% больных этот диагноз встречается в «чистом» виде. У 48% пациентов СДВГ сочетается с оппозиционно-вызывающим расстройством, у 38% – с тревожными/аффективными расстройствами, у 14% – с расстройством поведения, у 11% – с тиками.
Концепция расширенного терапевтического подхода при СДВГ предусматривает не только коррекцию основных симптомов заболевания, но и решение других связанных с СДВГ проблем в жизни ребенка (отношения внутри семьи, самооценка, уверенность в своих силах, удовлетворенность, признание окружающими и т.д.). Дети с СДВГ нуждаются в помощи родителей, педагогов и психологов. Родителям надо помочь разобраться в причинах трудностей поведения и обучения у ребенка, дать советы по воспитанию, учить членов семьи избегать новых конфликтных ситуаций. Для детей и подростков полезна психотерапия по преодолению трудностей и развитию навыков общения. Профессор Н.Н. Заваденко порекомендовал использовать интернет-ресурсы www.adhd-kids.narod.ru и www.sdvg-impuls.ru, которые содержат информацию для родителей и педагогов детей с СДВГ.
Фармакотерапия СДВГ назначается по индивидуальным показаниям в тех случаях, когда когнитивные и поведенческие нарушения у ребенка не могут быть преодолены лишь с помощью немедикаментозных методов. В качестве лекарств в России традиционно используют препараты ноотропного ряда. Было проведено исследование терапевтического потенциала Пантогама при длительном лечении детей, страдающих СДВГ, в котором приняли участие 32 пациента (23 мальчика и 9 девочек) в возрасте от 6 до 12 лет. Курс монотерапии Пантогамом длился от 4 до 8 месяцев. Таблетки по 250 мг назначались в суточной дозе 500–1000 мг (20–30 мг/кг) в два приема, утром и днем, после еды. В начале лечения проводили постепенное наращивание суточной дозы. Продолжительность терапии определялась индивидуально в зависимости от динамики клинических симптомов. У большинства пациентов (69%) она составила 6 месяцев, у шестерых (19%) – 4 месяца, у четверых (12%) – 8 месяцев.
Клинически значимое улучшение со снижением общего балла по шкале СДВГ – DSM-IV более чем на 25% достигнуто у 21 из 32 пациентов. Почти у половины детей с СДВГ (14 человек) улучшение наступило уже после 2 месяцев лечения, у 5 – через 4 месяца и у 2 – через 6 месяцев. «Действительно, бывает, что 2–3 месяцев лечения недостаточно для того, чтобы терапевтический потенциал Пантогама реализовался полностью», – подчеркнул профессор Н.Н. Заваденко.
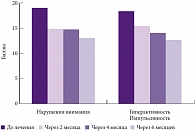
В подгруппе пациентов с положительным эффектом лечения незначительно выраженные побочные явления зарегистрированы только в 4 случаях (3 – появление эмоциональной лабильности, 1 – беспокойный сон). Динамика показателей по шкале СДВГ – DSM-IV на фоне лечения Пантогамом доказывает статистически значимое уменьшение и нарушений внимания, и гиперактивности/импульсивности (рис. 3). Динамика показателей по шкале М. Вейсс (в данной шкале высокие баллы отражают сильные функциональные нарушения) на фоне лечения Пантогамом также была положительной. За 6 месяцев эти показатели уменьшились на 25–40%. «Таким образом, усилия специалистов должны быть направлены на раннее выявление СДВГ. Разработка и комплексная коррекция должны осуществляться своевременно, носить индивидуальный характер. Коррекция, в том числе индивидуальная терапия, безусловно, должна быть достаточно продолжительной», – завершая свое выступление, отметил профессор Н.Н. Заваденко.
Эффективность Пантогама при лечении гиперкинетических расстройств у детей
Доклад зам. главного врача Московского НИИ педиатрии и детской хирургии, к.м.н. А.И. КРАПИВКИНА был посвящен вопросам применения энерготропной терапии при нарушениях познавательных функций и поведения у детей, к которым относятся нарушения вербально-мнестической функции (сужение объема памяти, нарушение воспроизведения заданной последовательности слов и зрительных образов, недостаточность слухоречевого гнозиса, дефекты регуляции и контроля памяти), нарушения внимания (плохая переключаемость, инертность), поведенческие расстройства (эмоциональная лабильность).
В настоящее время существует несколько теорий формирования нарушений психологического развития и поведения у детей: перинатальная, нейробиологическая, нейропсихологическая, нейроанатомическая, теория токсических веществ, инфекционная, метаболическая и наиболее активно обсуждаемая в литературе – дизэнергетическая, на которой А.И. Крапивкин подробно остановился. «Метаболическое направление» в медицине формирует представление о роли митохондриальных нарушений (тканевой гипоксии) в развитии и течении самых разнообразных патологических процессов.
Митохондриальная патология – область медицины, изучающая комплекс заболеваний, связанных с развитием тканевой гипоксии и нарушениями клеточного обмена. В митохондриях происходят многие важные биохимические процессы: цикл трикарбоновых кислот, окисление жирных кислот, карнитиновый цикл, транспорт электронов в дыхательной цепи (с помощью I–IV ферментных комплексов), окислительное фосфорилирование (V ферментный комплекс).
В докладе А.И. Крапивкина приведена классификация групп заболеваний и состояний, характеризующихся нарушениями клеточного энергообмена: митохондриальные болезни, «вторичные» митохондриальные дисфункции (эндогенные, экзогенные), энергодефицитный диатез.Митохондриальные болезни – впервые выявленная в 1962 г. гетерогенная группа заболеваний, обусловленных генетическими, структурными, биохимическими дефектами митохондрий. Основными нозологическими формами митохондриальных заболеваний являются синдром MELAS (митохондриальная энцефаломиопатия, лактат-ацидоз, инсультоподобные эпизоды); синдром MERRF (миоклонус-эпилепсия с разорванными красными волокнами); синдром NARP (нейропатия, атаксия, пигментный ретинит); оптическая нейропатия Лебера и др. При митохондриальных нарушениях применяют препараты, переносящие электроны в дыхательной цепи (витамины K1 и K3, коэнзим Q10, янтарная кислота, цитохром C), лекарственные средства, служащие кофакторами энергообмена (витамины PP, B1, B2, липоевая кислота, биотин, карнитин) и уменьшающие степень лактат-ацидоза (дихлорацетат и димефософон), антиоксиданты (витамины C и E) и др.
Митохондриальная дисфункция не всегда выражается в форме резко выраженной самостоятельной патологии. Она либо является своего рода вторичным нарушением, либо сказывается на характере течения других болезней (так называемые вторичные митохондриальные дисфункции). Вторичные митохондриальные нарушения возникают при наследственных обменных заболеваниях (гликогенозах, болезни Вильсона – Коновалова и др.), аутоиммунных заболеваниях (рассеянном склерозе, системной красной волчанке и др.), эндокринных болезнях (диабете 1-го и 2-го типа, гипотиреозе), нейродегенеративных заболеваниях и др. Нарушения функции митохондрий приводят к недостаточности энергообеспечения центральной нервной системы, поскольку нервная ткань является наиболее энергозависимой в организме, так как от 40 до 60% энергии аденозинтрифосфата (АТФ) в нейронах тратится на поддержание ионного градиента на наружной оболочке и передачу нервного импульса.
В докладе А.И. Крапивкина обсуждается гипотеза, что нарушения клеточной энергетики, связанные с митохондриальной дисфункцией, становятся причиной дисфункции центральной нервной системы у детей с расстройствами психологического развития и поведения. Была исследована группа из 63 детей, посещающих специализированные (коррекционные) группы детских дошкольных учреждений и имеющих диагнозы F80–F98 по МКБ-10. Дети были разделены на группы в зависимости от расстройства психологического развития и поведения:
- группа 1 (n = 20) с нарушениями формирования устной речи;
- группа 2 (n = 22) с синдромом дефицита концентрации внимания и гиперактивностью;
- группа 3 (n = 21) с проявлениями общего отставания в развитии (задержки темпового психоречевого развития);
- контрольная группа (n = 15) детей без отклонений в нервно-психическом развитии.
Группа 1 (дети с нарушениями развития речи) отличалась от контрольной на цитохимическом уровне активностью митохондриальных ферментов, причем отличия по активности сукцинатдегидрогеназы (СДГ) и глицерофосфатдегидрогеназы (ГФДГ) были статистически значимы. Для детей с дефицитом концентрации внимания (группа 2) также были характерны изменения активности ферментов, но достоверные отличия от контроля выявлены только по ГФДГ.
Отклонения показателей цитохимической активности митохондриальных ферментов достоверно коррелировали с различными формами нарушений психологического развития и поведения у детей. Варианты изменений показателей энергообмена специфичны для каждой из 3 обследованных групп пациентов. В исследовании дети получали левокарнитин (L-карнитин) для приема внутрь – препарат Элькар (раствор), в 1 мл которого содержится 0,2 г L-карнитина. Прием лекарства – по половине чайной ложки 2 раза в день в течение месяца.
Энерготропная терапия L-карнитином способствовала нормализации активности митохондриальных ферментов у детей с нарушениями развития речи (группа 1), что привело к достоверному улучшению у них слуховой вербальной кратковременной памяти и увеличению объема отсроченной памяти. Корректурная проба (метод оценки внимания) также дала достоверно лучшие результаты. У детей с дефицитом концентрации внимания (группа 2) энерготропная терапия L-карнитином привела к нормализации активности ГФДГ при незначительном влиянии на активность других митохондриальных ферментов.
Энерготропная терапия привела к достоверному улучшению у данной группы детей зрительной памяти и увеличению объема отсроченной памяти, а также к значимому улучшению внимания по данным корректурной пробы. У детей с задержкой темпов развития (группа 3) нормализовалась активность СДГ при отсутствии существенных изменений активности других митохондриальных ферментов. Как следствие, у этих детей заметно улучшились внимание и зрительная память. Однако, в отличие от первых двух групп, улучшение не было статистически значимым.
По результатам проведенного исследования А.И. Крапивкин сделал вывод, что нарушения клеточного энергообмена (митохондриальные нарушения), по-видимому, становятся причиной развития нарушений психологического развития и поведения у детей или как минимум могут способствовать их проявлению. Различные паттерны изменений исходных цитохимических показателей свидетельствуют, по-видимому, о специфичности патогенетического участия митохондриальных дисфункций у детей с различными формами нарушений психологического развития и поведения.
«Результаты исследования до и после энерготропной терапии свидетельствуют как о нормализации показателей митохондриальных ферментов, так и об эффективности использования энерготропной терапии для коррекции нарушений психологического развития и поведения – показателей вербальной и зрительной памяти, внимания, переносимости психоэмоциональных нагрузок», – подчеркнул А.И. Крапивкин.
Энерготропные препараты целесообразно использовать при лечении нарушений нервно-психического развития (в том числе при органических поражениях нервной системы, диэнцефальной дисфункции, расстройствах эмоционально-волевой сферы, нервной регуляции и поведения) в составе комплексной терапии дисциркуляторной и травматической энцефалопатии, митохондриальной энцефаломиопатии, а также при лечении нервно-мышечных заболеваний.
Выступления ведущих специалистов в области детской неврологии были посвящены нарушениям когнитивных функций при различных заболеваниях у детей, а также многообразию препаратов, используемых для лечения нарушений в когнитивной сфере. Отдельно было сказано об опасности послеоперационной когнитивной дисфункции у детей, которая является закономерным следствием большинства современных методов анестезии. Подчеркнута необходимость использования более безопасных способов анестезии и обязательного назначения нейропротекторов до и после операции.
Широкое распространение в популяции получил синдром дефицита внимания и гиперактивности у детей. Велика частота его сочетания с другими психоневрологическими расстройствами. Был приведен алгоритм эффективной и безопасной терапии СДВГ. Доложены результаты плацебоконтролируемого клинического исследования применения Пантогама. Доказано, что этот препарат улучшает внимание, краткосрочную и долгосрочную вербальную и зрительную память у детей 6–12 лет с гиперкинетическими расстройствами, уменьшает уровень депрессии и тревоги.
На симпозиуме было уделено особое внимание гипотезе, согласно которой в основе многих психоневрологических расстройств лежит нарушение работы клеточных «энергетических станций» – митохондрий. Приведены примеры успешной терапии препаратом Элькар таких разных заболеваний у детей, как нарушения развития речи, синдром дефицита внимания и задержка темпов развития.