Новое направление в локальной терапии остеоартроза коленных суставов
- Аннотация
- Статья
- Ссылки


Показатели распространенности ОА варьируют в различных возрастных и этнических группах и зависят от локализации патологического процесса и половой принадлежности. В среднем ОА страдают около 10% всего населения и почти половина всех пациентов в мире старше 50 лет [2, 3]. По данным Минздравсоцразвития РФ, с 2000 по 2009 г. число больных ОА увеличилось более чем в 2 раза, а распространенность заболевания (на 100 тыс. населения) возросла за 10 лет на 51,1%.
Основным клиническим симптомом ОА является боль в суставах различной интенсивности и продолжительности: у 25% больных старше 50 лет интенсивность боли так высока, что приводит не только к ограничению функциональной активности, но и к полной потере трудоспособности [4, 5]. У пожилых пациентов продолжительность жизни зависит в большей степени от интенсивности боли, чем от сопутствующих заболеваний [5].
Основная цель терапии ОА коленных суставов (ОА КС) – минимизация боли и улучшение качества жизни пациентов. В последние годы в лечении ОА КС достигнут значительный прогресс, однако остается нерешенной крайне актуальная проблема безопасности применяемых лекарственных средств, особенно у больных пожилого возраста.
Последние рекомендации OARSI (Osteoarthritis Research Society International) и Общероссийской общественной организации «Ассоциация ревматологов России» по терапии ОА КС регламентируют применение различных групп лекарственных средств, в том числе локальных нестероидных противовоспалительных препаратов (НПВП) [6, 7]. Локальные НПВП широко применяются при ОА, однако риск развития системных (желудочно-кишечных и кардиоваскулярных) нежелательных явлений достаточно высок [8, 9]. В связи с этим поиск средств локальной анальгезии продолжается. Оптимальный лекарственный препарат (или метод) не должен представлять прямой или непрямой опасности для пациента и требовать постоянного медицинского наблюдения [9].
Особый интерес вызывают лечебные пластыри, созданные на основе нанотехнологий, в частности Нанопласт Форте (НФ), обладающий анальгетическим и миорелаксирующим действием. Пластырь содержит магнитный слой из редкоземельных металлов и нанопорошок, продуцирующий длинноволновое инфракрасное излучение.
К моменту начала нашего исследования работ, посвященных изучению сравнительной эффективности пластыря НФ и плацебо, не проводилось.
Цель исследования заключалась в оценке эффективности, системной и локальной переносимости НФ в сопоставлении с пластырем-плацебо у больных ОА КС.
Материалы и методы
В двойное слепое двухнедельное проспективное сравнительное рандомизированное многоцентровое плацебоконтролируемое исследование было включено 120 пациентов с ОА КС I–III рентгенологических стадий по Kellgren и Lowrence. Критериями включения в исследование являлись подписанное пациентом информированное согласие, интенсивность боли в анализируемом (целевом) суставе ≥ 40 мм по визуальной аналоговой шкале (ВАШ), отсутствие клинически значимых нарушений функции печени и почек, прием НПВП в стабильной дозе не менее 4 недель до исследования, адекватная стабильная терапия сопутствующих заболеваний. В исследование не включали пациентов со вторичным ОА; иными ревматическими заболеваниями (ревматоидный артрит, болезнь Бехтерева и др.); синовитом коленных суставов, требующим введения кортикостероидов; тяжелыми сопутствующими заболеваниями; поражением кожных покровов в области коленного сустава.
Первичным критерием эффективности являлось уменьшение боли в целевом коленном суставе (индекс WOMAC, раздел А) на ≥ 50% от исходного уровня. Кроме того, в процессе исследования проводилась в динамике оценка боли по критериям разделов В и С индекса WOMAC; общая оценка эффекта лечения раздельно больным и врачом по ВАШ, ежедневная оценка больным интенсивности боли в мм по ВАШ. Суммарная оценка эффективности НФ проводилась на 14-й день раздельно врачом и больным по следующим градациям: 1 – значительное улучшение; 2 – улучшение; 3 – отсутствие эффекта; 4 – ухудшение. Потребность в приеме НПВП подсчитывалась на протяжении исследования: рассчитывалась суточная доза, уменьшение дозы или полная отмена НПВП в связи с уменьшением интенсивности болевого синдрома.
Переносимость НФ и пластыря-плацебо оценивалась по частоте и выраженности (в баллах от 1 до 3) локальных и/или системных нежелательных явлений. Статистическая обработка полученных результатов проведена с использованием прикладных программ Statistica.
Результаты и их обсуждение
В исследование в соответствии с кодом рандомизации включено 120 пациентов ОА КС, по 60 больных в обеих группах. По возрасту, продолжительности ОА, длительности обострения, индексу массы тела (ИМТ), интенсивности боли в коленных суставах, другим клиническим параметрам и общей активности болезни обе группы были полностью сопоставимы (см. табл.).
В целом в анализируемых группах преобладали женщины (97 больных) с II–III стадиями ОА КС (93,3%); продолжительностью ОА 7,7 года и длительностью обострения 8,9 недель. Среднее значение ИМТ составило 29,5 кг/м2. У 55 (73%) больных был диагностирован двухсторонний ОА КС. Среди сопутствующих болезней наиболее часто (57,5%) отмечалась артериальная гипертензия.
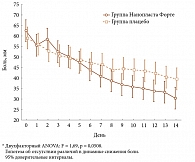
Частота достижения 50-процентного уменьшения боли (подшкала А индекса WOMAC) была достоверно выше в группе активного НФ, чем в группе плацебо (38,2% и 16,7% соответственно, р = 0,013; точный критерий Фишера). Интенсивность боли при ходьбе уменьшилась только при использовании активного НФ (р = 0,05; двухфакторный анализ ANOVA), причем достоверное уменьшение боли было отмечено уже на 4-й день применения НФ (рис. 1).
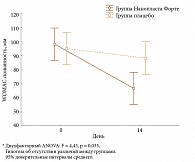
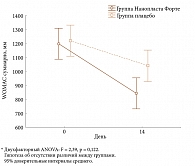
Суммарный показатель боли по индексу WOMAC в основной группе также уменьшился достоверно: с 235,1 до 149,4 мм, что свидетельствует о выраженном анальгетическом эффекте НФ (рис. 2). На фоне лечения в основной группе достоверно уменьшилась утренняя скованность (рис. 3) и увеличилась функциональная активность (рис. 4). Общее состояние больных по субъективной оценке (р = 0,05) и по мнению врача (р = 0,01) улучшилось статистически значимо. Отмена и уменьшение дозы НПВП происходили достоверно (р = 0,007; точный критерий Фишера) чаще в группе больных, применявших активный НФ, чем в группе плацебо: у 23 и 7 пациентов соответственно, то есть почти у половины больных.
При общей оценке эффективности НФ в основной группе у 82% пациентов отмечалось значительное улучшение. На фоне применения плацебо в 52% случаев эффекта от лечения не было, 5% больных оценили свое состояние как ухудшение.
В группе активного лечения все пациенты полностью завершили исследование. Нежелательных явлений (НЯ), связанных с применением НФ, не выявлено. У одного пациента зарегистрировано обострение хронического гастрита, что исследователи не связали с использованием НФ. В группе плацебо отмечалось по одному случаю ОРВИ и гипертонического криза, не связанных с применением пластыря-плацебо; зарегистрированы 2 локальных НЯ: кожный зуд слабой выраженности и аллергический дерматит. В связи с последним пластырь-плацебо был отменен на 4-й день.
Заключение
Высокая анальгетическая активность Нанопласта Форте способствует улучшению функциональной активности пациентов с ОА КС. Преимуществами НФ являются его отличная переносимость и возможность уменьшения дозы или отмены НПВП на фоне применения пластыря. Нанопласт Форте может быть рекомендован как метод дополнительной локальной терапии при ОА КС.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.