количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Практика
Новые подходы к оценке эффективности терапии и достижения биологической ремиссии болезни Крона (клинический случай)
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Гастроэнтерология" Спецвыпуск №1 (7)
- Аннотация
- Статья
- Ссылки
- English
На примере клинического случая обоснована необходимость непрерывного мониторинга болезни Крона, проводимого с контролем достижения не только клинической и эндоскопической, но и биологической ремиссии при помощи неинвазивных биологических маркеров активности воспалительного процесса (С-реактивный белок сыворотки и фекальный кальпротектин). Показана возможность достижения глубокой ремиссии на фоне терапии ингибитором фактора некроза опухоли альфа адалимумабом у больной, потерявшей ответ на терапию инфликсимабом.
На примере клинического случая обоснована необходимость непрерывного мониторинга болезни Крона, проводимого с контролем достижения не только клинической и эндоскопической, но и биологической ремиссии при помощи неинвазивных биологических маркеров активности воспалительного процесса (С-реактивный белок сыворотки и фекальный кальпротектин). Показана возможность достижения глубокой ремиссии на фоне терапии ингибитором фактора некроза опухоли альфа адалимумабом у больной, потерявшей ответ на терапию инфликсимабом.
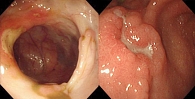
Рис. 1. Больная К., 29 лет. Колоноскопия. А – глубокие, дискретные продольные язвы с подрытым краем. Б – продольные язвы, соединяющиеся поперечными трещинами с островками отечной слизистой оболочки
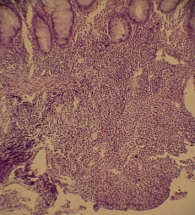
Рис. 2. Больная К., 29 лет. Очаговая воспалительная инфильтрация собственной пластинки толстой кишки. Клетки воспалительного инфильтрата проникают за пределы собственной мышечной пластинки в подслизистый слой
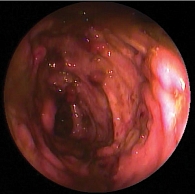
Рис. 3. Больная К., 29 лет. Колоноскопия через 12 недель от начала терапии инфликсимабом. Слизистая оболочка слепой и восходящего отдела толстой кишки гиперемирована. Сосудистый рисунок прослеживается на отдельных участках. На стенках единичные геморраги
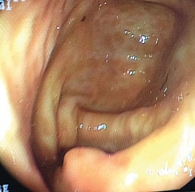
Рис. 4. Больная К., 29 лет. Колоноскопия. Слизистая оболочка толстой кишки через 16 недель после начала терапии адалимумабом. Единичные афты
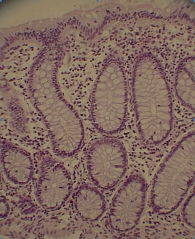
Рис. 5. Больная К., 29 лет. Контрольная биопсия слизистой оболочки толстой кишки через 16 недель после терапии адалимумабом. Крипты обычной глубины. Эпителиальная выстилка крипт содержит большое количество бокаловидных клеток. Собственная пластинка слабо
Болезнь Крона (БК) (англ.Crohn’s disease, синоним – гранулематозный энтерит, регионарный энтерит, трансмуральный илеит, терминальный илеит) – хроническое неспецифическое гранулематозное трансмуральное воспаление, которое может поражать все отделы желудочно-кишечного тракта (ЖКТ), начиная от полости рта и заканчивая прямой кишкой, с наиболее частой локализацией поражения в илеоцекальном отделе. Впервые БК описал в 1932 г. американский гастроэнтеролог Баррил Б. Крон (Burrill B. Crohn) совместно со своими коллегами Леоном Гинзбургом (Leon Ginzburg) и Гордоном Д. Оппенгеймером (Gordon D. Oppenheimer) [1].
Болезнь Крона является хроническим воспалительным иммуноопосредованным прогрессирующим деструктивным заболеванием, к которым также относятся ревматоидный артрит, рассеянный склероз и др. Точная этиология заболевания остается неизвестной. Однако существует общепринятая гипотеза патогенеза БК, которую можно представить следующим образом: воспаление слизистой оболочки ЖКТ развивается у лиц с генетической предрасположенностью вследствие неадекватного и чрезмерного иммунного ответа со стороны иммунной системы слизистой оболочки ЖКТ на факторы внешней среды, включая кишечную микрофлору. Иммунный ответ слизистой оболочки при БК характеризуется воспалительной реакцией по типу Т1-хелперного ответа с активацией множества воспалительных цитокинов, одну из ключевых ролей среди которых играет фактор некроза опухоли альфа (ФНО-альфа) [2–5].
Для заболевания типично чередование периодов клинической ремиссии и рецидивов с возобновлением клинических симптомов. Каждый четвертый больной испытывает постоянные симптомы заболевания (хроническое непрерывное течение) [6]. Медико-социальная актуальность БК обусловлена не только неясной этиологией и сложностью патогенеза, но и прогрессирующим характером течения заболевания, что предопределяет непредсказуемость эффекта от проводимого лечения, развитие осложнений, требующих оперативного вмешательства, зачастую представляющих угрозу жизни и приводящих к инвалидизации больных [7].
Традиционная терапия БК включает препараты 5-аминосалициловой кислоты, глюкокортикостероиды (ГКС), иммуносупрессоры и антибиотики. Современные руководства по лечению БК, основанные на результатах метаанализов, подвергают серьезному сомнению клиническую значимость препаратов 5-аминосалициловой кислоты для индукции и поддержания ремиссии БК [8]. ГКС вообще не способны поддерживать ремиссию заболевания [9]. Кроме того, лечение традиционными препаратами не предотвращает прогрессирование БК: при среднем периоде наблюдения чуть более 8 лет осложнения развиваются у 60% больных [10]. Очевидно, что даже в отсутствие симптомов заболевание может прогрессировать на фоне непрерывного воспалительного процесса.
Разумеется, для улучшения отдаленных результатов наблюдения больных БК, предотвращения прогрессирования заболевания помимо эффективных препаратов, способных контролировать воспалительный процесс, требуется изменение парадигмы лечения. Целью лечения должно быть не только устранение симптомов, но и строгий мониторинг объективных параметров воспаления. Новый подход «лечение до цели» (англ. treat-to-target), уже разработанный и внедренный в руководства по лечению ревматоидного артрита, заключается в том, что пациенту подбирается индивидуальная терапия с предварительно заданной терапевтической целью: достижение низкого уровня активности заболевания или состояния ремиссии. При этом каждые 3 месяца осуществляется мониторинг эффективности терапии. В случае если заданное состояние поддерживается, лечение данного больного продолжается в прежнем режиме, если цель не достигнута – терапия оптимизируется (интенсифицируется или меняется) [11]. Оправданность применения данного подхода при лечении ревматоидного артрита подтверждена в крупных исследованиях [12].
Прогресс в изучении молекулярных мишеней воспаления при воспалительных заболеваниях кишечника (ВЗК) и появление антицитокиновой (биологической) терапии привели к эволюции целей лечения: достижение клинической ремиссии в более короткие сроки, поддержание ремиссии без ГКС, полное заживление слизистой оболочки кишечника и закрытие свищей, снижение потребности в операциях и госпитализации. Достижение этих целей позволяет улучшить качество жизни больных ВЗК и сохранить их социальную активность.
В настоящее время для лечения БК в Российской Федерации зарегистрировано три биологических препарата – инфликсимаб (ИНФ), адалимумаб (АДА) и цертолизумаба пегол. Все они являются ингибиторами ФНО-альфа, однако различаются по своей структуре. ИНФ и АДА представляют собой моноклональные антитела, специфически блокирующие ФНО-альфа. Последовательность белка в ИНФ – химерная (75% идентично человеческому белку и 25% – мышиному) [13]. АДА по своей структуре полностью идентичен человеческому иммуноглобулину G1 [14]. Цертолизумаба пегол представляет собой Fab`-фрагмент гуманизированного антитела (специфичного к ФНО-альфа), присоединенный к молекуле полиэтиленгликоля [15].
В соответствии с современными представлениями понятие ремиссии БК претерпевает изменения. Сегодня ремиссия БК определяется как состояние, при котором вероятность дальнейшего прогрессирования заболевания мала или отсутствует, что подразумевает отсутствие биологических и гистологических признаков воспаления, а не только симптомов заболевания (англ. remission beyond symptoms ) [11]. «Золотым стандартом» ремиссии при БК в настоящее время считается клиническая ремиссия (контроль симптомов) при условии эндоскопической ремиссии (заживление слизистой оболочки). Однако, как известно, БК – заболевание, охватывающее все слои кишечной стенки. В этой связи дискутируется вопрос о необходимости включения в критерии ремиссии БК альтернативных методов оценки трансмурального заживления слизистой оболочки: магнитно-резонансной энтерографии, компьютерной томографической энтерографии и трансабдоминального ультразвукового исследования [16].
С учетом последних достижений в лечении и диагностике БК назрела необходимость дополнить определение ремиссии БК новыми критериями. На сегодняшний день очевидно, что воспалительный процесс в кишечнике может протекать без явных клинических симптомов. Существующие понятия «клиническая ремиссия», «эндоскопическая ремиссия», характеризующаяся заживлением слизистой оболочки, дополнены понятием «биологическая ремиссия». Биологическая ремиссия БК подразумевает отсутствие симптомов заболевания, заживление слизистой оболочки кишечника, подтвержденное в том числе и радиографическими методами, а также нормализацию уровня сывороточных и фекальных биомаркеров активного воспаления.
В гастроэнтерологическом сообществе активно обсуждаются вопросы о том, что можно считать истинной ремиссией и какие биологические маркеры потенциально могут быть использованы для оценки наступления этого состояния. Среди биологических маркеров наиболее изучены С-реактивный белок сыворотки (СРБ) и фекальный кальпротектин (ФКП). При условии исключения инфекционного процесса определяемый уровень СРБ < 5 мг/мл свидетельствует об отсутствии воспаления и благоприятном прогнозе течения заболевания.
Анализ результатов клинического исследования STORI (Study of infliximab discontinuation in Crohn’s disease patients in stable remission on combined therapy with immunosuppressors – Исследование отмены инфликсимаба при стабильной ремиссии болезни Крона на фоне комбинированной иммуносупрессивной терапии) показал, что концентрация СРБ < 5 мг/мл может свидетельствовать о заживлении слизистой оболочки, при этом метод определения СРБ характеризуется достаточно высокой чувствительностью (> 70%), но низкой специфичностью (< 40%). Концентрация ФКП < 250 мкг/г указывает на заживление слизистой оболочки с большей достоверностью, чем СРБ, особенно в случае толстокишечной локализации БК. Чувствительность этого показателя превышает 80%, но специфичность невелика – около 50%. Однако при одновременном применении обоих маркеров возможно повысить специфичность до уровня > 70% [17].
В настоящее время проводятся исследования новых биомаркеров и панелей биомаркеров в качестве более подходящих кандидатов для оценки ремиссии БК. Использование таких биомаркеров может предоставить более глубокую, носящую прогностическую ценность информацию о ремиссии, а не только свидетельствовать о заживлении слизистой оболочки.
Тем не менее на данный момент именно заживление слизистой оболочки остается критерием эффективности и желаемой значимой конечной точкой в клинических исследованиях, оценивающих ответ на лечение БК. Под заживлением слизистой оболочки общепринято понимать полное отсутствие изъязвлений слизистой оболочки, кроме небольшого числа афтозных язв до 5 мм в диаметре [18–20].
В исследованиях показано, что способностью заживлять слизистую оболочку обладают ингибиторы ФНО-альфа. При назначении ИНФ в открытом режиме заживление слизистой оболочки достигалось у 30% (28/93) пациентов на 26-й неделе [21]. Улучшение этого параметра может наблюдаться уже через 4 недели терапии ИНФ и сильно коррелировать с индексом активности БК (ИАБК) [22]. Определение наиболее эффективного режима дозирования ИНФ проводилось у пациентов с умеренной и тяжелой формами БК. Оказалось, что на фоне индукционного курса ИНФ заживление слизистой оболочки происходило у 29% пациентов (13/45) к 10-й неделе, а при однократной инфузии – только в 3% случаев. Отсутствие заживления слизистой оболочки было связано с увеличением частоты госпитализации и проведения операций. При длительной терапии биологическими препаратами постоянное поддерживающее лечение ИНФ более эффективно для достижения заживления слизистой оболочки, чем эпизодическое назначение, – 44% (16/36) против 18% (4/22) через 12 месяцев [23]. Заживление слизистой оболочки рассматривается как прогностический фактор, который может быть ассоциирован с возможностью отмены иммуносупрессивной терапии в дальнейшем [24]. АДА при проведении индукционного курса и продолжении поддерживающего лечения также был эффективнее в отношении заживления слизистой оболочки, чем только индукционный курс [25].
Как уже упоминалось, в настоящее время формируется новая парадигма понятия ремиссии БК – remission beyond symptoms. Первым шагом в этом направлении можно считать клиническое исследование EXTEND (Extend the safety and efficacy of adalimumab through endoscopic healing – Увеличение безопасности и эффективности терапии адалимумабом путем достижения эндоскопического заживления) с применением АДА. Исследователи ввели термин «глубокая ремиссия» (англ. deep remission), который включал клиническую ремиссию, определяемую по ИАБК (< 150 баллов), и полное заживление слизистой оболочки. Результаты EXTEND впервые показали достижимость не только клинической, но и клинико-эндоскопической (глубокой) ремиссии при применении ингибитора ФНО-альфа, что является частью понятия remission beyond symptoms. EXTEND – проспективное, рандомизированное, плацебоконтролируемое исследование продолжительностью 1 год, в котором по таким параметрам, как индукция и поддержание заживления слизистой оболочки, сравнивали два режима терапии АДА: непрерывное лечение АДА и индукционный курс АДА с последующим плацебо-контролем. Через год у 19,4% пациентов, получавших АДА непрерывно раз в две недели после индукционного курса, было отмечено достижение глубокой ремиссии, тогда как в группе плацебо (только индукционный курс АДА) пациенты с клинико-эндоскопической ремиссией отсутствовали [26].
В клинической программе EXTEND также показано, что достижение глубокой ремиссии сопровождается улучшением результатов лечения. Пациенты, достигшие ранней (к 12-й неделе) глубокой ремиссии, спустя 1 год реже нуждались в госпитализации и связанных с БК оперативных вмешательствах в отличие от пациентов, не достигших ранней глубокой ремиссии [27]. Эти пациенты также имели достоверно более высокое качество жизни и в меньшей степени были ограниченны в отношении работоспособности и активности [27]. Кроме того, ранняя глубокая ремиссия обеспечила экономию затрат на медицинскую помощь в размере около 9000 долларов США в год [28].
Согласно результатам одного рандомизированного контролируемого исследования и девяти когортных исследований, АДА демонстрирует клиническую эффективность после предыдущего неудачного лечения инфликсимабом у пациентов с БК. Клиническая ремиссия зарегистрирована у 12–67% пациентов в период инициирующей терапии и у 29–72% больных во время проведения поддерживающей терапии. Клинический ответ на АДА составлял от 29 до 83% во время инициирующей терапии и 31–59% в течение поддерживающего лечения [29].
В исследованиях цертолизумаба пегола – еще одного ингибитора ФНО-альфа также показана эффективность препарата в достижении заживления слизистой оболочки: признаки заживления слизистой оболочки наблюдались у 5% пациентов на 10-й неделе, а эндоскопическое улучшение – у 42% пациентов [19].
Разбор клинического случая
Приводим клинический случай, в котором покажем необходимость непрерывного мониторинга БК с более жестким контролем достижения ремиссии с помощью биомаркеров, а также возможность достижения глубокой ремиссии у больной, получающей АДА после ранее проводимой терапии ИНФ.
Больная К. (29 лет). Поступила в отделении патологии кишечника Центрального научно-исследовательского института гастроэнтерологии (ЦНИИГ) Московского клинического научно-практического центра Департамента здравоохранения г. Москвы (МКНЦ ДЗМ) с жалобами на кашицеобразный стул до 8 раз в сутки, с примесью слизи. Схваткообразные боли в левой подвздошной области, уменьшающиеся после дефекации, боли в межфаланговых суставах кистей и стоп, подъем температуры вечером до 37,2–37,4 °С, снижение массы тела на 10 кг за год.
Родилась в 1984 г. в Москве. Служащая. Условия жизни удовлетворительные. Сопутствующие заболевания – язвенная болезнь двенадцатиперстной кишки (ДПК), хронический гастрит. Не курит.
Считает себя больной с 2006 г., когда появились острые боли в животе. Госпитализирована в ГКБ № 81 с подозрением на перфорацию полого органа. При обследовании выявлена острая язва луковицы ДПК. Проведена стандартная консервативная противоязвенная терапия с положительным эффектом. Эрадикация Helicobacter pylori не проводилась. Отмечала сезонное появление болей в животе, по поводу чего самостоятельно принимала антациды, ингибиторы протонной помпы с положительным эффектом.
Весной 2009 г. появился жидкий стул до 6–8 раз в сутки с примесью слизи, повышение температуры до 38 °С, боли в животе схваткообразного характера. Госпитализирована в ГКБ № 29 с предварительным диагнозом «язвенный колит средней степени тяжести». Колоноскопия (05.2009): осмотр до купола слепой кишки, картина язвенного колита с преимущественным поражением прямой кишки с поверхностными эрозиями и подслизистыми кровоизлияниями, сосудистый рисунок отсутствует, контактная кровоточивость.
На фоне терапии преднизолоном в/в, месалазином 3 г/сут, метронидазолом, микроклизм с гидрокортизоном отмечена положительная динамика – стул 1 раз в сутки, температура нормализовалась. При выписке: колоноскопия – слизистая прямой кишки умеренно гиперемирована, сосудистый рисунок смазан. Рекомендовано продолжать лечение месалазином 2 г/сут. Принимала препараты нерегулярно. Отмечала постепенное снижение массы тела.
Ухудшение самочувствия с сентября 2011 г., когда после перенесенного острого респираторного вирусного заболевания появился жидкий стул до 8 раз в сутки с примесью слизи, боли в межфаланговых суставах кистей и стоп, подъем температуры вечером до 37,2–37,4 °С. Самостоятельно принимала преднизолон 40 мг/сут, месалазин 2 г/сут с незначительным положительным эффектом. Госпитализирована в ЦНИИГ 08.12.2011. Ректороманоскопия 12.2011: внутренние геморроидальные узлы, умеренно выраженные, не напряженные, без признаков воспаления, в типичных местах; до уровня ректосигмоидного изгиба, на видимых участках слизистая оболочка немного отечна, розовая, гладкая, блестящая, сосудистый рисунок отчетливый; выше ректосигмоидного изгиба определяются геморрагии, линейный язвенный дефект. Заключение: выявленные изменения в большей степени соответствуют болезни Крона толстой кишки без поражения прямой. Внутренний геморрой.
Колоноскопия 12.2011. Эндоскоп проведен в проксимальный отдел сигмовидной кишки. На уровне 40 см по отметкам на эндоскопе выраженное сужение кишки за счет отека. Слизистая оболочка прямой кишки розовая, гладкая, блестящая. Сосудистый рисунок отчетливый, несколько перестроен. Слизистая оболочка дистального отдела сигмовидной кишки умеренно отечна, сосудистый рисунок отсутствует. Определяются мелкие язвенные дефекты, покрытые фибрином. Слизистая оболочка сигмовидной кишки в средней и верхней трети резко гиперемирована, отечная, просвет ее сужен. Определяются глубокие язвенные дефекты линейной формы, расположенные в основном продольно, покрытые фибрином, а также псевдополипозные разрастания, напоминающие булыжную мостовую. Сосудистый рисунок отсутствует. Контактная кровоточивость умеренная. Заключение: болезнь Крона толстой кишки, стадия язв.
Назначено лечение: преднизолон 60 мг/сут, месалазин 3 г/сут, Мезим, Омез 40 мг/сут, азатиоприн 100 мг/сут, Метрoгил 100 в/в кап × 3 р/сут, витамины группы В, глюконат кальция, Сорбифер Дурулес, МД мил Клинипит. После выписки продолжила прием преднизолона с постепенным снижением дозы по 5 мг в неделю, азатиоприна (2 мг/кг) 100 мг/сут, Омеза по 20 мг на время приема преднизолона.
После снижения дозы преднизолона до 15 мг/сут развился рецидив: жидкий стул до 6 раз в сутки, повышение температуры до 37,6 °С.
Госпитализирована повторно в марте 2012 г. с диагнозом «болезнь Крона толстой кишки, обострение высокой степени активности, хроническое рецидивирующее течение с внекишечными проявлениями (полиартралгии) средней степени тяжести, гормональная зависимость; язвенная болезнь ДПК в фазе ремиссии».
Результаты обследования показали: по данным общего анализа крови гемоглобин 117 г/л, эритроциты 3,9 × 5106/мм3, гематокрит 34; ретикулоциты 1,2%, тромбоциты 562 × 103 мм3, лейкоцитоз 20 × 109/л, с нейтрофильным палочкоядерным сдвигом до 12%, скорость оседания эритроцитов (СОЭ) 33 мм/ч; в биохимическом анализе крови: сывороточное железо – 12,1 мкм/л, СРБ – 108 мг/л, фибриноген 5,91 г/л. ФКП – 540 мг/г (нормальные величины ≤ 50 мг/г). ИАБК составил 387,4.
При УЗИ органов брюшной полости признаков патологии печени, желчевыводящих путей, поджелудочной железы, селезенки, почек не выявлено.
По данным эзофагогастродуоденоскопии (ЭГДС) выявлено: рубцово-язвенная деформация луковицы ДПК, хронический гастродуоденит, недостаточность кардии, биопсия № 346-74/52: слизистая оболочка ДПК с признаками дуоденита.
Колоноскопия от 25.03.2012 показала: слизистая оболочка терминального отдела подвздошной кишки бледно-розовая с уплощенными складками. Баугиниева заслонка щелевидной формы. Слизистая оболочка слепой и восходящего отдела толстой кишки гиперемирована. Сосудистый рисунок прослеживается на отдельных участках. На стенках множественные геморрагии, плоские язвы до 0,4 см. Выраженная контактная кровоточивость. В поперечно-ободочном отделе на стенках на фоне линейных язв до 0,8 × 0,2 см с наложениями гноя определяются псевдополипы до 0,4 см. Выраженная контактная кровоточивость. Слизистая оболочка отечна, гиперемирована. Гаустры не контурируются, сосудистый рисунок смазан, определяется на отдельных участках. Слизистая оболочка нисходящей и сигмовидной кишки с множественными линейными язвами на фоне гиперемированной отечной слизистой. Наложения фибрина и гноя, выраженная контактная кровоточивость. Слизистая оболочка прямой кишки розовая, сосудистый рисунок четкий. Заключение: выраженный эрозивно-язвенный колит (рис. 1).
Биопсия: собственная пластинка обильно инфильтрирована лимфоцитами, плазмоцитами, большое количество эозинофилов; очаговая воспалительная инфильтрация собственной пластинки, клетки воспалительного инфильтрата проникают за пределы собственной мышечной пластинки в подслизистый слой (рис. 2).
На основании анализа анамнестических, клинико-лабораторных и инструментальных данных больной установлен диагноз: болезнь Крона толстой кишки высокой степени активности, хроническое непрерывное течение с внекишечными проявлениями (полиартралгии), средней степени тяжести, гормонозависимость. Сопутствующие заболевания: хронический гастродуоденит, язвенная болезнь ДПК в фазе ремиссии.
Больной начата терапия преднизолоном 120 мг/сут внутривенно, коррекция водно-электролитных нарушений, антибактериальная терапия, продолжено лечение азатиоприном 100 мг/сут (2 мг/кг).
С учетом непрерывного характера течения заболевания, стероидной зависимости, неэффективности иммуносупрессивной терапии азатиоприном была назначена биологическая терапия (с марта 2012 г.) – ИНФ в стандартной дозе. Через 4 недели лечения ИНФ отмечено уменьшение частоты стула до 2 раз в сутки, постепенное исчезновение болевого синдрома, слабости и недомогания, нормализация температуры тела. В общеклиническом и биохимическом анализах крови отмечалась положительная динамика: гемоглобин 117 г/л, эритроциты 4,0 × 106/мм3, гематокрит 41,1,
ретикулоциты 0,8%, тромбоциты 209 × 103 мм3, лейкоциты 9,8 × 109/л, СОЭ 4 мм/ч, сывороточное железо 20,6 мкм/л, СРБ 8 мг/л, фибриноген 1,95 г/л. ФКП 120 мг/г (нормальные величины ≤ 50 мг/г).
Через 12 недель (май 2012 г.) проведена контрольная колоноскопия (рис. 3). Слизистая оболочка слепой и восходящего отдела толстой кишки бледно-розовая. Сосудистый рисунок прослеживается на отдельных участках. На стенках единичные геморрагии и эрозии. В поперечно-ободочном отделе на стенках определяются псевдополипы до 0,4 см. Слизистая умеренно отечна, гиперемирована, сосудистый рисунок смазан, определяется на отдельных участках. Слизистая оболочка нисходящей и сигмовидной кишки с единичными эрозиями на фоне гиперемированной отечной слизистой. Слизистая оболочка прямой кишки розовая, сосудистый рисунок четкий. Заключение: эрозивный колит.
Таким образом, эндоскопической ремиссии БК достигнуто не было. Отсутствие эндоскопической ремиссии коррелировало с повышенным уровнем ФКП и СРБ.
Через 30 недель после начала терапии (после 6-й инфузии ИНФ – декабрь 2012 г.) наблюдалась потеря ответа на терапию – нарастание частоты диареи до 8 раз в сутки с примесью слизи, появление болей в суставах, лихорадки до 38 °С. В общеклиническом и биохимическом анализах крови гемоглобин 92 г/л, эритроциты 3,24 × 106/мм3, гематокрит 34,1, ретикулоциты 0,8%, тромбоциты 509 × 103 мм3, лейкоциты 11,8 × 109/л, палочкоядерные нейтрофилы 12%, СОЭ 25 мм/ч, сывороточное железо 9,6 мкм/л, СРБ 18 мг/л, фибриноген 1,95 г/л. ФКП > 600 мг/г (нормальные величины ≤ 50 мг/г). Колоноскопия от 12.2012 показала: подвздошная кишка – слизистая отечная, гиперемирована, ранима при контакте; слепая кишка – множественные язвы размером 0,3–0,6 см,
нисходящий и сигмовидный отдел – псевдополипы, афты, эрозии на стенках.
Нами было проведено исключение оппортунистических инфекций: ДНК вируса Эпштейна – Барр, цитомегаловируса в крови не определялась. Токсин Clostridium difficile не выявлен. ИАБК составил
332,5 балла. У больной также были определены концентрация ИНФ в сыворотке крови и уровень антител к нему, что составило 1,05 мкг/мл (нормальные величины > 5 мкг/мл) и 240 нг/мл (нормальные величины до 50 нг/мл) соответственно. Больной начата терапия преднизолоном 120 мг/сут внутривенно, антибактериальная терапия, коррекция водно-электролитных нарушений, назначен азатиоприн 100 мг/сут (2 мг/кг). С учетом сниженной концентрации ИНФ и повышенного уровня антител к нему на основании эмпирического алгоритма, предложенного для оптимизации лечения биологическими препаратами при потере клинического ответа при БК [30], было принято решение о переводе на другой биологический препарат – АДА. Терапия начата 02.2013 по схеме: 160 мг в 1-й день (по две инъекции по 40 мг в день последовательно в течение двух дней), 80 мг через 2 недели (на 15-й день), еще через 2 недели (29-й день) режим поддерживающего лечения – 40 мг один раз в 2 недели. В течение 14 недель больной отменен преднизолон.
Через 16 недель от начала лечения проведено комплексное контрольное обследование. Частота стула – не более 2 раз в сутки, консистенция стула нормализовалась, отмечено купирование болевого синдрома, нормализация температуры тела. В общеклиническом и биохимическом анализах крови гемоглобин 131 г/л, эритроциты 4,5 × 106/мм3, гематокрит 44,7, ретикулоциты 0,5%, тромбоциты 256 × 103 мм3, лейкоциты 7,8 × 109/л, СОЭ 8 мм/ч, сывороточное железо 20,5 мкм/л, СРБ 4,3 мг/л. ФКП 54 мг/г (нормальные величины ≤ 50 мг/г). ИАБК составил 105 баллов.
Колоноскопия от 06.2013 показала: слизистая оболочка толстой кишки и в терминальном отделе подвздошной кишки на всем протяжении розовая, гладкая, блестящая. Сосудистый рисунок местами несколько усилен, перестроен. Отсутствие изъязвлений. Слизистая оболочка ободочной кишки с единичными афтами (рис. 4). Биопсия: крипты обычной глубины, эпителиальная выстилка крипт содержит большое количество бокаловидных клеток, собственная пластинка слабо инфильтрирована лимфоцитами и плазмоцитами (рис. 5).
В настоящее время больная продолжает наблюдаться в ЦНИИГ МКНЦ ДЗМ и получать противорецидивную терапию адалимумабом 40 мг каждые 2 недели и азатиоприном 100 мг/сут.
Заключение
Данный клинический случай демонстрирует необходимость постоянного строгого индивидуального контроля активности БК, целью контроля является достижение ремиссии, предотвращение рецидивов и прогрессирования заболевания. Терапевтическое решение должно базироваться не только на клинических симптомах и особенностях течения БК, но и на оценке инструментальных и лабораторных показателей, в особенности биологических маркеров активности воспалительного процесса. Критерием эффективности проводимой терапии должна быть конечная точка, включающая как клиническую, так и биологическую ремиссию (устранение воспалительного процесса в кишечнике).
Таким образом, в идеале критерием ремиссии БК должно быть полное прекращение воспалительного процесса. Методами контроля могут служить неинвазивные биомаркеры – ФКП и СРБ. Их применение позволило продемонстрировать возможности оценки степени заживления слизистой оболочки кишки, сопоставимые с эндоскопическим методом. Тем не менее требуется дальнейший поиск биомаркеров с более высокой специфичностью и чувствительностью.
У больных, теряющих ответ на биологическую терапию, требуется ее оптимизация в виде увеличения дозы биологического препарата, уменьшения интервала между введениями препарата или смена биологического препарата. Существующий эмпирический алгоритм оптимизации биологической терапии, учитывающий концентрацию в крови ингибитора ФНО-альфа и уровень антител к нему, позволил нам обоснованно перейти на терапию АДА. Изменение тактики лечения с применением АДА помогло нам приблизиться к достижению биологической ремиссии, подтвержденной нормальным уровнем биомаркеров – ФКП и СРБ.
1. Crohn B.B., Ginzburg L., Oppenheimer G.D. Regional ileitis; a pathologic and clinical entity // JAMA. 1932. Vol. 99. P. 1323–1329.
2. Gately M.K., Renzetti L.M., Magram J. et al. The interleukin-12/interleukin-12-receptor system: role in normal and pathologic immune responses // Annu. Rev. Immunol. 1998. Vol. 16. P. 495–521.
3. Ina K., Itoh J., Fukushima K. et al. Resistance of Crohn’s disease T cells to multiple apoptotic signals is associated with a Bcl-2/Bax mucosal imbalance // J. Immunol. 1999. Vol. 163. № 2. P. 1081–1090.
4. Podolsky D.K. Inflammatory bowel disease // N. Engl. J. Med. 2002. Vol. 347. № 6. P. 417–429.
5. Holtmann M.H., Schütz M., Galle P.R., Neurath M.F. Functional relevance of soluble TNF-alpha, transmembrane TNF-alpha and TNF-signal transduction in gastrointestinal diseases with special reference to inflammatory bowel diseases // Z. Gastroenterol. 2002. Vol. 40. № 8. P. 587–600.
6. Henriksen M., Jahnsen J., Lygren I. et al. Clinical course in Crohn’s disease: results of a five-year population-based follow-up study (the IBSEN study) // Scand. J. Gastroenterol. 2007. Vol. 42. № 5. P. 602–610.
7. Парфенов А.И. Болезнь Крона: к 80-летию описания // Терапевтический архив. 2013. Т. 85. № 8. С. 35–42.
8. Dignass A., Van Assche G., Lindsay J.O. et al. The second European evidence-based Consensus on the diagnosis and management of Crohn’s disease: Current management // J. Crohn’s Colitis. 2010. Vol. 4. № 1. P. 28–62.
9. Steinhart A.H., Ewe K., Griffiths A.M. et al. Corticosteroids for maintenance of remission in Crohn’s disease // Cochrane Database Syst. Rev. 2003. № 4. CD000301.
10. Cosnes J., Cattan S., Blain A. et al. Long-term evolution of disease behavior of Crohn’s disease // Inflamm. Bowel Dis. 2002. Vol. 8. № 4. P. 244–250.
11. Panaccione R., Colombel J.F., Louis E. et al. Evolving definitions of remission in Crohn’s disease // Inflamm. Bowel Dis. 2013. Vol. 19. № 8. P. 1645–1653.
12. Schoels M., Knevel R., Aletaha D. et al. Evidence for treating rheumatoid arthritis to target: results of a systematic literature search // Ann. Rheum. Dis. 2010. Vol. 69. № 4. P. 638–643.
13. Инструкция по применению препарата Ремикейд®.
14. Инструкция по применению препарата Хумира®.
15. Инструкция по применению препарата Симзия®.
16. Pallotta N., Tomei E., Viscido A. et al. Small intestine contrast ultrasonography: an alternative to radiology in the assessment of small bowel disease // Inflamm. Bowel Dis. 2005. Vol. 11. № 2. P. 146–153.
17. Louis E., Mary J.Y., Vernier-Massouille G. et al. Maintenance of remission among patients with Crohn’s disease on antimetabolite therapy after infliximab therapy is stopped // Gastroenterology. 2012. Vol. 142. № 1. P. 63–70.
18. De Cruz P., Kamm M.A., Prideaux L. et al. Mucosal healing in Crohn’s disease: a systematic review // Inflamm. Bowel Dis. 2013. Vol. 19. № 2. P. 429–444.
19. Hébuterne X., Lémann M., Bouhnik Y. et al. Endoscopic improvement of mucosal lesions in patients with moderate to severe ileocolonic Crohn’s disease following treatment with certolizumab pegol // Gut. 2013. Vol. 62. № 2. P. 201–208.
20. Pineton de Chambrun G., Peyrin-Biroulet L., Lémann M., Colombel J.F. Clinical implications of mucosal healing for the management of IBD // Nat. Rev. Gastroenterol. Hepatol. 2010. Vol. 7. № 1. P. 15–29.
21. Sandborn W.J., Rutgeerts P.J., Reinisch W. et al. One year data from the Sonic study: a randomized, double-blind trial comparing infliximab and infliximab plus azathioprine to azathioprine in patients with Crohn’s disease naive to immunomodulators and biologic therapy // Gastroenterology. 2009. Vol. 136. № 5. Suppl. 1. P. 751f.
22. D’haens G., Van Deventer S., Van Hogezand R. et al. Endoscopic and histological healing with infliximab anti-tumor necrosis factor antibodies in Crohn’s disease: a European multicenter trial // Gastroenterology. 1999. Vol. 116. № 5. P. 1029–1034.
23. Rutgeerts P., Feagan B.G., Lichtenstein G.R. et al. Comparison of scheduled and episodic treatment strategies of infliximab in Crohn’s disease // Gastroenterology. 2004. Vol. 126. № 2. P. 402–413.
24. Louis E.E.A. Infliximab discontinuation in Crohn’s disease patients in stable remission on combined therapy with immunosuppressors: interim analysis of a prospective cohort study // Gut. 2008. Vol. 57. Suppl. 2. P. A66.
25. Rutgeerts P., Van Assche G., Sandborn W.J. et al. Adalimumab induces and maintains mucosal healing in patients with Crohn’s disease: data from the EXTEND trial // Gastroenterology. 2012. Vol. 142. № 5. P. 1102–1111.
26. Colombel J., Rutgeerts P., Sandborn W.J. et al. Deep remission for adalimumab-treated patients with moderate to severe ileocolonic Crohn’s disease: results from EXTEND // J. Crohn’s Colitis. 2010. Vol. 4. P. S11. Abstract OP31.
27. Colombel J., Rutgeerts P., Sandborn W.J. et al. Deep remission predicts long-term outcomes for adalimumab-treated patients with Crohn’s disease: data from EXTEND // Gut. 2010. Vol. 59. Suppl. 3. P. A80. Abstract OP371.
28. Colombel J., Sandborn W.J., Louis E. et al. Economic impact of deep remission in adalimumab-treated patients with Crohn’s disease: results from EXTEND // 6th Congress of the European Crohn’s and Colitis Organisation; February 24–26, 2011; Dublin, Ireland. Poster P070 // https://www.ecco-ibd.eu/publications/congress-abstract-s/abstracts-2011/item/90.html
29. Da W., Zhu J., Wang L., Lu Y. Adalimumab for Crohn’s disease after infliximab treatment failure: a systematic review // Eur. J. Gastroenterol. Hepatol. 2013. Vol. 25. № 8. P. 885–891.
30. Colombel J.F., Feagan B.G., Sandborn W.J. et al. Therapeutic drug monitoring of biologics for inflammatory bowel disease // Inflamm. Bowel Dis. 2012. Vol. 18. № 2. P. 349–358.
New approaches to estimation of treatment efficacy and attainment of biological remission in Crohn’s disease
O.V. Knyazev, A.I. Parfenov, N.A. Fadeyeva, P.L. Shcherbakov, S.G. Khomeriki
Moscow Clinical Applied Research Center of the Moscow City Health Department
Contact person: Oleg Vladimirovich Knyazev, oleg7@bk.ru
In this report, the authors present a case of a woman with Crohn’s disease to substantiate the need for continuous monitoring of the disease activity targeting at clinical, endoscopic and biological remission of the disease.
To determine biological remission, non-invasive biological markers of inflammation were used such as C-reactive protein and fecal calprotectin. Deep remission attainment has been demonstrated after tumor necrosis factor-alpha inhibitor adalimumab therapy in a patient with lost response to therapy with infliximab.
Key words: Crohn’s disease, remission, biological therapy, adalimumab, infliximab, biomarkers, C-reactive protein, fecal calprotectin
Новости на тему
28.07.2015
Отправить статью по электронной почте
Ваш адрес электронной почты:
В настоящее время пациентом с хронической обструктивной болезнью легких (ХОБЛ), склонным к частым обострениям, принято считать больного, количество эпизодов обострений у которого регистрируется 2 раза и более в течение календарного года. Больные ХОБЛ с частыми обострениями представляют особую группу пациентов с высоким риском заболеваемости и смертности и требуют повышенного внимания и более интенсивного терапевтического подхода. Новый противовоспалительный препарат рофлумиласт снижает частоту обострений у больных с бронхитическим типом ХОБЛ и частыми обострениями. Результаты исследований подтверждают способность рофлумиласта коренным образом изменять фенотип пациентов. Течение заболевания у больных ХОБЛ с частыми обострениями приобретает более стабильный характер. Под влиянием терапии происходит модификация индивидуальных фенотипов пациентов, и они становятся менее склонными к частым эпизодам обострений.
" id="sender_art_description" name = "SENDER_ART_DESCRIPTION" />
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
