Новый метод оценки прочности костной ткани: радиочастотная эхографическая мультиспектрометрия
- Аннотация
- Статья
- Ссылки
- English
В ближайшее время будут опубликованы данные об оценке хрупкости костной ткани с помощью нового параметра REMS, который не зависит от минеральной плотности костной ткани.
В ближайшее время будут опубликованы данные об оценке хрупкости костной ткани с помощью нового параметра REMS, который не зависит от минеральной плотности костной ткани.
Введение
Остеопороз – системное метаболическое заболевание скелета, характеризующееся снижением прочности кости и приводящее к переломам, которые возникают при незначительной травме. Низкоэнергетические переломы костей (тел позвонков, проксимального отдела бедренной кости, дистального отдела предплечья, проксимального отдела плечевой кости и др.) – единственные клинические проявления заболевания. Именно они обусловливают медицинскую, социальную и экономическую значимость остеопороза для современного общества.
Прочность костной ткани определяется двумя интегративными показателями: плотностью (или массой) и микроархитектоникой [1]. Следовательно, для выявления ее хрупкости идеально исследовать обе характеристики. Однако подавляющее большинство инструментальных методов исследования костной ткани направлено на оценку плотности костной ткани, являющейся ведущей детерминантой риска перелома. Золотым стандартом среди них считается двухэнергетическая рентгеновская абсорбциометрия (Dual-energy X-ray Absorptiometry – DXA).
Двухэнергетическая рентгеновская абсорбциометрия
DXA – метод денситометрии, в основе которого лежит абсорбция ионами кальция фотонов рентгеновских лучей, что позволяет подсчитать содержание в кости кальция с последующим определением проекционной минеральной плотности кости (МПК) (содержания кальция на единицу площади кости, г/см2). Использование двух уровней энергии помогает точно измерить МПК независимо от толщины мягких тканей [2]. Согласно рекомендациям экспертов Всемирной организации здравоохранения, диагноз «остеопороз» устанавливается по Т-критерию, который выражается в стандартных отклонениях (SD) МПК от нормы. За нормальные значения принято референсное значение в контрольной популяции молодых здоровых пременопаузальных женщин в возрасте от 20 до 40 лет. Остеопороз диагностируется при Т-критерии -2,5 SD и более. При Т-критерии от -1,0 до -2,5 SD устанавливают диагноз «остеопения». Показатель свыше -1,0 SD считается нормой [3, 4].
От величины Т-критерия зависит риск перелома. Так, его снижение на одно стандартное отклонение в шейке бедра увеличивает риск перелома этой локализации в 2,6 раза, переломов других локализаций в 1,6 раза [5]. Именно поэтому инструментальный диагноз остеопороза базируется на величине Т-критерия.
Предпочтительные локализации проведения DXA-денситометрии – проксимальный отдел бедренной кости и поясничный отдел позвоночника (аксиальная, или центральная, денситометрия). Денситометрия наилучшим образом определяет риск переломов той локализации, где проведено исследование, а переломы тел позвонков и проксимального отдела бедренной кости являются наиболее тяжелыми проявлениями остеопороза.
Как было отмечено ранее, в настоящее время DXA считается золотым стандартом диагностики остеопороза и прогнозирования риска низкоэнергетических переломов. Высокая точность и воспроизводимость результатов DXA позволяют также использовать ее для оценки динамики МПК в процессе лечения. Данный метод диагностики включен в международные [6] и отечественные [7] клинические рекомендации по остеопорозу.
Широкому применению DXA в клинической практике препятствует ряд факторов. Согласно рекомендациям международных организаций, на 1 млн населения должно приходиться 11 аппаратов [8]. В Российской Федерации на 2010 г. обеспеченность составляла 0,6 аппарата на 1 млн населения [9]. Это обусловлено не только высокой стоимостью аппарата, но и необходимостью оборудования помещения, в котором он будет находиться. Следует также учитывать важность правильного положения тела пациента во время проведения исследования, высокой квалификации оператора, проводящего денситометрию и анализирующего ее результаты. Определенный субъективизм становится источником ошибок.
Известно, что переломы могут происходить не только у лиц с низкой МПК, но и у пациентов с остеопенией или нормальной МПК, поскольку помимо плотности кости большое значение отводится ее эластическим свойствам, микроструктурным параметрам, которые невозможно установить с помощью современных денситометров. Поэтому DXA обладает высокой специфичностью, но низкой чувствительностью в отношении выявления лиц с высоким риском переломов [10, 11].
Сказанное выше определяет актуальность поиска новых технологий, которые имели бы сходные или лучшие характеристики при выявлении высокого риска переломов, но не обладали недостатками DXA.
Количественное ультразвуковое исследование костной ткани
В качестве одной из альтернатив рентгеновской денситометрии предлагалось использовать количественное ультразвуковое исследование костной ткани (КУЗИ). В отличие от DXA при этом методе диагностики не используется ионизирующая радиация. Оборудование значительно дешевле и более портативно, не требует специально оборудованной комнаты и привлечения высококвалифицированных специалистов. Однако для данного исследования доступны только периферические участки скелета, поэтому зачастую результаты КУЗИ и центральной DXA не совпадают. Единственным участком скелета, в отношении которого доказана способность КУЗИ прогнозировать риск переломов, является пяточная кость. С помощью КУЗИ пяточной кости можно выявить риск низкоэнергетических переломов у пациентов старше 65 лет, в комбинации с клиническими факторами риска развития остеопороза – идентифицировать лиц с очень низким риском переломов, у которых для исключения остеопороза проведения дальнейших обследований не требуется [12]. Таким образом, КУЗИ предназначено преимущественно для скрининга или инициации терапии остеопороза, когда доступность DXA ограничена.
Количественное ультразвуковое исследование костной ткани не может использоваться для мониторирования эффективности лечения из-за отсутствия соответствующих крупных рандомизированных исследований и неоднозначности уже опубликованных данных [13].
Хотя, как указывалось выше, результаты КУЗИ периферического скелета обычно не совпадают с данными центральной DXA, в случае ультразвукового исследования того участка скелета, где проводится DXA-денситометрия, отмечается некоторая корреляция их измерений [14]. Этот факт послужил основой для разработки группой итальянских ученых новой технологии, которая получила название «радиочастотная эхографическая мультиспектрометрия» (Radio frequency Echographic Multi-Spectrometry – REMS).
Радиочастотная эхографическая мультиспектрометрия
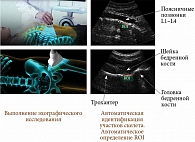
Технология REMS основана на анализе нативных необработанных неотфильтрованных ультразвуковых сигналов, или радиочастотных ультразвуковых сигналов, производимых при эхографическом сканировании поясничных позвонков и/или проксимального отдела бедренной кости, что позволяет получить максимальное количество информации об исследуемых тканях (рис. 1). В отличие от других предлагавшихся методов ультразвукового исследования костной ткани REMS определяет не один или несколько параметров, а сравнивает спектр анализируемых сигналов с референсными спектральными моделями определенных патологических состояний (остеопороз, остеопения) и нормы [15, 16].
При проведении REMS датчик размещается на область живота в проекции поясничных позвонков и/или на область проксимального отдела бедренной кости, чтобы визуализировать исследуемые участки скелета. Оператор устанавливает параметры глубины сканирования и фокуса, после чего программа автоматически определяет кость и идентифицирует область интереса (Region of Interest – ROI). Параллельно обрабатываются нативные необработанные неотфильтрованные сигналы от нескольких линий сканирования, от каждой линии – один спектр. Далее проводится комбинированный анализ изображений в В-режиме (идентификация таргетной кости и связанных с этим ROI) и радиочастотных данных. Таким образом, технология REMS анализирует полный спектр радиочастотных сигналов, полученных при эхографическом сканировании поясничных позвонков и шейки бедренной кости, что позволяет определить архитектонику кости.
Анализ спектра каждой линии сканирования автоматически позволяет исключать любые артефакты (кальцификаты или остеофиты), поскольку также идентифицируются спектральные характеристики, не имеющие непосредственного отношения к костной ткани.
Полученные данные объединяются в спектр сигналов исследуемой кости, специфичный для каждого обследованного. В дальнейшем этот спектр сигналов сравнивается с референсными спектральными моделями соответствующего пола, возраста, индекса массы тела и локализации исследования, построенными на основании большой базы данных.
Наиважнейшими показателями состояния костной ткани, имеющими отношение к диагностике остеопороза и прогнозированию риска переломов, являются низкая МПК и высокий риск переломов. Соответственно для анализа результатов REMS разработаны два новых диагностических параметра – Osteoporosis Score (OS) и Fragility Score (FS). OS позволяет оценить степень схожести спектра, полученного у исследуемого, со спектральными моделями пациентов с низкой (Т-критерий ≤ -2,5 SD) и нормальной (Т-критерий ≥ -1,0 SD) МПК, FS – количественно аналогичную схожесть спектра с моделями, полученными у пациентов с недавно перенесенным низкоэнергетическим переломом или без переломов в анамнезе [17].
По сути, OS определяет процент проанализированных участков кости, в результате сканирования и сложного спектрального анализа классифицированных как остеопорозные. Таким образом, анализ радиочастотных сигналов, полученных при эхографическом сканировании таргетной кости, и детальное сравнение с референсными спектральными моделями позволяют определить соответствие внутренней архитектоники кости модели остеопорозной, остеопенической или здоровой кости.
В дальнейшем с помощью уравнений линейной регрессии OS трансформируется в значения МПКREMS для каждого позвонка/шейки бедренной кости. Путем количественных сравнений с референсными кривыми базы данных NHANES МПКREMS, так же как МПКDXA, выражается в виде Т- и Z-критериев. Выходным параметром является МПКREMS, диагностический индекс, продемонстрировавший значимую корреляцию с соответствующими величинами МПК, получаемыми при DXA-денситометрии [15, 16].
FS – индекс хрупкости кости. Это независимый индикатор качества кости, который позволяет оценить риск перелома независимо от МПК. FS выражается в числовом диапазоне от нуля до ста. Значение получают путем сравнения спектра сигналов конкретного пациента с референсными спектральными моделями, полученными у лиц с низкоэнергетическими переломами или без таковых. Недавно опубликованные исследования доказали высокую точность FS при разграничении пациентов с и без переломов. FS также статистически значимо коррелировал с десятилетней вероятностью остеопоротического перелома по FRAX (Fracture Risk Assessment Tool), подсчитанной с учетом МПК бедра [18–20].
Техника проведения
Как было отмечено ранее, для исследования позвоночника эхографический датчик устанавливается в трансабдоминальной позиции под грудиной для визуализации позвонка L1. Далее под контролем изображения на экране его передвигают вниз до позвонка L4. Необходимо сканировать как минимум два позвонка. Сканирование каждого позвонка продолжается около 20 секунд с последующей автоматической обработкой данных в течение одной-двух минут. При исследовании проксимального отдела бедренной кости УЗИ-датчик устанавливается параллельно оси «головка – шейка бедра» для визуализации этой области. Длительность сканирования – около 40 секунд с последующим автоматическим анализом данных в течение одной минуты. Для получения адекватной информации каждому пациенту устанавливаются специфические параметры фокуса датчика и глубины сканирования. Необходимо отметить, что REMS автоматически определяет, соответствует ли полученный спектр сигналов спектральной модели трабекулярной кости. Если нет, результаты не будут визуализированы, оператор должен будет повторить процедуру [21].
Клинические исследования
Возможность применения REMS в диагностике остеопороза оценена в ряде клинических исследований.
В одноцентровом исследовании у 342 женщин в возрасте 51–60 лет одновременно проведены DXA-денситометрия и абдоминальное эхографическое REMS-сканирование поясничного отдела позвоночника. Для анализа данных пациенток разделили на две группы: одна использовалась для построения ультразвуковой спектральной модели, вторая – для оценки воспроизводимости и диагностической точности построенной модели. В данном исследовании впервые применен разработанный авторами полностью автоматизированный алгоритм, выполняющий серию спектральных и статистических анализов. В результате был разработан новый диагностический параметр OS. OS, так же как DXA, классифицировал пациентов по категориям «остеопороз», «остеопения» и «норма» в 91,1% случаев (κ = 0,859, p < 0,0001), а МПКREMS, рассчитанная на основании OS, значимо коррелировала с МПКDXA (r = 0,84, p < 0,001) [15].
В другом одноцентровом исследовании с участием 377 женщин более старшего возраста (от 61 до 70 лет) диагностическая конкордантность REMS и DXA при исследовании бедренной кости составила 94,7% [16]. Были также показаны различия в величине МПКREMS у женщин в постменопаузе и пременопаузе [22].
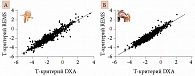
Анализ был продолжен в многоцентровом исследовании с участием 1914 женщин в постменопаузе в возрасте от 51 до 70 лет (2018 г.) [21]. Это было одномоментное наблюдательное исследование, в котором всем участницам одновременно с DXA-денситометрией позвоночника и проксимального отдела бедренной кости было проведено эхографическое сканирование этих же участков скелета с помощью REMS. Исследователи сравнивали краткосрочную воспроизводимость (у разных операторов и одного оператора) и диагностическую точность REMS и DXA. В целом при исключении пациенток с ошибочными заключениями REMS (280 в отношении позвоночника и 205 в отношении бедренной кости) и DXA (78 в отношении позвоночника и 59 в отношении бедренной кости) REMS хорошо дифференцировала пациенток с остеопорозом. Так, в позвоночнике ее чувствительность составляла 91,7%, специфичность – 92,0%, в шейке бедра – 91,5 и 91,8% соответственно. Эти результаты подтверждены хорошей согласованностью данных REMS с результатами DXA: для позвоночника коэффициент корреляции составил 0,94 (р < 0,001), для бедра – 0,93 (р < 0,001). Линейная регрессия также свидетельствовала о хорошей корреляции данных обоих методов. Так, для позвоночника коэффициент корреляции составлял 0,95, для бедра – 0,97 (рис. 2). Воспроизводимость результатов REMS, оцениваемая с помощью среднеквадратичного коэффициента вариации, была достаточно высокой и составила 0,38% для позвоночника (95%-ный доверительный интервал (ДИ) 0,28–0,48), 0,32% для шейки бедра (95% ДИ 0,24–0,40). Эти показатели для DXA в другом исследовании, проведенном в отношении пациенток с похожими характеристиками, варьировались от 1,07 до 1,47% [23, 24].
При распределении пациенток на три группы: остеопороз, остеопения и норма – диагностическая конкордантность DXA и REMS составила 88,8% (κ = 0,824, p < 0,001) для позвоночника и 88,2% (κ = 0,794, p < 0,001) для шейки бедра. Большое количество случаев неправильной классификации результатов было связано со значениями МПК, близкими друг к другу и к пороговому значению. Например, у пациентки Т-критерий по результатам DXA-денситометрии составлял -2,5 SD, REMS – -2,4 SD. Соответственно по DXA у нее определили остеопороз, по REMS – остеопению, хотя показатели были очень близки. Если допустить толерантность T-критерия по REMS 0,3 SD, то диагностическая конкордантность двух методов будет выше и составит 97,4% для позвоночника и 98,0% для шейки бедра.
В целом доля ошибочно проведенных сканов при REMS была довольно большой – 18,0% для позвоночника и 12,5% для бедра. Большинство ошибок было допущено в первые три-четыре месяца от начала исследования, по мере наработки опыта его проведения их число уменьшалось. Ошибки преимущественно были связаны с неправильно выбранными глубиной и фокусом сканирования. Отдельный анализ был проведен в группе пациенток, из которой не удалялись ошибочные сканы REMS и DXA. В этом случае чувствительность REMS снижалась до 81,0% в отношении позвоночника и до 81,7% в отношении шейки бедра при специфичности 84,3 и 89,7% соответственно. Совпадение результатов составило 76,4% (κ = 0,629, p < 0,001) для позвоночника и 81,9% (κ = 0,691, p < 0,001) для шейки бедра.
Результаты этого многоцентрового исследования свидетельствуют о высокой чувствительности и специфичности REMS в идентификации пациентов с остеопорозом и хорошей согласованности ее данных с данными DXA. Авторы сделали вывод о достаточно высокой точности и воспроизводимости результатов REMS, поэтому рекомендовали данный метод для диагностики остеопороза. Однако было подчеркнуто, что для предупреждения ошибочных заключений важно обеспечить тщательное обучение оператора. Исследователи также отметили, что в будущем могут быть созданы дополнительные программы, обеспечивающие автоматическое определение правильного фокуса датчика и глубины скана у конкретного пациента.
Помимо довольно большой доли случаев неправильно проведенного сканирования существенными ограничениями данного исследования являются дизайн (одномоментное исследование) и проведение в рамках одной страны.
Для более точных выводов необходимы проспективные исследования с оценкой способности REMS прогнозировать риск переломов и оценивать динамику состояния костной ткани на фоне лечения.
В настоящее время в пяти европейских центрах проводится многоцентровое исследование Echo-Bone [25], в котором сравниваются REMS и DXA. Нужны также исследования в отношении мужчин и лиц других рас помимо европеоидной. Технология перспективна у детей и беременных. В будущем с ее помощью может быть возможна оценка мышечной ткани и хряща.
Метод получил официальную поддержку со стороны ряда международных организаций. Так, в октябре 2018 г. REMS разрешена к применению Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) США. Аппарат рекомендован к применению для диагностики остеопороза с использованием диагностических параметров: МПКREMS, Т- и Z-критерий, а также для определения риска переломов при подсчете десятилетнего риска по FRAX. Отмечено, что МПКREMS, определенная на основании ультразвуковых параметров поясничного отдела позвоночника и шейки бедра, имеет высокую корреляцию с МПКDXA, оцененной в тех же участках скелета. Поскольку точность REMS соответствует точности DXA, первая может использоваться для мониторирования изменений костной ткани у женщин [26].
В 2019 г. опубликована резолюция согласительного совещания экспертов, организованного Европейским обществом по клиническим и экономическим аспектам остеопороза, остеоартрита и заболеваний опорно-двигательного аппарата (ESCEO) [25], в которой подчеркивается, что REMS – это первый клинически доказанный метод прямого измерения МПК в поясничном отделе позвоночника и шейке бедренной кости без использования ионизирующей радиации. Предполагают, что с учетом безопасности и портативности в ближайшее время он найдет широкое применение в клинической практике, особенно в первичном звене здравоохранения или при невозможности транспортировать пациента в кабинет денситометрии.
Заключение
В клинической практике появился новый неинвазивный метод оценки костной ткани, не имеющий недостатков рентгеновской денситометрии и объединивший важные интегральные показатели риска перелома – плотность костной ткани и ее качество, – REMS. В настоящее время REMS доказала эффективность при диагностике остеопороза. Ее результаты совпадают с данными, полученными при проведении DXA в тех же участках скелета (поясничный отдел позвоночника и шейка бедра). В ближайшее время ожидаются публикации по оценке хрупкости костной ткани с помощью другого параметра REMS, независимого от МПК, – индекса хрупкости кости FS.
Автор благодарит за предоставленные рисунки компанию Echolight SpA и M. Di Paola.
O.M. Lesnyak, MD, PhD, Prof.
North-Western State Medical University named after I.I. Mechnikov
Contact person: Olga M. Lesnyak, olga.m.lesnyak@yandex.ru
The review provides data on the possibilities of using a new ultrasound method for bone strength determination – Radio frequency Echographic Multi-Spectrometry (REMS) for examination of the lumbar spine and proximal femur. REMS results are highly correlated with the results of axial Dual-energy X-ray Absorptiometry.
At the same time, the first method is safer, as ionizing radiation is not used. In addition, REMS can be used to determine not only the density, but also the quality of bone tissue.
In the near future, data will be published on the assessment of bone fragility using the new REMS parameter, independent of the bone mineral density.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.