Новый способ концентрирования клеточного материала экссудатов
- Аннотация
- Статья
- Ссылки
- English
Материал и методы. Методом седиментации с использованием капельной воронки при исследовании 28 образцов экссудатов (плевральных и абдоминальных), полученных от 24 больных раком яичников, определено оптимальное время накопления клеточных образцов в выпотных жидкостях. Проведено сравнение двух способов концентрирования клеточного материала экссудата – с использованием капельной воронки и с использованием цилиндра.
Результаты. При использовании капельной воронки для концентрирования клеточного материала экссудатов оптимальной признана экспозиция времени отстаивания 60 минут.
Заключение. Применение капельной воронки для концентрирования клеточного материала экссудатов оптимально. В исследуемых препаратах содержится достаточное количество клеточного материала для цитологического исследования, клеточные комплексы крупнее, чем при использовании цилиндра.
Материал и методы. Методом седиментации с использованием капельной воронки при исследовании 28 образцов экссудатов (плевральных и абдоминальных), полученных от 24 больных раком яичников, определено оптимальное время накопления клеточных образцов в выпотных жидкостях. Проведено сравнение двух способов концентрирования клеточного материала экссудата – с использованием капельной воронки и с использованием цилиндра.
Результаты. При использовании капельной воронки для концентрирования клеточного материала экссудатов оптимальной признана экспозиция времени отстаивания 60 минут.
Заключение. Применение капельной воронки для концентрирования клеточного материала экссудатов оптимально. В исследуемых препаратах содержится достаточное количество клеточного материала для цитологического исследования, клеточные комплексы крупнее, чем при использовании цилиндра.



Введение
Основным методом диагностики злокачественных новообразований при наличии выпотов в серозных полостях является цитологическое исследование экссудатов. Однако диагностическая точность существующего традиционного цитологического исследования выпотных жидкостей не превышает 40–60%. Этого недостаточно для установления точного морфологического диагноза [1, 2].
Одной из причин низкой точности классического цитологического метода исследования выпотных жидкостей является низкое содержание в экссудатах опухолевых и мезотелиальных клеток [3].
Известен метод седиментации, который заключается в осаждении дисперсной фазы из дисперсионной среды под действием силы тяжести для концентрирования дисперсионной фазы [4]. Этот способ применяется в том числе для разделения дисперсионной системы. Несмотря на то что экссудат является дисперсионной системой, при проведении цитологических исследований для концентрирования клеточного материала в выпотных жидкостях способ седиментации не используется.
Цель исследования – совершенствование способа концентрирования клеточного материала экссудатов серозных полостей для цитологического исследования.
Материал и методы
В исследование были включены 24 больных раком яичников. После обследования методом лучевой диагностики (ультразвуковое сканирование, рентгеновская компьютерная томография, магнитно-резонансная томография) абдоминальный экссудат выявлен у 16 пациенток, плевральный – у четырех, плевральный и абдоминальный – у четырех.
Всем больным выполнена пункция серозных полостей. К экссудату, полученному с помощью лапароцентеза или пневмоцентеза, добавляли 5%-ный раствор цитрата натрия в соотношении 1:10 для предотвращения образования фибринового сгустка. При проведении пневмоцентеза для цитологического исследования собирали весь объем экссудата, а при выполнении лапароцентеза – три порции по 500 мл в начале, середине и конце пункции.
Три порции абдоминального экссудата, полученного после лапароцентеза, переливали в колбу и перемешивали. Затем экссудат (плевральный или абдоминальный), разделенный на пять равных частей, размещали в капельных воронках для отстаивания и концентрирования клеточного осадка в придонной части выпотной жидкости (рис. 1). Оптимальное время накопления клеточных образцов в придонном слое экссудата определяли следующим образом. Первую порцию отстаивали 15 минут, вторую – 30, третью – 45, четвертую – 60, пятую – 90 минут.
По истечении времени экспозиции отстаивания экссудата обогащенный клеточными элементами придонный слой из капельной воронки сливали в пять-шесть центрифужных пробирок. Экссудат центрифугировали на аппарате Элекон ЦЛМН-Р10-01 (скорость вращения 2000 об/мин) в течение десяти минут и оценивали клеточность в каждом исследуемом образце. Для этого каплю клеточного осадка переносили на предметное стекло и определяли количество клеток (опухолевых и клеток мезотелия без учета клеточных элементов крови) в нативном препарате при 280-кратном увеличении (объектив ×40, окуляр ×7) в трех – пяти полях зрения. Из полученного сконцентрированного клеточного осадка готовили микропрепараты для цитологического исследования.
Сравнивали два способа концентрирования клеточного материала экссудата (с использованием капельной воронки и с использованием цилиндра). Было исследовано три образца асцитической жидкости, полученной у больных с цитологически верифицированным диагнозом «рак яичников». Перед началом накопления клеточного материала определяли клеточность образцов экссудатов. Затем экссудат распределяли по двум цилиндрам и двум капельным воронкам в равном объеме, отстаивали в течение 30 и 60 минут и определяли количество клеточных образцов и клеточных комплексов.
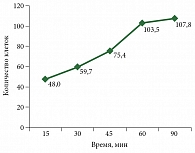
Через 15 минут отстаивания среднее количество клеток в 28 исследуемых образцах экссудатов составило 48 в поле зрения, через 30 минут – 59,7, через 45 минут – 75,4, через 60 минут – 103,5, через 90 минут – 107,8. На рисунке 2 представлена кривая осаждения клеточных образцов экссудатов в зависимости от времени их отстаивания.
Количество клеточных образцов в экссудате при 60-минутном отстаивании в 1,7 раза (на 73,3%) больше, чем при 30-минутном. Дальнейшее пролонгирование времени экспозиции существенно не влияет на увеличение клеточных образцов в изучаемых экссудатах.
В настоящее время в клинической лабораторной практике используется способ концентрирования клеточного материала экссудата путем отстаивания в цилиндре с последующим забором обогащенного клеточными образцами придонного слоя выпотной жидкости, центрифугирования и приготовления цитологических препаратов из клеточного осадка.
Мы сравнили два способа концентрирования клеточного материала в выпотных жидкостях для получения цитологических препаратов: с использованием капельной воронки и приготовления цитологических препаратов из обогащенного клеточными образцами придонного слоя экссудата путем его отстаивания в цилиндре (таблица).
Как видно из таблицы, среднее количество клеточных образцов в асцитической жидкости сразу после ее получения – 12,3 в поле зрения, клеточных комплексов – 1,7. После отстаивания выпотной жидкости через 30 минут среднее количество клеточных образцов в цилиндре составило 17,3 в поле зрения, клеточных комплексов – 2,3, в капельной воронке – 27,3 и 3,7 соответственно. Через 60 минут отстаивания экссудата эти показатели составили 60, 4,3, 79 и 7 соответственно.
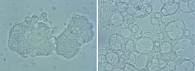
При сравнении двух способов концентрирования клеточного материала экссудата с традиционным цитологическим методом количество клеточных образцов через 30 минут отстаивания биологической жидкости в цилиндре увеличивается на 40%, в капельной воронке – на 121%, а через 60 минут – в 3,9 и 5,4 раза соответственно. Необходимо также отметить важную закономерность: при отстаивании экссудата в капельной воронке увеличивается не только количество клеточных образцов и клеточных комплексов, но и количество клеточных элементов в клеточных комплексах по сравнению с образцами, полученными из обогащенного придонного слоя выпотной жидкости в цилиндре (рис. 3 и 4).
Заключение
Использование капельной воронки для концентрирования клеточного материала экссудатов при 60-минутном отстаивании оптимально для получения качественных микропрепаратов, содержащих достаточное количество клеточного материала для цитологического исследования. В отличие от цилиндра капельная воронка позволяет получить более крупные клеточные комплексы.
M.G. Leonov, V.I. Novik, S.A. Belyaeva, Ya.H.-B. Yershova, Zh.P. Selifonova
Oncology Сentre № 3, Novorossiysk
N.N. Petrov National Medical Oncology Centre, Saint-Petersburg
Contact person: Mikhail Genrikhovich Leonov, novonko@yandex.ru
Aim – the improvement of method for concentration of cellular material of exudates of serous cavity for cytological research.
Material and methods. The optimum time of settling exposition was determined on the basis of the analysis sedimentation method with using drop funnel in research of 28 exudates (pleural and abdominal) from 24 patients. We compared two methods for concentration of cellular material of exudates: with using a drop funnel and with using cylinder.
Results. The optimum time of settling exposition is 60 min. with using a drop funnel for concentration of cellular material of exudates.
Conclusion. A drop funnel for concentration of cellular material of exudates is optimum. There are enough cellular material for cytological research in the stuff. Cell’s complexes are larger with using a drop funnel.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.