Возможности цитологического исследования экссудатов серозных полостей в диагностике онкопатологии в условиях многопрофильного стационара
- Аннотация
- Статья
- Ссылки
- English
Цель исследования – показать возможности цитологического исследования экссудатов из серозных полостей в диагностике онкопатологии.
Материал и методы. За период 2018–2021 гг. цитологическому исследованию были подвергнуты 10 082 образца выпотных жидкостей серозных полостей: плевральной – 8166 (81%), абдоминальной – 1512 (15%), перикардиальной – 404 (4%). Проводилось микроскопическое исследование традиционных препаратов, в сложных диагностических случаях выполнялось иммуноцитохимическое (ИЦХ) исследование.
Результаты. Традиционный цитологический метод анализа выпотных жидкостей показал наличие метастатических поражений серозных полостей у женщин в 672 случаях (58%), главным образом за счет прогрессирования рака молочной железы (26%). У мужчин в основном регистрировались плевриты за счет метастазирования аденокарциномы легкого – 266 случаев (23%). Применение ИЦХ-исследования повышало диагностическую точность цитологического метода с 62 до 93% и специфичность с 95 до 99%.
Заключение. Разработан алгоритм проведения ИЦХ-исследований, отличающихся по количеству используемых моноклональных антител, для определения гистологической формы злокачественной опухоли и органа – источника метастазирования. В ряде случаев при проведении ИЦХ-исследований двух-трех моноклональных антител может быть вполне достаточно для подтверждения гистологической формы опухоли. При необходимости можно выполнить дополнительные ИЦХ-исследования без значительных потерь времени на получение результатов.
Цель исследования – показать возможности цитологического исследования экссудатов из серозных полостей в диагностике онкопатологии.
Материал и методы. За период 2018–2021 гг. цитологическому исследованию были подвергнуты 10 082 образца выпотных жидкостей серозных полостей: плевральной – 8166 (81%), абдоминальной – 1512 (15%), перикардиальной – 404 (4%). Проводилось микроскопическое исследование традиционных препаратов, в сложных диагностических случаях выполнялось иммуноцитохимическое (ИЦХ) исследование.
Результаты. Традиционный цитологический метод анализа выпотных жидкостей показал наличие метастатических поражений серозных полостей у женщин в 672 случаях (58%), главным образом за счет прогрессирования рака молочной железы (26%). У мужчин в основном регистрировались плевриты за счет метастазирования аденокарциномы легкого – 266 случаев (23%). Применение ИЦХ-исследования повышало диагностическую точность цитологического метода с 62 до 93% и специфичность с 95 до 99%.
Заключение. Разработан алгоритм проведения ИЦХ-исследований, отличающихся по количеству используемых моноклональных антител, для определения гистологической формы злокачественной опухоли и органа – источника метастазирования. В ряде случаев при проведении ИЦХ-исследований двух-трех моноклональных антител может быть вполне достаточно для подтверждения гистологической формы опухоли. При необходимости можно выполнить дополнительные ИЦХ-исследования без значительных потерь времени на получение результатов.



Введение
Значимость цитологического исследования в современной медицине бесспорна. В отличие от гистологического оно выполняется не на тканевом, а на клеточном уровне. Клиническая цитология отличается от других методов клинической лабораторной диагностики тем, что ее целью является выявление атипичных клеток с установлением цитоморфологического диагноза при неопухолевых и опухолевых процессах. Определение на клеточном уровне признаков злокачественности экссудатов связано с некоторыми субъективными трудностями, одной из которых является дифференциальная диагностика клеток мезотелия с признаками пролиферации и клеток, подозрительных по принадлежности к аденокарциноме. Выраженная реактивность серозного покрова полостей, десквамация и регенеративная способность мезотелия обусловливают большое разнообразие клеточного состава.
Необходимо отметить и тот факт, что нередко злокачественные клетки в экссудатах серозных полостей не удается обнаружить даже при поздних стадиях заболевания в силу недостаточного их количества в исследуемом материале [1]. В последнее время широкое внедрение метода жидкостной цитологии и иммуноцитохимического (ИЦХ) исследования позволило значительно снизить фактор субъективизма [2].
В связи с этим очень важно организовать оптимальный менеджмент в морфологических и клинико-диагностических лабораториях (КДЛ), установить цитологические критерии дифференциальной диагностики опухолей при исследовании выпотных жидкостей и разработать алгоритм проведения ИЦХ-исследований. Признаки атипии клеток при различных поражениях перекрещиваются с признаками злокачественности, что создает определенные трудности в идентификации природы поражения и может служить причиной ложноположительного или ложноотрицательного цитологического диагноза [3, 4].
Задача цитолога – донести до клинициста информацию о том, как важно соблюдать и выполнять пакет инструкций, сформированный в цитологической лаборатории, который представляет алгоритм направления биологического материала, приготовления цитологических препаратов, а также проведения микроскопического исследования и интерпретации полученных результатов.
Цель исследования – показать возможности цитологического исследования экссудатов серозных полостей в диагностике онкопатологии.
Материал и методы
Работа выполнена на базе Центра грудной хирургии ГБУЗ «НИИ – ККБ № 1 им. проф. С.В. Очаповского» в КДЛ. За период 2018–2021 гг. цитологическому исследованию были подвергнуты 10 082 образца выпотной жидкости серозных полостей (плевральной – 8166 (81%), абдоминальной – 1512 (15%), перикардиальной – 404 (4%)) пациентов, находящихся на обследовании в поликлинических и других стационарных отделениях больницы по поводу подозрения на наличие злокачественного новообразования (чаще рака легкого).
Перед проведением пункции серозных полостей для оценки распространенности опухолевого процесса всем пациентам выполнялось комплексное обследование с использованием лучевых (ультразвуковое сканирование, рентгенологическое исследование, компьютерная и магнитно-резонансная томография) и других диагностических методов. Пункции серозных полостей с диагностической и/или лечебной целью выполняли врачи-хирурги по общепринятым методикам.
К полученной выпотной жидкости добавляли антикоагулянт (раствор цитрата натрия 5% в расчете 5 мл на 100 мл жидкости или гепарин 1 мл (5000 МЕ) на 500 мл жидкости). При этом весь полученный экссудат направляли для исследования в КДЛ. На первом, преаналитическом этапе исследования медицинский лабораторный техник оценивал физико-химические свойства, наличие осадка до и после центрифугирования на обычной центрифуге. Стеклопрепараты для ИЦХ-исследования готовили двумя методами: жидкостным (с использованием предметных стекол с поли-L-лизиновым покрытием) на цитоцентрифуге Cytospin 4 и традиционным. Полученные микропрепараты фиксировали по методу Май – Грюнвальда и окрашивали по Романовскому – Гимзе.
На аналитическом этапе проводили микроскопическое исследование традиционных препаратов, в сложных диагностических случаях выполняли ИЦХ-исследование с использованием панели моно- или поликлональных антител различных фирм-производителей. Чаще всего использовали следующие панели антител: к общим цитокератинам (AE1/AE3), эпителиальному антигену Ber-EP4, раково-эмбриональному антигену, эпителиальному мембранному антигену, мезотелиальному антигену HBME-1, Vimentin, Calretinin, Mesotelin, тиреоидному фактору транскрипции 1 (TTF-1), цитокератинам (СК) 7, 20, 5/6, Napsin, CA-125, маркеру опухоли Вильмса (WT-1), хромогранину А, синаптофизину, CD56, рецепторам эстрогенов, рецепторам прогестерона, Melan A, S100, тиреоглобулину.
Результаты
Как видно из табл. 1, в 2020 г. количество цитологических исследований в КДЛ уменьшилось на 34% в сравнении с 2019 г. Это связано с эпидемиологическими ограничениями, обусловленными новой коронавирусной инфекцией COVID-19. В 2021 г. количество исследований увеличилось на 12% в сравнении с 2020 г.
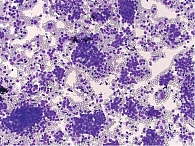
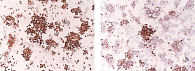
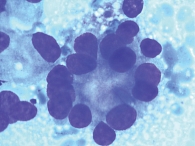
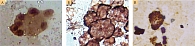
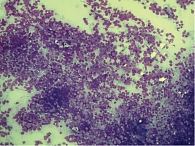
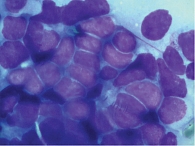
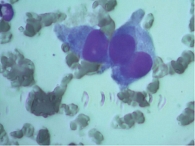
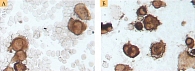
Ретроспективный анализ результатов морфологического исследования, полученных с 2019 по 2021 г., показал, что традиционным цитологическим методом в выпотных жидкостях у женщин метастатические поражения серозных полостей (плевральной и абдоминальной) диагностировались чаще – 672 случая (58%) от общего количества метастатических поражений серозных полостей, главным образом за счет прогрессирования рака молочной железы (26%) (рис. 1). При этом опухолевые клетки при проведении ИЦХ-исследования экспрессировали рецепторы эстрогенов и прогестерона (рис. 2). У мужчин метастатические плевриты были обусловлены в основном метастазированием аденокарциномы легкого – 266 случаев (23%) (рис. 3). При этом опухолевые клетки при проведении ИЦХ-исследования экспрессировали эпителиальный маркер Ber-EP4 (+), цитокератины СК7 (+), TTF1 (+) (рис. 4).
По морфологической структуре метастатические экссудаты с наличием клеток аденокарциномы легкого выявлялись чаще (в 75 (54,3%) случаях), чем метастазы плоскоклеточного рака (35 (25,36%)). Метастатические экссудаты при остальных гистологических формах рака легких представлены меньшим числом наблюдений: мелкоклеточного рака (16 (1,59%)), нейроэндокринных опухолей (12 (8,7%)) (табл. 2).
В представленной табл. 2 цитологические и иммуноцитохимические заключения, полученные при исследовании опухолей легкого, лимфатических узлов средостения и плевры, сопоставлены с результатами гистологического и иммуногистохимического исследования, что позволило оценить точность цитологического и ИЦХ-исследований при метастатических экссудатах опухолей различного гистогенеза (рис. 5–8).
Наибольшие трудности дифференциальной диагностики возникали при воспалительных процессах и метастатических экссудатах, так как часто реактивно измененный мезотелий приобретает признаки атипии, полиморфизма, что может вызвать ошибочное предположение о наличии метастазов злокачественного новообразования (рис. 9).
Во всех случаях при цитологическом заключении «метастатический экссудат с наличием клеток злокачественного новообразования» проводилось ИЦХ-исследование с использованием эпителиального маркера BerEp4 и/или CD 45 (LCA) и Vimentin. При положительной экспрессии BerEp4 и отрицательной – Vimentin цитолог делал заключение «метастатический экссудат с наличием клеток рака». При наличии плевральных экссудатов выполнялось ИЦХ-исследование с антигенами TTF1 (маркер для аденокарциномы легкого и рака щитовидной железы). В случае экспрессии TTF1(+) и отсутствия экспрессии тиреоглобулина (–) делалось заключение: «метастатический экссудат с наличием клеток аденокарциномы легкого». Необходимо помнить, что тиреоглобулин в клетках опухоли легкого всегда отрицательный. В случае положительной экспрессии TTF1 (+) и тиреоглобулина (+) опухолевыми клетками цитологическое заключение: «метастатический экссудат с наличием клеток папиллярного или фолликулярного рака щитовидной железы».
В результате проведенного морфологического исследования 5800 экссудатов, собранных за последние три года, в 20% случаев выпотная жидкость из серозных полостей была обусловлена наличием злокачественного процесса, в 30% – воспалительным генезом и в 35% – лимфоидным характером (табл. 3).
Таким образом, применение ИЦХ-исследования в сложных случаях повышает диагностическую точность цитологического метода диагностики метастатических экссудатов с 62 до 93% и специфичность с 95 до 99%.
Необходимо отметить, что правильно классифицировать плевральный выпот по клеточному составу с использованием только цитологического исследования можно при туберкулезе легких; плеврите, обусловленном пневмонией; синдроме транссудата у пациентов с сердечно-сосудистой недостаточностью. Выпотная жидкость у пациентов с плевритами неопухолевой этиологии имеет мезотелиально-лимфоцитарный, гранулоцитарно-макрофагальный, макрофагально-гистиоцитарный клеточный состав.
Заключение
Цитологическое исследование жидкостей серозных полостей составляет важную часть в повседневной работе цитологической лаборатории и является одним из методов морфологической диагностики патологического процесса. Исследование выпотных жидкостей позволяет врачу получить информацию о патогенезе образования выпота, корректно выбрать тактику лечения и спрогнозировать динамику развития заболевания.
Сформированный продуктивный клинико-лабораторный диалог значительно повышает информативность цитологической диагностики. Проанализировав результаты использования различных подходов, отличающихся по количеству используемых моно- или поликлональных антител для определения гистологической формы и органной принадлежности опухоли, мы разработали алгоритм проведения ИЦХ-исследования выпотных жидкостей. А именно: цитолог после просмотра материала, приготовленного традиционным методом, может принимать абсолютно взвешенные поэтапные решения о дальнейших диагностических действиях. В отдельных конкретных случаях проведения ИЦХ-исследования двух-трех моноклональных антител может быть вполне достаточно для определения гистологической формы опухоли и ее органной принадлежности, а при необходимости нужно выполнить дополнительные ИЦХ-исследования без значительных потерь времени в получении результатов.
K.S. Pavlyuk, M.G. Leonov, PhD, E.N. Slavnova, PhD, A.V. Akobyan, T.V. Sinitskaya, O.V. Gospirovich, E.A. Artemova
Krasnodar Scientific Research Institute – Regional Clinical Hospital No. 1 named after S.V. Ochapovsky
Novorossiysk Oncological Dispensary No. 3
Kuban State Medical University
P.A. Herzen Moscow Research Oncological Institute
Contact person: Mikhail G. Leonov, novonko@yandex.ru
Cytological criteria of tumors in exudate fluids are associated with certain subjective difficulties, one of which is the differential diagnosis of proliferating mesothelial and malignant neoplasm cells.
The study aimed to show the possibilities of cytological examination of exudates from serous cavities in the diagnosis of oncopathology.
Material and methods. From 2018 to 2021, 10,082 serous cavity effusions (pleural – 8,166 (81%), abdominal cavity – 1,512 (15%), pericardial – 404 (4%)) were included in the cytological examination. Microscopic examination of traditional preparations was carried out, and immunocytochemical (ICC) examination was carried out in difficult diagnostic situations.
Results. Analysis of the study showed that by the traditional cytological method in effusion fluids in women, metastatic lesions of the serous cavities were diagnosed in 672 cases (58%), mainly due to the progression of breast cancer (26%).
In men, pleurisy was mainly due to metastasis of adenocarcinoma of the lung – 266 cases (23%). ICC research increased the diagnostic accuracy of cytological examination by 62–93% and the specificity – by 95–99%.
Conclusions. An algorithm has been developed for conducting ICS studies, differing in the number of monoclonal antibodies used, to determine the histological form of a malignant tumor and the source organ of metastasis. In specific cases, conducting ICR studies with 2–3 monoclonal antibodies may be quite enough to confirm the histological form of the tumor and, where necessary, perform additional ICR studies without significant loss of time for obtaining results.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.