количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Теория
Нутриционная поддержка после обширных резекций кишечника: новые подходы
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Гастроэнтерология" Спецвыпуск №1 (7)
- Аннотация
- Статья
- Ссылки
- English
Авторы представили собственную классификацию типов клинико-нутриционных (метаболических) нарушений, возникающих вследствие обширных резекций кишечника, в зависимости от уровня и объема оперативного вмешательства. Обоснована необходимость применения стимуляторов микробиоты и заместительной коррекции желчных кислот в рамках нутриционной поддержки у пациентов с постколэктомическим синдромом. Показано, что даже в отдаленном периоде (свыше 5 лет после операции) введение в структуру нутриционной программы растительного препарата на основе подорожника блошиного и препарата урсодезоксихолевой кислоты (Урсосан) способствует более быстрому восстановлению нутриционного статуса по сравнению с традиционной нутриционной метаболической коррекцией.
Авторы представили собственную классификацию типов клинико-нутриционных (метаболических) нарушений, возникающих вследствие обширных резекций кишечника, в зависимости от уровня и объема оперативного вмешательства. Обоснована необходимость применения стимуляторов микробиоты и заместительной коррекции желчных кислот в рамках нутриционной поддержки у пациентов с постколэктомическим синдромом. Показано, что даже в отдаленном периоде (свыше 5 лет после операции) введение в структуру нутриционной программы растительного препарата на основе подорожника блошиного и препарата урсодезоксихолевой кислоты (Урсосан) способствует более быстрому восстановлению нутриционного статуса по сравнению с традиционной нутриционной метаболической коррекцией.
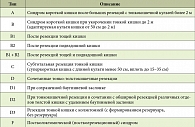
Таблица 1. Классификация вариантов обширных резекций кишечника
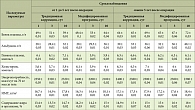
Таблица 2. Эффективность нутриционной коррекции после обширных резекций кишечника в отдаленном периоде у больных с метаболическими нарушениями типа F
Нутриционная поддержка прочно вошла в хирургическую практику. Однако предметом дискуссий остается выбор тактики нутриционной поддержки в отдаленном периоде (спустя 1–5 лет и более 5 лет) после резекций органов (в том числе обширных резекций кишечника), что во многом обусловлено адаптивными возможностями пищеварительного канала к работе в новых анатомических условиях, сопровождающихся изменением (угнетением) пищеварительно-транспортных процессов [1–3].
В условиях нарушенного всасывания в тонком кишечнике (при обширных резекциях, особенно сочетанных тонко-толстокишечных), при тяжелых формах воспалительных заболеваний толстой кишки нельзя не учитывать роль выключения микробиоты из пищеварения, значение возникающих иммунных сдвигов, а также влияние обусловленных отсутствием участков кишечника изменений в обмене желчных кислот, связанных с различными механизмами обработки пищевого рациона [4–7].
Нами предложена классификация [8–10] типов метаболических нарушений, возникающих вследствие обширных резекций кишечника различного объема и уровня (табл. 1). Выделенные типы описаны на основе анализа данных 675 больных в течение двадцатилетнего периода наблюдений.
Тип А
При этом типе метаболических нарушений отмечается относительно удовлетворительное качество жизни: клинические проявления либо отсутствуют вовсе, либо выражены незначительно – эпизодическая неустойчивость стула, непереносимость некоторых продуктов; в отдаленном периоде более 5 лет после операции у таких больных чаще отмечаются холецистолитиаз, оксалатные почечные камни. Адаптивные процессы в кишечнике весьма активны, окончательно формируются примерно через полгода-год после операции и характеризуются как минимум гиперплазией клеток ворсинок, увеличением глубины крипт (что повышает площадь поверхности слизистой оболочки), повышением ферментативной активности в зоне пристеночного пищеварения, увеличением синтеза гормонов кишечника и панкреатодуоденальной зоны. Биохимические параметры близки к норме. Дефицит массы тела отсутствует. Потребности в белковом и энергетическом компонентах соответствуют наблюдаемым в здоровом организме. Адаптация полная, прогноз благоприятный [11–13].
Тип В
Подтип В1
Обширная резекция тощей кишки – основного абсорбционного насосного участка – сопровождается нарушением всасывания. Типично наличие слабовыраженной или умеренной диареи. При резекции тощей кишки в большей степени, чем при удалении других участков тонкой кишки, развивается гиперсекреция соляной кислоты [14]. В основе этого нарушения лежит следующий механизм: прекращается синтез ингибиторных гормонов (гастральный ингибирующий пептид, вазоактивный интестинальный пептид), из-за чего повышается уровень гастрина и стимулируется синтез соляной кислоты. Повышенная нагрузка соляной кислотой усугубляет диарею, так как инактивируются панкреатическая липаза и конъюгация солей желчных кислот в кишке. Отмечаются дисгидрические нарушения, как правило, 1–2-й степени тяжести при волемических изменениях в виде нормоцитемической гиповолемии, незначительно повышенном гематокритном показателе, дефиците циркулирующих белка, натрия, кальция, магния, цинка. Дефицит массы тела либо отсутствует, либо соответствует трофологической недостаточности (гипотрофии) 1–2-й степени. В течение 1–1,5 лет изменяется компонентный состав тела: сначала происходит уменьшение жировой массы тела (до 9–10% содержания жира в организме) и потеря соматических и висцеральных белков, что соответствует легкой или средней степени недостаточности питания, затем компонентный состав тела стабилизируется. Адаптивные процессы, направленные главным образом на купирование синдрома кишечной недостаточности, аналогичны развивающимся при типе А, однако достигают максимальных величин значительно позднее (через 1 год – 1,5–2 года). Для подтипа B1 характерна частичная адаптация функций пищеварительного канала. В качестве приспособительной реакции практически вдвое увеличивается синтез гормонов кишечника и панкреатодуоденальной зоны. На ранних этапах диарея практически полностью купируется при приеме соответствующих препаратов, в последующем лечится диетой с совместным назначением медикаментов, обеспечивающих потенцирование нутритивной коррекции (фармаконутрицевтиков), препаратов анаболического действия и корректоров волемических и электролитных нарушений, витаминов. Иногда диагностируются неярко выраженные явления дисбиоза (вздутие живота, повышение уровня короткоцепочечных жирных кислот (КЦЖК) в копрофильтрате и проч.).
Подтип В2, подтип В1 + В2
Полная резекция подвздошной кишки приводит к серьезным расстройствам всасывания. Причиной диареи служат потери солей желчных кислот (холагенная диарея) и невсосавшиеся жирные кислоты (при подтипе В2). Отмечается пониженная концентрация желчных солей в желчи, что учащает встречаемость (образование) желчных камней. Выявляется снижение секреции холецистокинина, вследствие чего регистрируется гипокинезия желчного пузыря (в свою очередь способствующая застою желчи и камнеобразованию). При подтипе В1 + В2 развитию диареи также способствует механизм гиперсекреции соляной кислоты. Дисгидрические нарушения в основном имеют смешанный генез. Их выраженность зависит от длины культи. При длине 50–200 см культя адаптируемая, однако сроки адаптации зависят от объема удаляемой части, функционального резерва оставшегося отрезка и характера заболевания (при онкопатологии и рецидивах воспалительных заболеваний кишечника неизвестной этиологии функциональный резерв значительно снижен). Дисгидрические нарушения могут быть достаточно тяжелыми, сопровождаться развитием отечного синдрома; волемические изменения могут достигать степени гипоцитемической гиповолемии. Возможно наличие признаков В12-дефицитной и железодефицитной анемии (вследствие снижения всасывания железа). Может отмечаться дефицит циркулирующих белков, магния, натрия, калия, железа. Регистрируется дискинезия желчного пузыря, наблюдаются колебания показателей холестерина и трансаминаз (аспартатаминотрансфераза и аланинаминотрансфераза), снижается уровень креатинина плазмы, возможно появление белка в моче, уробилиногена. Иногда диагностируются явления неярко выраженного дисбиоза (вздутие живота, изменения уровней КЦЖК в копрофильтрате и проч.). Дефицит массы тела, как правило, соответствует трофологической недостаточности (гипотрофии) 3-й степени. Изменение компонентного состава тела происходит в течение 1–1,5 лет и характеризуется как понижением жировой массы тела (6–8% содержания жира в организме), так и потерей соматических и висцеральных белков, что в большинстве случаев соответствует средней или тяжелой, но корригируемой степени недостаточности питания. Потребности в белковом компоненте и энергии повышены примерно в 1,5 раза. Адаптивные процессы направлены на купирование синдрома кишечной недостаточности и гепаторенальной дисфункции. Прогноз сомнительный.
Тип С
Больные, перенесшие субтотальную резекцию тонкой кишки, относятся к наиболее тяжелой группе пациентов – 9–12 баллов согласно модифицированной системе оценки здоровья пациента (тяжести заболевания) АРАСНЕ-II (Acute physiological and chronic health evaluation – Оценка острых и хронических изменений состояния здоровья). При типе C отмечаются все наблюдаемые при подтипе В1 + В2 симптомы в наиболее выраженном виде. Из особенностей следует выделить выраженную слабость, дефицит массы тела 4-й степени, выраженную гипокалиемию (на уровне жизнеугрожающих величин), дефицит кальция, хлоридов, магния, цинка, микроэлементов, витаминов. Отмечается гипопротеинемия, гипоальбуминемия. Функциональный резерв кишечника отсутствует, печени и почек снижен. Происходит нарушение энтерогепатической циркуляции и, по-видимому, механизмов обратной регуляторной связи. При крайней степени тяжести состояния пациента в отсутствие специальной коррекции развивается полиорганная недостаточность. Адаптивные процессы направлены на сохранение гомеостаза. Без периодической коррекции в стационаре метаболических нарушений потеря массы тела у больных составляет почти 5% в год. Индекс массы тела – менее 18 кг/м2, снижается мышечная сила, увеличивается утомляемость, резко уменьшается масса свободного жира (менее 8–4%), повышаются уровни маркеров воспаления (фактор некроза опухоли (ФНО), интерлейкин (ИЛ) 6, C-реактивный белок). Анемия достигает значений по гемоглобину менее 12 г/дл, снижение альбумина плазмы достигает уровня менее 32 г/л, развивается дефицит омега-3 жирных кислот, то есть выявляются все диагностические критерии кахексии. В отсутствие направленной инфузионно-нутритивной коррекции в соответствии с критериями алиментационно-волемического диагноза развиваются эндотоксикоз, полиорганная недостаточность. Прогноз неблагоприятный.
Тип D
Наблюдается осмотическая диарея. Выявляется на первый взгляд необъяснимый лактатный (метаболический) ацидоз, что связано с бактериальной ферментацией лактозы в толстом кишечнике и выработкой избытка D-молочной кислоты, которая усиливает осмотическую диарею. Из особенностей выделим следующие: происходит транслокация кишечной микрофлоры (намного более выраженная при подтипе D2) в проксимальном направлении, развивается изменение активности толстокишечной микробиоты, приводящее в свою очередь к дефициту не только микроэлементов, но и витаминов, снижению иммунного ответа, развитию системного остеопороза и т.д. Особенно характерен дефицит магния. Потребности в белковом компоненте близки к норме, энергопотребность возрастает в 1,5–1,7 раза.
Тип F
Для пациентов с постколэктомическим (постколрезекционным) синдромом характерны симптомы нарушения микробиоценоза кишечника. При этом у больных с левосторонней гемиколэктомией, по данным Л.Б. Лазебника и соавт., отмечается более выраженный дисбиоз, чем при правосторонней гемиколэктомии [15]. В связи с нарушениями активности и спектра микробиоты возникают иммунные сдвиги: регистрируется повышение уровней ИЛ-6, ФНО. При левосторонней гемиколэктомии повышается уровень холестерина, липопротеидов низкой плотности, триглицеридов. При правосторонней гемиколэктомии наблюдается рост липопротеидов высокой плотности, что может стать предпосылкой для разработки антиатерогенных операций в метаболической хирургии. При колэктомии по причине изменения энтерогепатической циркуляции практически не происходит образования вторичных желчных кислот и, как следствие, достаточного количества урсодезоксихолевой кислоты, что диктует необходимость применения фармаконутрицевтиков в структуре нутриционной метаболической коррекции [16]. В стадии декомпенсации могут проявиться признаки эндотоксикоза, развитие которого при постколэктомическом синдроме обусловлено нарушением двух основных механизмов дезинтоксикации. Во-первых, при постколэктомическом синдроме отсутствует следующий эффект, наблюдаемый в естественных условиях: снижение рН при образовании КЦЖК приводит к тому, что аммиак, образующийся в толстой кишке, при микробном преобразовании белков и аминокислот переходит в ионы аммония, которые не могут свободно диффундировать через кишечную стенку в кровь, а выводятся в виде аммонийных солей с калом. Во-вторых, нарушается преобразование билирубина в уробилиноген, который в норме частично всасывается и экскретируется с мочой, а частично выводится с калом. В итоге в копрограмме появляются особенности, которые при благоприятном прогнозе по мере адаптации кишечника существенно нивелируются [17, 18].
Функциональный резерв остального кишечника (при нагрузке сахарозой) в целом достаточен для обеспечения нутритивной поддержки у 78% перенесших обширные операции на толстой кишке, у 22% пациентов он снижен или резко снижен в течение полугода после операции. Функциональные нарушения печени (и сниженный функциональный резерв), выявленные по данным ультразвукового ангиосканирования, могут быть верифицированы в соответствии со шкалой М.Д. Дибирова и В.С. Акопян (2008) [19]: в первые полгода у 88,2% отмечается легкая степень печеночной дисфункции (2–3 балла), у 11,8% – средняя степень (4–6 баллов). Среди последствий обширных резекций толстого кишечника выражены электролитные нарушения, в частности отмечается значительный дефицит магния, нарушение энтерогепатической циркуляции.
Функциональный резерв остального кишечника (при нагрузке сахарозой) в целом достаточен для обеспечения нутритивной поддержки у 78% перенесших обширные операции на толстой кишке, у 22% пациентов он снижен или резко снижен в течение полугода после операции. Функциональные нарушения печени (и сниженный функциональный резерв), выявленные по данным ультразвукового ангиосканирования, могут быть верифицированы в соответствии со шкалой М.Д. Дибирова и В.С. Акопян (2008) [19]: в первые полгода у 88,2% отмечается легкая степень печеночной дисфункции (2–3 балла), у 11,8% – средняя степень (4–6 баллов). Среди последствий обширных резекций толстого кишечника выражены электролитные нарушения, в частности отмечается значительный дефицит магния, нарушение энтерогепатической циркуляции.
Нутриционная коррекция у больных, перенесших обширные резекции кишечника
Как видно из приведенных выше описаний, типы метаболических нарушений С и F – клинически наиболее тяжелые. В механизмах развития метаболических нарушений у больных, перенесших обширные резекции кишечника, присутствуют различные факторы. Однако в настоящее время наименее изучена нутриционная недостаточность, развивающаяся вследствие нарушений пищеварения, в том числе связанных с участием в нем желчных кислот, цикл преобразований которых специфически изменяется в связи с послеоперационным отсутствием того или иного участка кишки.
Известно, что в физиологических условиях желчные кислоты синтезируются в микросомах, конъюгируются с таурином или глицином и в виде холевой и хенодезоксихолевой кислот (первичные желчные кислоты) выделяются в желчь, откуда под влиянием холецистокинина попадают в двенадцатиперстную кишку. Здесь начинается путь эмульгации жиров и их участия в липидном обмене. Далее по всей длине тонкой кишки происходит пассивное всасывание незначительного количества желчных кислот. Исключение представляет подвздошная кишка, где активно всасывается 80% желчных кислот. Невсосавшиеся желчные кислоты (около 16%) проходят ниже, в толстую кишку, и подвергаются процессу деконъюгации ферментами кишечной микробиоты. Незначительная часть деконъюгированных желчных кислот также всасывается, но большая их часть превращается в дегидрохолевую и литохолевую кислоты (вторичные желчные кислоты), которые также всасываются в толстой кишке (пассивно) и затем попадают в печень, чтобы снова повторить цикл энтерогепатической циркуляции (ЭГЦ). Потери желчных кислот с калом составляют 2–5%. В сутки выполняется 5–10 циклов ЭГЦ [20], обеспечивающих экономию количества желчных кислот в организме, так как печень не в состоянии обеспечить синтез суточных норм желчных кислот (в норме печень синтезирует лишь 0,2–0,6 г желчных кислот в сутки, в то время как за счет ЭГЦ в желчь выделяется 25–30 г желчных кислот в сутки). Следовательно, недостаточность желчных кислот может быть связана: а) с первичным уменьшением их синтеза (заболевания печени), б) с нарушением ЭГЦ, в) с нарушением механизмов обратной связи, регулирующих их синтез.
В норме при уменьшении уровня желчных кислот, участвующих в ЭГЦ, происходит активация их синтеза печенью до достижения нормального уровня. При изучении клинико-нутриционных параллелей установлено, что последствием обширных резекций кишечника является недостаточный синтез вторичных желчных кислот, то есть у таких больных не обеспечивается формирование полноценной энтерогепатической циркуляции и регуляции. Пул кишечной микробиоты оказывается также малоактивным вследствие укорочения кишечной поверхности [21–23].
По этой же причине несостоятельной оказывается и обратная связь, регулирующая синтез желчных кислот, так как структуры, участвующие в гормональной регуляции, также могут оказаться в зоне удаленного отрезка кишечника.
Учитывая приведенные выше сведения, мы провели исследование, в ходе которого пациентам для коррекции нутриционных нарушений в отдаленном периоде после перенесенной операции резекции кишечника в структуру нутриционной поддержки включали стимуляторы микробиоты (растительный препарат Подорожника семенная кожура (Plantaginis semenis deliciosa) по 5 г на прием, то есть по 1 саше 1–2 раза в сутки растворяли и вводили в составе принимаемого рациона) и заместительную коррекцию желчными кислотами (препарат урсодезоксихолевой кислоты Урсосан 250 мг в сутки растворяли в объеме суточного рациона).
Наш опыт применения модифицированной программы коррекции (введение в структуру нутриционной программы растительного препарата на основе подорожника блошиного и Урсосана) в сравнении с традиционной нутриционной коррекцией у пациентов с последствиями обширной резекции кишечника типа F, поступавших в стационар для коррекции нутриционных нарушений спустя 1–5 лет и свыше 5 лет после перенесенной колэктомии, представлен в табл. 2.
Как видно из данных табл. 2, отмечаются следующие преимущества модифицированной схемы: быстрее восстанавливались параметры общего белка, альбумина, наблюдалась тенденция к увеличению массы тела. При этом уровни глюкозы и холестерина оставались в пределах физиологических колебаний. Показательно и сохранение индекса литогенности желчи на близком к норме уровне (0,9–0,93) в течение первых 3 лет наблюдения у пациентов, длительно получавших модифицированную нутриционную коррекцию (наличие сладжа, неоднородности желчи верифицировались также по данным ультразвукового исследования).
Таким образом, при проведении нутриционной коррекции у больных, перенесших обширные резекции кишечника, в зависимости от уровня и объема вмешательства выделяются несколько характерных типов клинико-нутриционных (метаболических) нарушений (А–F типы) [10]. В результате развившихся последствий объемных операций на кишечнике нарушаются различные виды обмена, в том числе и обмен желчных кислот, связанный с выпадением функционально значимых отрезков кишечника. При проведении нутриционного лечения у таких больных целесообразно в его структуру вводить корректоры микробиоты и препараты урсодезоксихолевой кислоты (нами применялся препарат Урсосан в стандартных терапевтических дозировках – по 1 капсуле (250 мг) 1 раз в сутки). Такая схема терапии приводит к более полной утилизации липидов и в целом к более быстрому восстановлению нутриционного статуса даже в отдаленном периоде после перенесенной колэктомии.
1. Жерлов Т.К., Баширов С.Р., Рыжов А.И. Хирургическая коррекция постколэктомических нарушений. Новосибирск: Наука, 2004.
2. Jeppesen P.B. The novel use of peptide analogs in short bowel syndrome // Expert Rev. Gastroenterol. Hepatol. 2013. Vol. 7. № 3. P. 197–199.
3. Krähenbühl L., Büchler M.W. Pathophysiology, clinical aspects and therapy of short bowel syndrome // Chirurg. 1997. Vol. 68. № 6. P. 559–567.
4. Адлер Г. Болезнь Крона и язвенный колит: пер. с нем. А.А. Шептулина. М.: Гэотар-мед, 2001.
5. Ардатская М.Д. Клиническое значение короткоцепочечных жирных кислот при патологии желудочно-кишечного тракта: автореф. дис. … д-ра мед. наук. М., 2003.
6. Балтайтис Ю.В. Обширные резекции толстой кишки. Киев: Здоровье, 1990.
7. Schütz T.; Lochs H. Kurzdarmsyndrom // Der Gastroenterologe. 2009. Vol. 4. № 1. P. 27–34.
8. Костюченко Л.Н., Кузьмина Т.Н. Нутриционная поддержка при последствиях обширных резекций кишечника // Национальное руководство по нутрициологии. 2013. С. 563–584.
9. Костюченко Л.Н. Нутриционная поддержка при последствиях обширных резекций различных отделов кишечника // Современная медицинская наука. 2013. № 3. С. 48–68.
10. Нутрициология в гастроэнтерологии: руководство для врачей / под ред. Л.Н. Костюченко. М.: Медицинская книга, 2013.
11. Nightingale J., Woodward J.M.; Small Bowel and Nutrition Committee of the British Society of Gastroenterology. Guidelines for management of patients with a short bowel // Gut. 2006. Vol. 55. Suppl. 4. P. iv1–iv12.
12. Thompson J.S., DiBaise J.K., Iyer K.R. et al. Postoperative short bowel syndrome // J. Am. Coll. Surg. 2005. Vol. 201. № 1. P. 85–89.
13. Lobo D.N. Colonic adaptation: a therapeutic target for short-bowel syndrome? // World J. Surg. 2008. Vol. 32. № 8. P. 1840–1842.
14. Gruy-Kapral C., Little K.H., Fordtran J.S. et al. Conjugated bile acid replacement therapy for short-bowel syndrome // Gastroenterology. 1999. Vol. 116. № 1. P. 15–21.
15. Лазебник Л.Б., Ли И.А., Дроздов В.Н., Сильвестрова С.Ю. Нарушения микробиоценоза кишечника и метаболизма липидов после гемиколэктомии // Экспериментальная и клиническая гастроэнтерология. 2010. № 3. С. 32–38.
16. Christl S.U., Scheppach W. Metabolic consequences of total colectomy // Scand. J. Gastroenterol. Suppl. 1997. Vol. 222. P. 20–24.
17. Ривкин В.А., Бронштейн А.С., Файн С.Н. Руководство по колопроктологии. М.: Медпрактика, 2001.
18. Caldarini M.I., Pons S., D’Agostino D. et al. Abnormal fecal flora in a patient with short bowel syndrome. An in vitro study on effect of pH on D-lactic acid production // Dig. Dis. Sci. 1996. Vol. 41. № 8. P. 1649–1652.
19. Дибиров М.Д., Акопян В.С., Родионов И.Е. и др. Способ оценки степени тяжести функциональных нарушений печени. Патент на изобретение № 2372852. 2008.
20. Алмазов В.А., Петрищев Н.Н., Шляхто Е.В., Леонтьева Н.В. Клиническая патофизиология. М.: ВУНМЦ, 1999.
21. Нутриционная поддержка в гастроэнтерологии / под ред. Л.Н. Костюченко. М.: Бином, 2012.
22. Jiang H.P., Guo Q.F., Zhang H.W., Yuan L., Chen D. Observation of ultrastructure and absorption function of colon mucosa in rats with ultra-short bowel syndrome // Zhongguo Linchuang Yingyang Zazhi. 2010. Vol. 18. P. 360–365.
23. Kinross J.M., von Roon A.C., Holmes E. et al. The human gut microbiome: implications for future health care // Curr. Gastroenterol. Rep. 2008. Vol. 10. № 4. P. 396–403.
Nutritional support after massive bowel resections: new approaches
L.N. Kostyuchenko, O.A. Smirnova, T.N. Kuzmina
Moscow Clinical Applied Research Center of the Moscow City Health Department
Contact person: Lyudmila Nikolayevna Kostyuchenko, aprilbird2@yandex.ru
The authors present their new classification of clinical and nutritional (metabolic) disorders after massive bowel resections taking into consideration the level and extent of resection. To provide nutritional support in patients with post-colectomy short bowel syndrome, microbiota stimulators and bile acid replacement therapy are recommended. Even in patients who had undergone bowel resection 5 years ago or more, adding to nutritional program Plantago psyllium L. herbal preparation and ursodeoxycholic acid (Ursosan) resulted in faster nutritional status improvement compared to standard nutritional support.
Key words: massive bowel resection, nutritional support, pharmacologic nutraceuticals, ursodeoxycholic acid
L.N. Kostyuchenko, O.A. Smirnova, T.N. Kuzmina
Moscow Clinical Applied Research Center of the Moscow City Health Department
Contact person: Lyudmila Nikolayevna Kostyuchenko, aprilbird2@yandex.ru
The authors present their new classification of clinical and nutritional (metabolic) disorders after massive bowel resections taking into consideration the level and extent of resection. To provide nutritional support in patients with post-colectomy short bowel syndrome, microbiota stimulators and bile acid replacement therapy are recommended. Even in patients who had undergone bowel resection 5 years ago or more, adding to nutritional program Plantago psyllium L. herbal preparation and ursodeoxycholic acid (Ursosan) resulted in faster nutritional status improvement compared to standard nutritional support.
Key words: massive bowel resection, nutritional support, pharmacologic nutraceuticals, ursodeoxycholic acid
Отправить статью по электронной почте
Ваш адрес электронной почты:
Авторы представили собственную классификацию типов клинико-нутриционных (метаболических) нарушений, возникающих вследствие обширных резекций кишечника, в зависимости от уровня и объема оперативного вмешательства. Обоснована необходимость применения стимуляторов микробиоты и заместительной коррекции желчных кислот в рамках нутриционной поддержки у пациентов с постколэктомическим синдромом. Показано, что даже в отдаленном периоде (свыше 5 лет после операции) введение в структуру нутриционной программы растительного препарата на основе подорожника блошиного и препарата урсодезоксихолевой кислоты (Урсосан) способствует более быстрому восстановлению нутриционного статуса по сравнению с традиционной нутриционной метаболической коррекцией.
" id="sender_art_description" name = "SENDER_ART_DESCRIPTION" />
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
