Желчные кислоты при первичном билиарном холангите как повреждающий фактор для холангиоцитов и как лекарственные средства
- Аннотация
- Статья
- Ссылки
- English
Введение
Первичный билиарный холангит (ПБХ) – это хроническое холестатическое прогрессирующее заболевание печени, относящееся к холангиопатиям [1]. У пациентов без лечения происходит постепенное прогрессирование заболевания с развитием повреждения холангиоцитов мелких желчных протоков, приводящее к их пролиферации, фиброзу и дуктулопении, сопровождающейся нарастающим холестазом. Вторым этапом заболевания является прогрессирование холестаза, что приводит к вовлечению в патологический процесс гепатоцитов, их повреждению, развитию фиброза и в конечном итоге холестатического цирроза печени и печеночно-клеточной недостаточности. Лечение любого заболевания зависит от раскрытия этиологических и патогенетических механизмов его развития, а также от разработки соответствующих препаратов. В настоящее время не существует этиотропных, значимо эффективных методов лечения ПБХ, так как этиология заболевания до настоящего времени остается неизвестной. Поэтому лечение пациентов с ПБХ преимущественно неспецифическое, а на поздних стадиях заболевания и симптоматическое. При этом в патогенезе развития повреждений холангиоцитов и гепатоцитов при ПБХ достигнуты определенные успехи, что позволило использовать гидрофильные желчные кислоты для лечения этого заболевания.
Использование гидрофильных желчных кислот для лечения ПБХ связано со значительным прогрессом в расширении наших представлений в понимании физиологии процессов желчеобразования и желчевыделения, а также роли желчных кислот в повреждении и гибели билиарных эпителиальных клеток (БЭК, холангиоцитов) при ПБХ [2–4]. Новые знания помогли лучше разграничить патофизиологию холестаза, адаптивные реакции БЭК и гепатоцитов на повреждающее действие желчных кислот. Знание физико-химических свойств различных желчных кислот и адаптивных реакций холангиоцитов и печеночных клеток к ним послужили важной основой для разработки относительно эффективных лекарственных препаратов на основе гидрофильных желчных кислот, способных потенциально замедлить прогрессирование заболевания. Основной принцип действия препаратов, содержащих гидрофильные желчные кислоты, заключается в замещении и разбавлении токсичных (обладающих сильными детергентными свойствами) первичных желчных кислот на менее токсичные и более гидрофильные и легко выводимые из организма. Проводимая терапия желчными кислотами при ПБХ направлена на замедление прогрессирования заболевания, увеличение продолжительности жизни и повышение ее качества.
В последние годы перечень гидрофильных желчных кислот, применяемых для лечения холестатических заболеваний печени, включая ПБХ, был расширен, и кроме урсодезоксихолевой кислоты (УДХК) обсуждается применение в качестве лекарственных препаратов обетихолевой кислоты (ОХК), тауроурсодезоксихолевой кислоты (ТУДХК) и норурсодезоксихолевой кислоты (норУДХК). В обзоре рассматриваются механизмы, объясняющие положительные терапевтические эффекты и потенциальные возможности каждой из желчных кислот в качестве лекарственного препарата, исходя из представлений о патогенезе начальных стадий ПБХ [4].
Первым препаратом для лечения ПБХ, одобренным Управлением по контролю качества пищевых продуктов и лекарственных средств США (FDA), была УДХК [5].
УДХК как препарат первой линии в лечении ПБХ
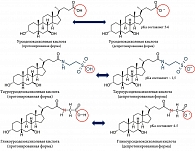
В 1987 г. немецкие гепатологи U. Leuschner и W. Kurtz [6] сообщили о положительном эффекте УДХК у пациентов с первичным билиарным холангитом – заболевании, которое ранее было известно как первичный билиарный цирроз [7, 8]. УДХК является 7-бета-эпимером первичной хенодезоксихолевой желчной кислоты (ХДХК), у которой гидроксигруппа (ОН) у седьмого углеродного атома имеет бета-положение, а не альфа-, как в ХДХК (рис. 1). Именно эти, незначительные, на первый взгляд, структурные химические различия приводят к существенным фармакотерапевтическим отличиям этих двух желчных кислот: УДХК является более гидрофильной и менее гепатотоксичной, чем ХДХК. Исследования многих ученых послужили основой к накоплению доказательств, подтверждающих положительный терапевтический эффект, послуживший основанием для использования УДХК в качестве стандарта лечения пациентов с ПБХ [9–14].
УДХК изучали во многих рандомизированных, плацебо-контролируемых исследованиях у пациентов с I–IV стадиями ПБХ как с положительными, так и с неоднозначными результатами [11, 15–18]. Клинические исследования показали, что пероральный прием УДХК в дозе 13–15 мг/кг/сут. хорошо переносится больными и оказывает положительный терапевтический эффект при холестатических заболеваниях печени, включая ПБХ [19]. Научные публикации отмечают, что прием УДХК у большинства пациентов улучшает биохимические маркеры холестаза (щелочная фосфатаза, гамма-глютамилтранспептидаза), замедляет прогрессирование ПБХ, отдаляет трансплантацию печени и смерть у большинства пациентов, улучшая таким образом их выживаемость [20, 21]. Эффективность применения УДХК зависит от стадии заболевания: чем раньше (I–II стадия) начато лечение, тем оно эффективнее. Некоторые авторы считают, что выживаемость без трансплантации у пациентов с ранней стадией ПБХ, получавших УДХК, была эквивалентна таковой в контрольной группе здоровых людей, сопоставимой по возрасту и полу [22–24]. Применение УДХК при ПБХ задерживает гистологическую прогрессию заболевания и продлевает выживаемость пациентов без трансплантации печени, в связи с чем этот препарат рекомендуется в качестве терапии первой линии для всех пациентов с ПБХ [19, 25]. Несмотря на это, эффективность применения УДХК при ПБХ остается предметом дискуссий из-за отсутствия доказательств эффективности по жестким конечным точкам (например, выживаемость или выживаемость без трансплантации печени), особенно у пациентов, которые начали прием препаратов УДХК на поздних стадиях заболевания [2].
Механизм положительного эффекта УДХК до конца не изучен. Ясно одно, что он зависит как от ее физико-химических свойств, так и от ее метаболизма и энтерогепатической циркуляции. В связи с этим важно представлять метаболизм УДХК в норме, от каких факторов он зависит и как меняется при ПБХ.
Метаболизм УДХК и образование конъюгатов с таурином и глицином
В норме в желчи человека присутствует около 5% УДХК. При пероральном применении препаратов УДХК для лечения холестатических заболеваний печени происходит увеличение ее фракции в желчи. После перорального приема большая часть УДХК всасывается путем пассивной диффузии в тонкой кишке и с венозной кровью воротной вены попадает в печень, где захватывается гепатоцитами. В печеночной клетке происходит конъюгирование боковой цепи УДХК с глицином или таурином (амидирование). Важно отметить, что примерно 75% УДХК конъюгирует с глицином, а около 25% – с таурином, как и первичные желчные кислоты [26].
Конъюгаты УДХК осуществляют энтерогепатическую циркуляцию. Конъюгированная с глицином или таурином УДХК в депротонированном состоянии поступает в печеночную желчь (рис. 1). И при нейтральном (рН 7,4) или слабощелочном физиологическом значении рН печеночной желчи глициновые и тауриновые конъюгаты УДХК находятся в ней в депротонированном состоянии, что не позволяет им проникать в холангиоциты через билиарный бикарбонатный «зонтик» [27, 28].
Последний создается вследствие секреции бикарбоната (HCO3-) БЭК. Бикарбонат, обладая буферными свойствами, поддерживает нейтральное или слабощелочное рН печеночной желчи, создает отрицательный заряд в надэпителиальном слое и поддерживает желчные кислоты в депротонированном состоянии [29]. Так как отрицательные заряды отталкиваются друг от друга, то желчные кислоты в ионизированной форме не подходят к апикальной поверхности холангиоцитов, что препятствует их проникновению в БЭК. Все это получило название билиарный бикарбонатный «зонтик».
В норме у здорового человека желчные кислоты, включая УДХК, в ионизированном (депротонированном) и конъюгированном с глицином и таурином состоянии поступают в желчный пузырь и двенадцатиперстную кишку. В кишечнике они благодаря своим детергентным свойствам принимают активное участие в эмульгировании и всасывании жиров и жирорастворимых витаминов.
Реакция конъюгатов УДХК с глицином и таурином на изменения рН печеночной желчи при ПБХ
В последние десятилетия появились научные данные об изменении рН печеночной желчи при ПБХ и его значении в развитии холангиопатии [27]. Было показано, что при ПБХ имеет место недостаточный синтез HCO3- холангиоцитами, недостаточное поступление бикарбоната в желчные протоки при одновременном его накоплении в БЭК [27, 30]. Имеются данные о том, что недостаточный синтез и поступление HCO3- в желчные протоки при ПБХ обусловлены снижением активности рецептора третьего типа инозитол-1,4,5-трисфосфата (InsP3R3) и хлор/бикарбонатного (Cl-/HCO3)-анионообменника 2 (AE2), вызванным повышением активности микро-РНК 506 (miR-506) в холангиоцитах, выстилающих желчные протоки [30]. До настоящего времени не известны факторы, запускающие повышенную экспрессию гена miR-506.
В результате недостаточного поступления бикарбоната в желчные протоки при ПБХ происходит закисление рН печеночной желчи и защелачивание рН внутри мелких БЭК, что приводит к нарушению метаболизма глициновых (но не тауриновых) конъюгатов желчных кислот, включая УДХК. В основе этого нарушения лежат различия в физико-химических свойствах глициновых и тауриновых конъюгатов желчных кислот, определяющих их состояние протонирования и депротонирования в зависимости от рН окружающей среды. Степень протонирования и депротонирования желчных кислот зависит как от уровня рН печеночной желчи, так и от константы диссоциации (pKa) желчных кислот. Так, значения pKa для неконъюгированных желчных кислот составляют 5–6 [31, 32]. Вследствие амидирования желчных кислот, рКа снижается до значений 4–5 для конъюгатов с глицином и 1–2 для конъюгатов с таурином [31–33] (рис. 1).
Закисление рН печеночной желчи при ПБХ позволяет неконъюгированным желчным кислотам и их глициновым конъюгатам, имеющим высокие значения pKa, легко протонироваться [31, 32]. Низкие значения pKa тауриновых конъюгатов желчных кислот свидетельствуют о том, что они являются более сильными кислотами, чем глициновые конъюгаты. Поэтому конъюгированные с таурином желчные кислоты будут находиться в диссоциированной (депротонированной, ионизированной) форме даже при сильно кислых значениях рН печеночной желчи. Глициновые конъюгаты с более высокими значениями pKa являются слабыми кислотами, поэтому при малейшем изменении рН желчи в кислую сторону будут быстро переходить в протонированное состояние и благодаря этому легко преодолевать билиарный бикарбонатный «зонтик» для проникновения в мелкие БЭК [32].
Роль бикарбоната и рН печеночной желчи в защите мелких холангиоцитов от повреждающего действия желчных кислот
Первичный билиарный холангит – это хроническое холестатическое прогрессирующее заболевание печени, протекающее с деструкцией, апоптозом и некрозом эпителия преимущественно мелких внутридольковых и септальных желчных протоков, с развитием дуктулопении и холестаза, в терминальной стадии которого развивается цирроз печени [1]. Развитие ПБХ уже в асимптоматической стадии заболевания связано с повреждением мелких холангиоцитов и развитием дуктулопении, приводящей к холестазу. До настоящего времени нет четкого представления, почему повреждаются при ПБХ именно мелкие холангиоциты, выстилающие внутридольковые, междольковые и септальные желчные протоки. Предполагается, что происходит это вследствие дисбаланса между факторами агрессии (желчными кислотами печеночной желчи) и факторами защиты (билиарный бикарбонатный «зонтик») холангиоцитов [4].
Желчь является агрессивной средой для холангиоцитов, выстилающих внутри- и внепеченочные желчные протоки. Наличие в желчи желчных кислот, обладающих мощными детергентными свойствами, способно вызывать повреждение клеточных мембран холангиоцитов. Гидрофобные желчные кислоты проявляют цитотоксичность ко многим типам клеток [27]. Однако билиарные эпителиальные клетки желчных протоков человека, несмотря на воздействие на них очень высоких (миллимолярных) концентраций гидрофобных желчных кислот, не проявляют признаков цитотоксичности [34]. Эта устойчивость подразумевает наличие механизмов, защищающих холангиоциты от токсического воздействия желчных кислот в норме. К известным факторам защиты, которые поступают в желчь в процессе ее прохождения по желчным протокам, относят выработку и секрецию муцина и HCO3- холангиоцитами [35]. В физиологических условиях основной функцией БЭК является билиарная секреция бикарбоната, необходимого для поддержания нейтрального или слабощелочного рН печеночной желчи [29]. Такое рН поддерживает желчные кислоты в депротонированном состоянии. HCO3- вырабатывается холангиоцитами на всем протяжении билиарного дерева.
Выработка муциновых гликопротеидов осуществляется перибилиарными железами (ПБЖ) [36]. Последние располагаются в стенке только крупных внутри- и внепеченочных желчных протоков и непосредственно связаны с их просветом. Вырабатываемый ПБЖ муцин наряду с бикарбонатом защищает холангиоциты от повреждающего действия желчных кислот только в крупных желчных протоках [35]. Холангиоциты крупных внутри- и внепеченочных желчных протоков имеют двойную защиту: муцин, вырабатываемый ПБЖ, и бикарбонат.
Внутридольковые, междольковые и септальные желчные протоки, которые поражаются при ПБХ, перибилиарных желез не содержат, что сопровождается отсутствием в них муцина [36]. В результате на уровне внутридольковых, междольковых и септальных желчных протоков фактором защиты мелких БЭК служит только бикарбонат.
Влияние «дырявого» билиарного бикарбонатного «зонтика» на метаболизм УДХК при ПБХ
Основным пусковым механизмом повреждения мелких БЭК и развития холестаза при ПБХ является поступление и накопление в холангиоцитах гидрофобных желчных кислот [4]. Механизм неконтролируемого поступления и накопления эндогенных желчных кислот в мелких БЭК связан со снижением защитной роли бикарбоната при ПБХ. Активно обсуждается теория «дырявого» билиарного бикарбонатного «зонтика» [27, 28, 37]. Эта теория основана на ряде клинических и экспериментальных работ, показывающих недостаточный синтез HCO3- холангиоцитами, его недостаточное поступление в желчные протоки при одновременном его накоплении в БЭК при ПБХ [27, 30]. Недостаточный синтез и поступление HCO3- в просвет желчных протоков приводит к созданию так называемого «дырявого» билиарного бикарбонатного «зонтика». Это приводит к смещению рН внутрипротоковой (печеночной) желчи в слабокислую область и увеличение рН внутри холангиоцита в слабощелочную область [30].
Закисление рН печеночной желчи и защелачивание рН внутри мелких БЭК приводит к нарушению метаболизма глициновых (но не тауриновых) конъюгатов первичных желчных кислот, включая УДХК, поступлению их и накоплению в БЭК, что приводит к апоптозу мелких холангиоцитов, развитию дуктулопении, с последующим развитием холестаза и токсического (детергентного) действия желчных кислот не только на холангиоциты, но и на гепатоциты по мере развития холестаза [4]. Наличие на апикальной поверхности крупных холангиоцитов муцинсодержащего гликокаликсного слоя защищает их от проникновения и повреждающего действия протонированных конъюгированных и неконъюгированных желчных кислот. Поэтому они не вовлекаются в механизм развития ПБХ.
Длительный пероральный прием препаратов УДХК в дозе 13–15 мг/кг/сут. [19] приводит к значительному замещению гидрофобных первичных желчных кислот на менее токсичную и более гидрофильную УДХК. Однако соотношение глициновых (¾) и тауриновых (¼) конъюгатов УДХК при этом остается в пользу первых. Это сохраняет возможность протонирования и проникновения глициновых (но не тауриновых) конъюгатов УДХК в мелкие БЭК через «дырявый» билиарный бикарбонатный «зонтик» в той же степени, что и первичных желчных кислот при закислении печеночной желчи, происходящем у пациентов с ПБХ [4, 27]. Слабощелочное рН внутри мелких БЭК приводит к депротонированию (что замедляет их выход из холангиоцитов) и накоплению желчных кислот, включая УДХК, в холангиоцитах. Внутриклеточное накопление глициновых конъюгатов УДХК является предпосылкой для их цитотоксических (детергентных) эффектов [27]. Однако из-за гидрофильных свойств УДХК ее детергентные (токсичные, повреждающие) свойства меньше, чем у первичных желчных кислот, что и приводит к положительному терапевтическому эффекту.
При этом тауриновые конъюгаты УДХК остаются в депротонированном состоянии и не преодолевают билиарный бикарбонатный «зонтик» [4]. И так как тауриновые конъюгаты УДХК, имеющие низкие рКа, находятся в печеночной желчи в депротонированном состоянии, то даже при кислом рН печеночной желчи при ПБХ они не будут проникать внутрь БЭК и не будут оказывать повреждающее на холангиоциты действие. Но тауриновых конъюгатов УДХК в печеночной желчи в три раза меньше, чем глициновых конъюгатов. Исходя из этих представлений для более эффективной приостановки прогрессирования ПБХ необходимо увеличить поступление тауриновых конъюгатов желчных кислот в печеночную желчь. Достичь этого можно посредством замещения глициновых конъюгатов в печеночной желчи на тауриновые. Или для уменьшения поступления глициновых конъюгатов желчных кислот в БЭК необходимо добиться защелачивания печеночной желчи. Последнее в настоящее время невозможно из-за отсутствия соответствующих механизмов и препаратов.
Применение ТУДХК и ее метаболизм при ПБХ
Вышеупомянутые фундаментальные и клинические исследования показывают, что ионизированные (депротонированные, имеющие отрицательный заряд) тауриновые конъюгаты желчных кислот не способны преодолевать билиарный бикарбонатный «зонтик» и проникать в холангиоциты [34, 38–40]. Эти данные позволили предположить потенциальную возможность использования ТУДХК для лечения холестатических заболеваний печени [41, 42].
Несмотря на то, что УДХК стала признанным препаратом в гепатологии, были проведены исследования с ее тауриновым конъюгатом – ТУДХК, которая представляет собой естественный компонент желчи человека, но в очень малых количествах. У пациентов с ПБХ ТУДХК применяли в дозах 500, 1000 и 1500 мг в сутки [43]. Не было выявлено существенной разницы между тремя дозами [43]. При приеме ТУДХК значительно улучшаются сывороточные показатели печеночных ферментов, связанных с холестазом и цитолизом, и возникают благоприятные изменения в составе желчных кислот в желчи. Во время приема препарата печеночная желчь обогащается ТУДХК, что указывает на замещение первичных желчных кислот. Показано, что низкая доза (500 мг) ТУДХК была достаточной для достижения удовлетворительного обогащения желчи тауриновыми конъюгатами УДХК и улучшения биохимических показателей [43]. Проведенные исследования с подобными результатами позволяют предположить, что целесообразной является ежедневная доза около 10 мг/кг массы тела в сутки [43, 44]. Также прием ТУДХК способствует сохранению клинико-функциональной стабильности в период ожидания пациентами с ПБХ трансплантации печени в терминальной стадии [44]. При этом прием неконъюгированной УДХК в терминальной стадии ПБХ такими свойствами не обладает.
Механизм положительного эффекта ТУДХК у пациентов с ПБХ достигается благодаря ее низкой константе диссоциации (pKa 1,5–2). В результате ТУДХК находится в ионизированном (депротонированном) состоянии в закисленной печеночной желчи при ПБХ. Депротонированное состояние позволяет ей включаться в энтерогепатическую циркуляцию и замещать большую часть конъюгированных с глицином первичных желчных кислот на тауроурсодезоксихолат. Это приводит к значительному снижению количества глициновых конъюгатов первичных желчных кислот наряду со значительным возрастанием в печеночной желчи ТУДХК. Однако полного замещения глициновых конъюгатов на тауриновые, к сожалению, не происходит, и достичь этого невозможно. Тем не менее даже неполное замещение глициновых конъюгатов желчных кислот на тауриновые значительно уменьшает поступление и повреждающее действие первых на холангиоциты, а в стадию развернутого холестаза и на гепатоциты. Исходя из патогенетических механизмов, ТУДХК должна способствовать более существенной приостановке прогрессирования ПБХ, чем при приеме неконъюгированной УДХК. Замедление скорости прогрессирования ПБХ будет зависеть от количества замещенных глициновых конъюгатов и от стадии заболевания.
У больных ПБХ выявляется снижение глицин/тауринового коэффициента, что можно рассматривать как компенсаторную реакцию организма, которая направлена на поддержание желчных кислот в депротонированном состоянии [45–48]. Требуется проведение дальнейших многоцентровых с длительным приемом препарата исследований по определению эффективности применения ТУДХК. Применение препарата ТУДХК в асимптоматической и на ранних стадиях заболевания должно быть особенно эффективно.
При положительном ответе пациентов на пероральный прием УДХК, ТУДХК и хорошей переносимости препаратов терапию следует продолжать пожизненно.
Применение обетихолевой кислоты при ПБХ
Хотя лечение УДХК у большинства пациентов показывает хороший клинический результат, остаются примерно 30–40% больных с ПБХ, которые адекватно не реагируют на терапию, что сопровождается высоким риском прогрессирования заболевания и серьезных осложнений [49]. Эффективными для лечения пациентов с холестатическими заболеваниями печени, не отвечающими адекватно на УДХК, считаются препараты, являющиеся агонистами фарнезоид-Х-рецепторов и рецепторов, активируемых пероксисомными пролифераторами [25]. В связи с этим в настоящее время изучается обетихолевая кислота (ОХК) в качестве терапии у пациентов с ПБХ, которые не отвечают на лечение УДХК [50]. В этих случаях лечение продолжают в комбинации УДХК с ОХК. ОХК в 2016 г. была одобрена Управлением по контролю за продуктами и лекарствами (FDA) США и в 2017 г. Европейским агентством по лекарственным средствам (EMA) [49, 51, 52] и лицензирована в качестве терапии второй линии для применения у пациентов с ПБХ, не имеющих адекватного ответа на УДХК, или в качестве монотерапии у взрослых, не переносящих УДХК [49, 51, 52]. Основанием для одобрения послужило снижение уровня щелочной фосфатазы, которая является одним из биомаркеров ПБХ, что свидетельствует о клиническом улучшении [52].
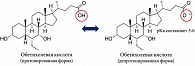
ОХК – это полусинтетическое производное хенодезоксихолевой желчной кислоты, известное также как 6α-этил-хенодезоксихолевая кислота, которая обладает сильным сродством к ядерному фарнезоид-Х-рецептору (FXR) (рис. 2) [53]. OХК, являясь мощным селективным агонистом FXR, обладает выраженными свойствами подавления синтеза желчных кислот при холестатических заболеваниях печени через транскрипцию гена CYP7A1 [54]. Одновременно с угнетением синтеза желчных кислот ОХК через FXR индуцирует экспрессию белка-насоса для экспорта желчных кислот (Bile Salt Export Pump, BSEP), который отвечает за выведение желчных кислот из гепатоцита [3, 54]. В результате происходит защита печеночных клеток от накопления и токсического (детергентного) действия желчных кислот [55].
Клинические исследования препаратов OХК при ПБХ свидетельствуют о хорошей переносимости и значительном улучшении биохимических показателей печени, связанных с холестазом [49, 52]. Результаты рандомизированного двойного слепого исследования третьей фазы, в котором ОХК (5 или 10 мг) сравнивали с плацебо, показали, что примерно у 50% пациентов было достигнуто значительное снижение уровня щелочной фосфатазы в сыворотке крови – маркера, предсказывающего прогрессирование заболевания при ПБХ [49]. Кожный зуд был наиболее распространенным нежелательным явлением у пациентов с ПБХ и зависел от дозы ОХК [51]. По данным X. Li и соавт. [51], в группе комбинированной терапии кожный зуд встречался чаще (61,3%), чем в группе монотерапии (42,3%). У пациентов с ПБХ доза ОХК 5 мг в сутки является более эффективной, чем дозы ОХК 10 мг (р = 0,001), 25 мг (р = 0,06) и 50 мг (р = 0,04), с наименьшим риском возникновения побочных эффектов [52].
Метаболизм обетихолевой кислоты при пероральном приеме пациентами с ПБХ
ОХК в тонком кишечнике захватывается энтероцитами и далее переправляется с венозной кровью воротной вены в гепатоциты, где подвергается конъюгированию с глицином (¾) и таурином (¼) в таком же соотношении, как и первичные желчные кислоты. Механизм действия ОХК заключается в подавлении синтеза первичных желчных кислот через FXR, что сопровождается уменьшением их количества в гепатоцитах и печеночной желчи, а также вследствие замещения первичных желчных кислот на обетихолевую кислоту. Индукция экспрессии белков-транспортеров желчных кислот на мембране гепатоцитов приводит к уменьшению содержания желчных кислот в печеночных клетках, что очень важно для предотвращения их повреждающего действия на мембранные структуры гепатоцитов. В то же время на фоне приема ОХК и повышенного поступления желчных кислот в печеночную желчь происходит увеличение заброса желчных кислот в общий кровоток в связи с наличием дуктулопении и внутрипеченочного холестаза при ПБХ. И чем более выражен холестаз, тем больше заброс ОХК в общий кровоток и выше вероятность развития нежелательного побочного эффекта – кожного зуда. Поступление в общий кровоток повышенного количества ОХК приводит к тому, что в процесс ее выведения из организма включаются почки и кожа. ОХК при попадании на нервные окончания вследствие своих сильных детергентных (на липидные компоненты миелиновой оболочки нервных волокон) и раздражающих свойств вызывает усиление кожного зуда, что и имеет дозозависимый эффект [51, 52].
Несмотря на уменьшение накопления и повреждающее действие желчных кислот на гепатоциты, прием ОХК не уменьшает токсического, повреждающего действия на холангиоциты, что связано с ее метаболизмом. Преобладающие глициновые конъюгаты первичных желчных кислот и ОХК в закисленной печеночной желчи больных ПБХ подвергаются протонированию (рис. 2), что способствует преодолению билиарного бикарбонатного «зонтика» глициновыми конъюгатами ОХК и попаданию их в холангиоциты. Происходит накопление и повреждающее действие глициновых конъюгатов первичных желчных кислот и ОХК на холангиоциты в связи с изменением рН печеночной желчи в кислую область и защелачиванием цитозоля БЭК у пациентов с ПБХ. ОХК не рекомендуется назначать пациентам с далеко зашедшей стадией ПБХ [51, 52].
На основании различных механизмов действия УДХК и ОХК рекомендована комбинированная терапия с использованием обоих препаратов при рефрактерном ПБХ. Комбинированное применение УДХК и ОХК приводит к положительному терапевтическому эффекту вследствие подавления синтеза первичных желчных кислот обетихолевой кислотой и замещения токсичных гидрофобных первичных желчных кислот на более гидрофильную и менее токсичную для холангиоцитов и гепатоцитов УДХК.
Исходя из описанных механизмов действия препаратов желчных кислот, более эффективным должно быть применение комбинации ТУДХК и ОХК. Применение ОХК в комбинации с тауроурсодезоксихолатом может стать жизненно важным средством фармакотерапии для пациентов с ПБХ [51].
Повысить терапевтическую эффективность ОХК, вероятно, можно за счет ее конъюгирования с таурином (амидирование боковой цепи ОХК) и сульфатирования у третьего углеродного атома циклопентанпергидрофенантренового кольца, что будет способствовать уменьшению ее токсических свойств, повышению растворимости в воде и выведению из организма с мочой [56, 57].
Применение норУДХК при холестатических заболеваниях
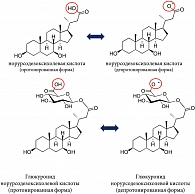
В качестве альтернативы УДХК или для одновременного применения с ней описано применение норУДХК для лечения ряда холестатических заболеваний печени и желчевыводящих путей [58]. НорУДХК представляет собой производное (гомолог) УДХК с укороченной (отсутствует одна метильная группа) боковой цепью, обладающее относительной устойчивостью к конъюгации боковой цепи с глицином или таурином (амидированию) (рис. 3) [59].
Нордигидроксижелчные кислоты, такие как норУДХК, выделяются в желчь частично в неизмененном виде, а частично – в виде глюкуронида или сульфатконъюгата [59, 60]. У человека большая часть норУДХК подвергается в гепатоцитах конъюгации боковой цепи с глюкуроновой кислотой, а не амидированию с глицином или таурином [61].
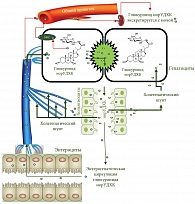
Вследствие глюкуронирования, а не амидирования боковой цепи норУДХК приобретает уникальные физиологические и фармакологические свойства: она способна подвергаться холегепатическому шунтированию вместо полного энтерогепатического цикла (рис. 4) [61–63].
В результате глюкуронирования боковой цепи отмечается значительная почечная элиминация глюкуронида С-23 эфира норУДХК [61]. Почечная экскреция, вероятно, является результатом выведения сложного эфира глюкуронида норУДХК из гепатоцита в плазму крови через базолатеральную мембрану с использованием MRP-транспортеров в печеночных клетках, которые осуществляют АТФ-зависимый экспорт желчных кислот через базолатеральную мембрану (рис. 4) [64].
НорУДХК считается гипержелчегонной желчной кислотой из-за холегепатического шунтирования [61, 65]. По результатам исследований на животных было показано, что физико-химические свойства молекулы эфира глюкуронида норУДХК способствуют осуществлению желчепеченочного (холегепатического) шунтирования, что приводит к ее постоянному потоку через БЭК желчных протоков, и это может иметь терапевтическое значение [61]. Считается, что благодаря своим гидрофильным свойствам, глюкуронированию боковой цепи и относительной устойчивости к конъюгированию с глицином и таурином норУДХК является перспективным фармакологическим препаратом для лечения целого ряда холестатических заболеваний печени и желчевыводящих путей. НорУДХК была успешно протестирована в клинических условиях у пациентов с первичным склерозирующим холангитом [58]. Проведено двойное слепое рандомизированное многоцентровое плацебо-контролируемое сравнительное исследование фазы III по пероральному применению норУДХК в дозе 1500 мг/сут. для лечения первичного склерозирующего холангита.
Применение норУДХК привело к дозозависимому снижению уровня щелочной фосфотазы и других печеночных ферментов в сыворотке крови после 12 недель лечения [66]. НорУДХК была эффективна как у пациентов, ранее принимавших УДХК (независимо от того, отвечали они на терапию УДХК или нет), так и у пациентов, не принимавших ранее УДХК [66, 67]. Переносимость препарата, по данным авторов, была хорошей, а количество нежелательных явлений, связанных с лечением, было одинаковым во всех группах [58, 66].
Метаболизм норУДХК при пероральном приеме
Механизм действия, опосредующий благоприятные эффекты норУДХК, остается предметом продолжающихся исследований [68, 69]. U. Beuers и соавт. высказывают предположение, что скорее всего норУДХК, проходя через холангиоциты, стимулирует секрецию бикарбоната БЭК для поддержания защитного билиарного бикарбонатного «зонтика» [70]. Однако данное высказывание не подтверждается экспериментальными исследованиями [71]. G.U. Denk и соавт. [71] показали, что применение норУДХК оказывает желчегонное действие только в нормальной изолированной перфузированной печени крысы, а в экспериментальной модели индуцированного холестаза не оказывает антихолестатического действия. А вот тауриновый конъюгат норУДХК (ТнорУДХК) был эффективен, хотя и уступал тауриновому конъюгату УДХК [71].
Косвенно эти данные указывают на другой механизм действия норУДХК. Физико-химические свойства норУДХК позволяют представить следующий механизм ее метаболизма. После всасывания в кишечнике норУДХК попадает через систему воротной вены в печень, где захватывается гепатоцитами. В печеночных клетках происходит глюкуронирование боковой цепи норУДХК (с образованием глюкуронидов норУДХК), что придает ей свойства очень слабой кислоты, и, попадая в печеночную желчь, норУДХК протонируется и, легко преодолевая билиарный бикарбонатный «зонтик», поступает в холангиоциты. При нормальном рН цитозоля БЭК она выводится в перибилиарное пространство и, попадая в кровь, транспортируется в гепатоциты и общий кровоток (рис. 4). Та часть глюкуронидов норУДХК, которая попала в печеночные клетки, снова включается в холегепатическую циркуляцию и частично за счет эфлюкса поступает в общий кровоток [64]. И лишь незначительная часть глюкуронидов норУДХК включается в энтерогепатическую циркуляцию. Происходит частичное замещение первичных желчных кислот на глюкуронид норУДХК, которая обладает меньшим токсическим действием на гепатоциты и БЭК за счет образования эфиров с глюкуроновой кислотой. Та часть глюкуронидов норУДХК, которая поступает в общий кровоток, благодаря наличию в молекуле глюкуроновой кислоты легко выводится из организма почками [61]. Вероятнее всего этот механизм и лежит в основе положительного эффекта норУДХК, полученного при применении у пациентов с первичным склерозирующим холангитом [58].
Однако при ПБХ нарушается поступление бикарбоната в желчные протоки, происходит закисление печеночной желчи и защелачивание рН внутри холангиоцитов. Это может приводить к тому, что глюкурониды норУДХК будут очень легко протонироваться (из-за закисления рН печеночной желчи) и, преодолевая билиарный бикарбонатный «зонтик», поступать в холангиоциты. Так как внутри БЭК при ПБХ происходит защелачивание цитозоля, то глюкурониды норУДХК могут частично депротонироваться и их выход в перибилиарное пространство ухудшится. Это приведет к задержке и накоплению глюкуронидов норУДХК в холангиоцитах с последующим повреждающим действием, хотя и в меньшей степени, чем первичные желчные кислоты, вследствие своей гидрофильности и глюкуронирования боковой цепи. Вероятно, именно этим механизмом можно объяснить отсутствие антихолестатического эффекта в экспериментальной модели индуцированного холестаза [71]. При этом G.U. Denk и соавт. [71] показали, что для достижения антихолестатического эффекта необходима конъюгация норУДХК с таурином. Эти данные также укладываются в концепцию влияния рН печеночной желчи на метаболизм глициновых и тауриновых конъюгатов желчных кислот в зависимости от того, сильной или слабой кислотой является конъюгат. Тауриновые конъюгаты норУДХК являются сильной кислотой, и они не будут протонироваться в печеночной желчи, поступать в БЭК, участвовать в холегепатической циркуляции. При этом ТнорУДХК будет участвовать в энтерогепатической циркуляции и будет замещать первичные желчные кислоты. Это может быть объяснением полученного G.U. Denk и соавт. [71] результата эффективности ТнорУДХК подобного тауриновому конъюгату УДХК.
Можно также повысить терапевтическую эффективность и ТнорУДХК посредством сульфатирования или глюкуронирования третьего углеродного атома циклопентанпергидрофенантренового кольца, что должно снизить ее токсические свойства, повысить растворимость в воде и выведение из организма с мочой [56, 57, 61].
Заключение
Лечение ПБХ остается сложной задачей, так как не определена причина, вызывающая это хроническое, медленно прогрессирующее холестатическое заболевание печени. Успехи в использовании гидрофильных желчных кислот для лечения ПБХ связаны с прогрессом в изучении физико-химических свойств желчных кислот и раскрытии патогенетических механизмов развития повреждения холангиоцитов и появления первых признаков этого заболевания. Применение препаратов желчных кислот (УДХК, ТУДХК, ОХК, норУДХК) для лечения ПБХ привело к замедлению прогрессирования заболевания и улучшению качества жизни этих пациентов. К сожалению, лечение ПБХ препаратами желчных кислот не сопровождается полным излечением заболевания.
Раскрытие механизмов, лежащих в основе положительного терапевтического эффекта этих препаратов и описанных в этом обзоре, показывает ограниченность эффективности препаратов желчных кислот. Поэтому существует острая необходимость в разработке новых, более эффективных препаратов и методов лечения этого холестатического заболевания. При этом при разработке новых препаратов должны учитываться данные по механизму развития начальных признаков ПБХ, по метаболизму различных форм и конъюгатов гидрофильных желчных кислот, используемых для лечения этого заболевания, а также и новые мишени, раскрытые при более глубоком изучении патофизиологии заболевания [4, 72]. Исходя из изложенных в обзоре механизмов положительных эффектов препаратов гидрофильных желчных кислот, с целью повышения эффективности и получения меньшего количества побочных эффектов необходимо разрабатывать новые препараты, содержащие в боковой цепи тауриновые конъюгаты желчных кислот, а также содержащие глюкуроновую кислоту или сульфогруппу у третьего углеродного атома циклопентанпергидрофенантренового кольца. Тауриновые конъюгаты будут поддерживать депротонированную форму желчных кислот в закисленной печеночной желчи пациентов с ПБХ, а сульфогруппа или глюкуроновая кислота – способствовать уменьшению токсических свойств, повышению растворимости в водной среде и выведению из организма через почки. При этом всасывание в кишечнике таких препаратов уменьшится, что необходимо будет учитывать при подборе дозировки препарата. Такие препараты должны лучше купировать симптомы и оказывать дальнейшее сдерживание прогрессирования ПБХ. Разработку этих препаратов и проведение экспериментальных и многоцентровых исследований можно ожидать в ближайшее время.
После 35 лет использования УДХК как уникального средства выбора для пациентов с ПБХ были определены ряд мишеней, основанных на более глубоком знании патофизиологии заболевания. Речь идет об открытии нарушения механизмов образования бикарбоната холангиоцитами при ПБХ вследствие снижения активности изоформы 3 инозитол-1,4,5-трисфосфатного рецептора и хлор/бикарбонатного анионообменника 2, вызванного повышением активности miR-506. Это может послужить основанием для разработки в будущем новых препаратов, направленных на локальное снижение активности miR-506 или активацию АЕ2 анионообменника в холангиоцитах. Вероятно, это будет одним из новых терапевтических подходов в лечении ПБХ в дополнение или для замены имеющихся способов применения гидрофильных желчных кислот.
V.I. Reshetnyak, PhD, Prof., I.V. Maev, PhD, Prof., Academician of the RAS
Russian University of Medicine, Moscow
Contact person: Vasiliy I. Reshetnyak, vasiliy.reshetnyak@yandex.ru
A comprehensive understanding of the aetiological and pathogenetic mechanisms underlying the development of any given disease is essential for the effective treatment of that disease. The aetiology of primary biliary cholangitis (PBC), a chronic, slowly progressive cholestatic liver disease, remains unknown. An understanding of the physicochemical properties of various bile acids and the adaptive responses of cholangiocytes and hepatocytes to them have provided an important basis for the development of relatively effective bile acid-based drugs that can potentially slow disease progression. Advances in the use of hydrophilic bile acids for the treatment of PBC are also associated with the discovery of pathogenetic mechanisms of the development of cholangiocyte damage and the appearance of the first signs of this disease. For 35 years, ursodeoxycholic acid (UDCA) has been a unique agent of choice for the treatment of patients with PBC. In recent years, there has been an expansion in the list of hydrophilic bile acids that are used to treat cholestatic liver disease, including PBC. In addition to UDCA, the potential use of obeticholic acid (OCA), tauroursodeoxycholic acid (TUDCA) and norursodeoxycholic acid (norUDCA) as pharmaceutical agents is also considered. The review presents a discussion of the pathogenetic rationale for the treatment of PBC with various bile acid preparations. Emphasis is placed on the mechanisms explaining the positive therapeutic effects and potentialities of each of the bile acids as a drug based on the understanding of the pathogenesis of the initial stages of PBC.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.