Нутриционная поддержка при постколрезекционном (постколэктомическом) синдроме: что нового?
- Аннотация
- Статья
- Ссылки
- English

![Рис. 1. Органеллы гепатоцита [3]](/upload/resize_cache/iblock/86d/195_350_1/4_2.jpg)




С развитием хирургической науки и анестезиологии процент выживаемости после обширных резекций кишечника существенно возрос. Однако в зависимости от объема и уровня вмешательства усугубились и последствия. Состояния после таких операций требуют длительной коррекции, иногда в течение всей жизни. Сказанное относится к обширным резекциям толстой кишки [1].
Как правило, причинами, приводящими к обширным резекциям кишечника, являются тромбоз сосудов брыжейки, онкопатология, воспалительные заболевания кишечника неустановленной этиологии (болезнь Крона, язвенный колит), травмы кишечника (отрыв брыжейки) и др. На клинику нутриционной недостаточности накладывает отпечаток и характер оперативного вмешательства, в результате которого изменяются анатомо-функциональные взаимоотношения различных отделов кишечника. К настоящему времени достаточно хорошо изучены основные функциональные особенности разных отделов толстой кишки:
- поперечно-ободочная кишка отвечает за транспорт кишечного содержимого, участвует в регуляции водно-электролитного обмена;
- левая половина толстой кишки выполняет резервуарную (накопительную) функцию, в результате левосторонней гемиколэктомии отмечаются нарушения моторики, в основном в виде запоров;
- правая половина толстой кишки достаточно активна в физиологическом плане, правосторонняя гемиколэктомия сопровождается высокой двигательной активностью кишечной мускулатуры (диарея) и желчных путей.
Обычно удаление всей ободочной кишки характеризуется такими клиническими признаками, как плохо компенсируемые нарушения водно-электролитного и белково-энергетического баланса, выпадение функций регуляторных гормонов (энтероглюкагона, пептида YY, нейротензина, частично мотилина – Мо-клетки).
Клинически обширные резекции толстой кишки проявляются выраженной сухостью кожных покровов, умеренной жаждой, торможением психических процессов (симптомы дефицита водных разделов), урчанием и болями в животе, снижением аппетита, жидким стулом с повышенным содержанием газов (зависит не только от дисбактериоза), непереносимостью ряда пищевых продуктов, зловонным стулом с примесью непереваренных компонентов (симптомы дисфункции поджелудочной железы), дефицитом массы тела, натрия, общего белка и альбумина, астенией, непостоянными отеками и анемией (показатели белково-энергетической недостаточности), уменьшением уровней натрия, общего белка и альбумина плазмы, остаточными явлениями проктита, выделением крови, слизи и гноя из культи прямой кишки (симптомы прогрессирования основного заболевания).
Нами изучена активность микробиоты в различные сроки при постколрезекционном синдроме. Дисбиотические явления разнообразны и зависят от того, какой отдел кишечника удален.
Основные функции кишечной микрофлоры:
- обеспечение антиинфекционной защиты. Антиинфекционная защита во многом связана с антагонизмом представителей нормальной микрофлоры по отношению к другим микробам. Осуществляется за счет различных механизмов: конкуренция за субстраты для роста, конкуренция за места фиксации, индукция иммунного ответа макроорганизма, синтез антибиотикоподобных веществ, стимуляция перистальтики, модификация/деконъюгация желчных кислот и др.;
- стимуляция иммунных функций макроорганизма;
- синтез короткоцепочечных жирных кислот. В частности, бутират регулирует апоптоз, процессы дифференцировки и пролиферации, с ним связывают антиканцерогенные эффекты; непосредственно участвует в процессах всасывания воды, натрия, хлора, кальция и магния;
- синтез витаминов групп В и К. Полипептидные гормоны: секретин, холецистокинин-панкреозимин, гастрин, мотилин, энкефалин, нейротензин и другие – образуются в желудочно-кишечном тракте;
- дезинтоксикация (аммиак переходит в аммоний, излишек билирубина – в уробилиноген);
- участие (наряду с печенью) в процессах энтерогепатической циркуляции желчных кислот;
- регуляция липидного обмена (микробы метаболизируют холестерин, поступающий в толстую кишку, в копростанол, затем – в копростанон, а образовавшиеся ацетат и пропионат, попав в кровь и достигнув печени, влияют на синтез холестерина: ацетат стимулирует его, пропионат, наоборот, тормозит);
- участие в обмене желчных кислот, в азотистом обмене и т.д.
Все перечисленные факторы позволили выделить степени выраженности постколэктомического синдрома (ПКЭС) [2] (табл. 1). Как видно из табл. 1, при I и II степени выраженности ПКЭС отмечаются нарушения обмена веществ с развитием нутриционной недостаточности различного уровня, что показали результаты исследования, проведенного в Центральном НИИ гастроэнтерологии.
Одна из причин, приводящих к обменным нарушениям, – расстройства энтерогепатической циркуляции при ПКЭС.
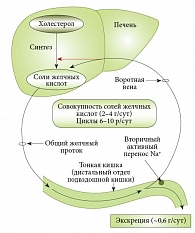
В печеночной клетке с участием эндоплазматического ретикулума (рис. 1) [3] синтезируются первичные желчные кислоты, которые впоследствии конъюгируют с аминокислотами (преимущественно таурином и глицином).
В кишечнике образуются вторичные желчные кислоты, которые за счет энтерогепатической циркуляции (рис. 2 и 3) снова поступают в печень, где трансформируются в третичные желчные кислоты. Одна из основных третичных желчных кислот – урсодезоксихолевая кислота (УДХК). Основные терапевтические эффекты УДХК [4]:
- холеретический:
элиминация пула токсичных гидрофобных желчных кислот вследствие конкурентного вытеснения их с рецепторов в подвздошной кишке;
стимуляция экзоцитоза в гепатоцитах путем активации Са-зависимой альфа-протеинкиназы, снижающей концентрацию гидрофобных желчных кислот;
индукция бикарбонатного холереза, усиливающая выведение гидрофобных желчных кислот в кишечник;
- цитопротективный – встраивание УДХК в фосфолипидный слой клеточной мембраны и, как следствие, стабилизация последней и повышение устойчивости к повреждающим факторам;
- антиапоптотический – снижение концентрации ионизированного кальция в клетках, предотвращающее выход цитохрома С из митохондрий и блокирующее активацию каспаз и апоптоз холангиоцитов;
- иммуномодулирующий:
уменьшение экспрессии молекул HLA I класса на гепатоцитах и HLA II класса на холангиоцитах;
снижение продукции провоспалительных цитокинов;
- гипохолестеринемический – снижение всасывания холестерина в кишечнике, синтеза холестерина в печени и его экскреции в желчь;
- литолитический:
снижение литогенности желчи в результате формирования жидких кристаллов с молекулами холестерина.
При ПКЭС вторичные желчные кислоты не образуются либо образуются в недостаточном количестве (из-за резекции части кишки). Как следствие – недостаточное образование третичных желчных кислот, в частности УДХК.
Кроме того, из-за отсутствия части толстой кишки недостаточно активна толстокишечная микробиота, которая также выполняет ряд важных функций. Так, известны внутрипросветные эффекты короткоцепочечных жирных кислот (КЦЖК). КЦЖК – это продукт метаболизма кишечной микробиоты. Бутират, синтезируемый микроорганизмами, является основным источником энергии для эпителия толстого кишечника, даже когда другие энергетические субстраты – глюкоза и глутамин – присутствуют в достаточном количестве. Описано влияние КЦЖК на толстокишечный кровоток и гладкомышечную активность кишечника. Хорошо изучены трофические эффекты КЦЖК и поддержание нормального клеточного фенотипа колоноцитов, главным образом бутирата и пропионата. Микробиота участвует в расщеплении неперевариваемых полисахаридов и частично в гидролизе других питательных веществ и т.д.
Перечисленные эффекты имеют значение для нормального функционирования всего желудочно-кишечного тракта, а не только толстой кишки.
Таким образом, существует два основных механизма развития эндотоксикоза вследствие кишечной и гепатической дисфункции при ПКЭС и постколрезекционном синдроме. Во-первых, из-за снижения рН при образовании КЦЖК аммиак в толстой кишке при микробном преобразовании белков и аминокислот переходит в ионы аммония, которые не могут свободно проникать сквозь кишечную стенку в кровь, а выводятся в виде аммонийных солей с калом (при ПКЭС этот эффект отсутствует или существенно снижен). Во-вторых, механизм дезинтоксикации, связанный с микрофлорой толстой кишки, обусловлен преобразованием билирубина в уробилиноген, который частично всасывается и экскретируется с мочой, а частично выводится с калом (при ПКЭС и этот механизм нарушается).
Вынужденное выпадение функций толстой кишки или ее части вызывает нутриционные расстройства, которые после операции постепенно нивелируются благодаря компенсаторным возможностям органов, лимитирующих усвоение. Однако зачастую требуется серьезная коррекция. Это зависит главным образом от функционального резерва (ФР) кишечника (его остаточной культи) и ФР основного синтезирующего органа – печени. Как правило, ФР кишечника (определяемый по цитруллину) практически восстанавливался в течение 6 месяцев после операции у 78% больных, перенесших обширную резекцию на толстой кишке, снижался или резко снижался – у 22%. Что касается функциональных изменений печени, наблюдавшихся по данным ультразвукового ангиосканирования и верифицированных по шкале М.Д. Дибирова и В.С. Акопян (2008) [5], в первые полгода отмечалась легкая степень печеночной дисфункции (2–3 балла) у 88,2%, средняя степень (4–6 баллов) – у 11,8%. При сохраненном или частично угнетенном ФР кишечника и печени адаптируемость культи развивалась у 85% больных к полутора годам после операции. При резко сниженном или отсутствовавшем ФР могла развиться фаза декомпенсации в 6-месячный период после операции.
Для профилактики развития последствий ПКЭС или снижения их активности, повышения качества жизни пациентов в целях нутриционного лечения и синдромной коррекции метаболических нарушений, определенных на основе алиментационно-волемического диагноза [6] (табл. 2), в качестве фармаконутрицевтика следует использовать источник УДХК, в частности препарат Урдокса.
При осуществлении нутриционной поддержки с применением Урдоксы синдрома эндотоксикоза не возникало, ФР печени был удовлетворительным, характер и макроскопическая характеристика стула в отдаленном периоде после операции также имели тенденцию к нормализации (табл. 3).
Следовательно, кроме традиционного применения [7–11] Урдоксу целесообразно использовать при последствиях обширных резекций толстой кишки и сочетанных тонко-толстокишечных резекций (табл. 4).
На сегодняшний день последствия колэктомии (постколэктомическая трансформация, стриктуры, колонизация и др.) нельзя скорректировать только с помощью хирургического вмешательства. Необходимо применять и поливалентную терапию, одним из компонентов которой является нутриционное лечение. Нутриционную поддержку следует назначать на основании синдромного подхода, учитывающего функциональные возможности кишечной культи (том числе ее резервуарных конструкций). Выбирая состав для нутриционной поддержки, важно обращать внимание на состояние микробиоты в толстокишечной культе, корригируя ее активность, например, пребиотиками; на ФР кишечника и печени. При установлении алиментационно-волемического диагноза (фактически определение маркеров метаболического риска) в ряде случаев удается не только уточнить объем оперативного вмешательства (мини- или расширенный), но и определить наиболее рациональную тактику нутриционной коррекции.
В целях прогнозирования метаболического риска необходимо:
- охарактеризовать исходный нутриционный статус;
- установить сопутствующую или сочетанную общесоматическую патологию (консультация терапевта);
- выявить эндокринные нарушения (консультация эндокринолога);
- оценить состояние органов пищеварения (консультация гастроэнтеролога);
- определить ФР органов, лимитирующих усвоение нутриентов, и исключить наличие генетических дефектов (консультация нутрициолога, клинического физиолога);
- выбрать рациональный способ оперативного лечения и объем превентивной, в том числе нутриционной, коррекции (витамины, микробиота, желчные кислоты, энзимы, микро- и макроэлементы) и подготовить рекомендации для восстановительного периода.
Nutritional support for postcolectomy syndrome: what’s new?
L.N. Kostyuchenko
Central Scientific Reseach Institute of Gastroenterology, Moscow
Contact person: Lyudmila Nikolayevna Kostyuchenko, aprilbird2@yandex.ru
Currently, surgical methods of correction of colectomy complications (e.g. postcolectomy transformation, strictures and colonization) should be supplemented with multidirectional drug therapy and nutritional support. Syndrome-based nutritional therapy should consider the functional characteristics of intestinal stump (including pouch constructions). The author substantiates the need for pharmaconutriceuticals – regulators of the gut’s microbiota, bile acids (Urdoxa) and enzymes.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.