Противовирусные эффекты витамина D как фактор повышения сопротивляемости папилломавирусной инфекции и опухолевым заболеваниям шейки матки
- Аннотация
- Статья
- Ссылки
- English
Введение
Витамин D – комплексный регулятор врожденного и приобретенного иммунитета, поэтому недостаточность этого витамина снижает антибактериальный и противовирусный иммунитет, стимулирует развитие патологий, ассоциированных с хроническим системным воспалением (атопического дерматита, ревматоидного артрита, воспалительных заболеваний кишечника, аутоиммунных заболеваний щитовидной железы и сепсиса). Результаты фундаментальных и клинических исследований показали, что возникающие на фоне недостаточности витамина D хроническое воспаление и нарушения врожденного иммунитета значительно снижают резистентность организма к туберкулезу, хроническому бронхиту, вирусным заболеваниям (вирусному гепатиту, острому респираторному заболеванию, папилломавирусной инфекции) [1, 2]. Таким образом, обеспеченность витамином D может существенно влиять на иммунитет, в том числе на противовирусную защиту организма.
Противодействие инфекционным заболеваниям играет важную роль в акушерско-гинекологической практике. В частности, вирусные и бактериальные заболевания на фоне недостаточного уровня витамина D повышают риск развития опухолей эндометрия, яичников и шейки матки [3]. Кроме того, иммуномодулирующее, антипролиферативное, проапоптотическое, антиангиогенное, противовоспалительное и противоопухолевое действие витамина D, обнаруженное в фундаментальных и клинических исследованиях, – еще один аргумент в пользу назначения витамина D для профилактики и терапии различных «гинекологических» опухолей, в том числе рака шейки матки [4].
В настоящей статье последовательно рассмотрены молекулярные основы противовирусного действия витамина D, результаты фундаментальных и клинических исследований, указывающие на действие витамина D против вирусов гепатита, Эпштейна – Барр, папилломы человека (ВПЧ), респираторно-синцитиального вируса и др. Показана целесообразность применения витамина D в профилактике и терапии опухолевых заболеваний шейки матки.
О молекулярных механизмах противовирусного действия витамина D
Витамин-D-индуцированные механизмы, связанные с противовирусной активностью, включают корректировку врожденного иммунного ответа (интерфероны), повышение уровней кателицидина (LL-37) и дефенсина, а также активацию специфических противовирусных микроРНК. Витамин D усиливает эффект интерферона, уменьшая синтез вирусных белков в зараженных вирусами клетках. Например, при инфицировании гепатоцитов в культуре вирусом гепатита С воздействие витамина D в форме 1,25(OH)2D активирует гены, связанные с аутофагией вирусных частиц (рецептор 37 G-белков (GPR37), фактор, индуцируемый гипоксией 1-альфа (HIF-1-альфа), хемокиновый лиганд 20 (CCL20)), и подавляет интенсивность репликации вируса (рис. 1) [5].
Одна из основ противовирусного действия витамина D – повышение экспрессии антимикробных пептидов кателицидина и бета-дефенсина 2 [6], которые проявляют не только микробицидную, но и противогрибковую и противовирусную активность [7].
Антимикробный пептид кателицидин – неотъемлемый компонент витамин-D-зависимого врожденного антимикробного иммунитета. Антимикробные пептиды встраиваются в цитоплазматическую мембрану бактерий и белковые оболочки вирусов и, приводя к образованию пор, нарушают целостность бактерий и вирусов. Кроме того, проникая внутрь бактерий и вирусов, положительно заряженные антимикробные пептиды связываются с отрицательно заряженными ДНК и РНК, что также стимулирует гибель бактерий и вирусов.
Обработка моноцитов в культуре посредством биологически активной формы витамина D (1,25(OH)2D) дозозависимо повышала экспрессию мРНК антимикробного пептида кателицидина в 48–140 раз, причем увеличение экспрессии гена кателицидина коррелировало с повышенной экспрессией белка кателицидина [8]. В клиническом исследовании установлена корреляция между уровнями 25(OH)D и кателицидина в плазме крови (фактор корреляции 0,45, р = 0,05) [9]. Более высокая концентрация кателицидина в плазме существенно (в 3,7 раза) снижала риск смерти от инфекции у пациентов с диализом [10].
Витамин D повышает экспрессию определенных микроРНК, которые проявляют противовирусные и онкопротективные свойства. Напомним, что микроРНК представляют собой короткие специфические фрагменты РНК, которые ассоциируются с матричной РНК для синтеза того или иного белка и осуществляют тонкую настройку экспрессии этого белка. Иначе говоря, посредством микроРНК синтезируется столько молекул белка, сколько нужно для потребностей клетки. Как недостаточный, так и избыточный синтез белков может приводить к развитию опухолей.
Витамин D и активированные им микроРНК (в частности, miR-155 и miR-146) тормозят экспрессию целевых специфических белков, ассоциированных с формированием избыточного воспаления: толл-подобных рецепторов 2 и 4, фактора некроза опухоли альфа, интерлейкинов 1-бета и 6, транскрипционного фактора NF-kB, киназного комплекса IkB (IKK), супрессора сигналинга цитокинов 1 (SOCS1) [11]. Активная форма витамина 1,25(OH)2D потенцирует ингибирующее действие miR-130а при репликации вируса гепатита C [5], повышающего риск опухолевых процессов в печени в десятки раз. Фундаментальные исследования показали, что воздействие витамина D на иммунитет также осуществляется посредством регуляции деления Т-хелперных лимфоцитов, дифференцирования В-клеток, секреции интерферона и других цитокинов, что способствует снижению избыточного воспаления [1].
Витамин D против вирусного гепатита
25(OH)D подавляет продукцию вируса гепатита С. Клетки HuH-7 в культуре были инфицированы вирусом гепатита С в присутствии или в отсутствие витамина D. 25(OH)D дозозависимо уменьшал вне- и внутриклеточный уровни основного антигена вируса гепатита С. Ингибирующее действие 25(OH)D осуществлялось на стадии сборки инфицирующего вирусного комплекса [12].
25(OH)D подавляет репликацию вируса гепатита С и способствует более быстрому вирусологическому ответу организма. Выживаемость клеток и нагрузка вирусом наблюдались в линиях клеток Con1-1b и J6/JFH-2a в культуре, обработанных различными дозами 25(OH)D. Вирусная нагрузка клеток Con1-1b дозозависимо снижалась на 69, 80 и 86% после обработки 1, 5 и 10 мкМ 25(OH)D соответственно (р < 0,0001). В клетках линии J6/JFH-2a были получены схожие результаты: нагрузка вирусом снижалась на 12, 55 и 80,5% после обработки 1, 5 и 10 мкМ 25(OH)D соответственно (р < 0,0001) [13].
Пациенты с хроническим гепатитом B (n = 70) при более высоком уровне 25(OH)D лучше отвечали на лечение пегилированным интерфероном альфа. В частности, доля противовирусных CD3+- и CD4+-T-лимфоцитов и отношение CD4+/CD8+ значительно увеличивались (p < 0,05) по мере повышения уровня 25(OH)D. Титры вирусной ДНК достоверно снижались с увеличением содержания 25(OH)D в сыворотке (p < 0,05) [14].
При хроническом гепатите С первого генотипа низкая концентрация витамина D в сыворотке крови ассоциировалась с выраженным фиброзом печени и ухудшением отклика на стандартную терапию интерфероном и рибавирином. У пациентов, прошедших противовирусную терапию пегилированным интерфероном с рибавирином (n = 167), более низкий уровень 25(OH)D независимо коррелировал с повышенным риском некроза печени (p = 0,04) и тяжелой формой фиброза (стадии F3, F4) [15].
Дефицит витамина D повышает риск развития хронического гепатита С и ухудшает отклик на терапию интерфероном альфа. Метаанализ 11 клинических исследований показал, что уровень 25(OH)D в сыворотке был достоверно ниже у пациентов с вирусным гепатитом С (n = 1575, 1117 случаев гепатита) по сравнению с группой контроля. Среди пациентов с уровнем 25(OH)D в сыворотке выше 30 нг/мл в 1,57 раза достоверно чаще отмечался высокий клиренс вирусных частиц (отношение рисков (ОР) 1,57, 95%-ный доверительный интервал (ДИ) 1,12–2,2) [16].
Метаанализ 14 клинических исследований (n = 3755) подтвердил, что низкий уровень витамина D у пациентов с хроническим гепатитом С ассоциировался с более высокой вероятностью тяжелого фиброза печени и более низкими шансами на достижение устойчивого вирусологического ответа (при котором вирусная РНК не обнаруживается в крови через шесть месяцев после завершения противовирусной терапии) на фоне лечения пегилированным интерфероном и рибавирином. Недостаточность витамина D (25(OH)D < 30 нг/мл) ассоциировалась с более тяжелым фиброзом печени (ОР 2,22, 95% ДИ 1,24–3,97). При уровне 25(OH)D < 20 нг/мл шансы устойчивого вирусологического ответа снижались на 47% (ОР 0,53, 95% ДИ 0,31–0,91, р < 0,001) [17].
Как показал метаанализ семи рандомизированных контролируемых исследований (n = 548), адъювантная противовирусная терапия гепатита С более эффективна при добавлении витамина D. Использование витамина D в сочетании с инъекциями пегилированного интерферона альфа и пероральным приемом рибавирина в течение 24 недель повысило успех терапии на 30% (ОР 1,30, 95% ДИ 1,04–1,62) по сравнению с терапией без включения витамина D. В частности, отмечена эффективность адъювантной терапии у пациентов с гепатитом С генотипа 1, который, как известно, проявляет резистентность к противовирусной терапии [18] и отличается наибольшей частотой малигнизации.
В метаанализе 11 клинических исследований у большинства инфицированных вирусом гепатита С обнаруживался генотип 1 (1068/1575). Высокая частота устойчивого вирусологического ответа наблюдалась у лиц с 25(OH)D > 30 нг/мл (ОР 1,57, 95% ДИ 1,12–2,2), особенно у пациентов, получавших витамин D (ОР 4,59, 95% ДИ 1,67–12,63). Важно отметить, что противовирусный эффект витамина D не зависел от генотипа вируса гепатита С [16].
Витамин D против других вирусов
Респираторно-синцитиальная вирусная инфекция ослабляет противовирусную и противоопухолевую защиту организма путем негативного воздействия на метаболизм витамина D. При заражении клеток респираторно-синцитиальные вирусы уменьшают экспрессию рецептора витамина D (Vitamin D Receptor – VDR) и увеличивают экспрессию фермента 1-бета-гидроксилазы, которая инактивирует витамин D [19].
Витамин D способствует усилению противовирусной защиты бронхиальных эпителиальных клеток при участии противовирусного и антибактериального пептида кателицидина и активации сигнальных путей интерферона [20]. Поддерживая противовирусный иммунитет, витамин D также снижает вызываемую респираторно-синцитиальным вирусом активацию провоспалительного фактора NF-kB и соответствующих цитокинов в эпителии дыхательных путей. Витамин D индуцирует белок IkBa, ингибитор фактора NF-kB, и снижает вызываемую респираторно-синцитиальным вирусом активацию провоспалительных генов, управляемых NF-kB (интерферон бета, CXCL10 и др.). Ингибирование NF-kB посредством аденовирусных частиц, содержащих IkBa, имитировало эффекты витамина D. Таким образом, витамин D уменьшал воспалительную реакцию в ответ на вирусные инфекции, не снижая при этом противовирусного действия [21].
Метаанализ 25 рандомизированных исследований (n = 10 933), проведенный с использованием данных об индивидуальных пациентах, показал, что дотации витамина D способствовали снижению риска инфицирования острым респираторным заболеванием в среднем на 12% (ОР 0,88, 95% ДИ 0,81–0,96, p < 0,001). При анализе данных подгрупп установлено, что среди пациентов, имевших более одного эпизода острого респираторного заболевания в год, риск повторного заболевания снижался на 20% при приеме витамина D (ОР 0,80, 95% 0,69–0,93, p = 0,004) [22].
Активность ретровируса, ассоциированного с множественным склерозом (вирус Эпштейна – Барр), взаимосвязана с обеспеченностью витамином D пациентов с рецидивирующим рассеянным склерозом. В частности, установлена обратная корреляция между концентрацией ретровирусов и концентрацией 25(OH)D в сыворотке крови (p < 0,01) [23]. Напомним, что внутриутробное инфицирование плода вирусом Эпштейна – Барр ведет к множественным порокам развития и повышенному риску рождения ребенка с ДЦП.
Недостаточность витамина D (25(ОН)D < 30 нг/мл) при трансплантации почек – независимый фактор риска увеличения частоты оппортунистических вирусных инфекций (цитомегаловирусной инфекции и онкогенной полиомавирусной инфекции, которая стимулирует развитие опухолей различной локализации). Значительно более низкая частота оппортунистических вирусных инфекций отмечена в подгруппе с достаточным уровнем витамина D (12%) по сравнению с подгруппой с недостаточностью витамина D (38%, p < 0,01) [24].
Витамин D против вируса папилломы человека
Кожные и генитальные папилломы – дерматологические изменения кожи и слизистых, вызываемые ВПЧ. Иммунотерапия, включающая вакцинацию против ВПЧ (циметидин, левамизол), а также прием препаратов цинка и витамина D в настоящее время занимают значительное место в лечении бородавок из-за низкой встречаемости побочных эффектов, простоты использования и достаточной эффективности [25].
В клиническом исследовании ВПЧ-инфекция и цервикальная интраэпителиальная неоплазия ассоциировались с недостаточностью витамина D3 (p = 0,009). Учитывая доказанные противовоспалительные функции витамина D3, его недостаточность может быть возможной причиной персистенции ВПЧ-инфекции [26]. Титры антител для разных штаммов ВПЧ были значительно выше среди пациенток с более низким уровнем 25(OH)D (< 30 нг/мл) [27].
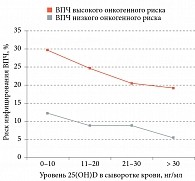
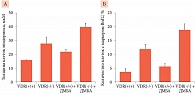
Цервикальная форма ВПЧ ассоциировалась с недостаточным уровнем 25(ОН)D в сыворотке (n = 2353). После корректировки на возраст, этническую принадлежность, пол и т.д. установлено, что риск инфицирования ВПЧ был выше у женщин с глубоким дефицитом (25(OH)D < 12 нг/мл, ОР 2,90, 95% ДИ 1,32–6,38), дефицитом (12–19 нг/мл, ОР 2,19, 95% ДИ 1,08–4,45) и недостаточным уровнем витамина D (20–29 нг/мл, ОР 2,19, 95% ДИ 1,22–3,93). Сравнение проводилось с пациентами, которые имели достаточный уровень витамина D (25(OH)D > 30 нг/мл) [28]. В среднем риск инфицирования ВПЧ увеличивался на 14% при снижении уровня в сыворотке 25(ОН)D на каждые 10 нг/мл (ОР 1,14, 95% ДИ 1,02–1,27) (рис. 2).
Был опубликован клинический случай, который продемонстрировал эффективность местного применения витамина D у пациентки с папилломой на правом указательном пальце [29]. Так, пациентка А., 41 год, с врожденным заболеванием почек перенесла трансплантацию почки от умершего донора и находилась на терапии иммунодепрессантами (такролимус, микофенолата мофетил). Через 19 месяцев после трансплантации у пациентки образовалась папиллома на правом указательном пальце, которая вырастала вновь и вновь, несмотря на многократную криотерапию и электрокоагуляцию. Местное лечение папилломы с использованием раствора 1,25(OH)2D (0,5 мкг/сут) привело к полному излечению через три месяца.
Витамин D как нутриентная основа профилактики и терапии опухолевых заболеваний шейки матки
1,25(OH)2D ингибирует пролиферацию опухолевых клеток шейки матки путем подавления экспрессии онкогена рака шейки матки (HCCR-1) и увеличения экспрессии проапоптотического белка р21. Опухолевые клетки шейки матки (линия HeLaS3) культивировали в средах с различными концентрациями 1,25(OH)2D, которые индуцировали остановку клеточного цикла на фазе G1. 1,25(OH)2D дозозависимо уменьшал экспрессию белка HCCR-1 посредством транскрипционной регуляции экспрессии гена HCCR-1 и повышенной экспрессии белка p21 и промоторной активности [30].
1,25(OH)2D увеличивает экспрессию онкопротективных микроРНК в клетках рака шейки матки (линия SiHa). МикроРНК влияют на экспрессию многочисленных белков деления клетки, поэтому поддержание функции микроРНК играет важную роль в торможении возникновения и развития опухолей. Показано, что 1,25(OH)2D регулирует экспрессию онкозащитных микроРНК miR-22, miR-296-3p и miR-498 [31].
Иммуногистохимический анализ показал, что уровни экспрессии VDR при цервикальной карциноме повышены по сравнению с нормальной тканью шейки матки. Окрашивание на VDR было однородным, без визуальных различий между отдельными опухолевыми клетками. Умеренно-сильное окрашивание на VDR было обнаружено в 16 из 21 биопсии рака шейки матки независимо от того, экспрессировали эти опухоли цитокератин 10 или трансглутаминазу К. Повышенная экспрессия VDR – один из аспектов иммунного ответа организма на ВПЧ [32].
Делеция рецептора витамина D в эксперименте сенсибилизирует эпителий к химически индуцированному опухолегенезу. Данный эффект вполне понятен, так как 1,25(OH)2D – мощный регулятор клеточной пролиферации, дифференцировки и апоптоза в различных типах клеток, включая кератиноциты. У мышей, гомозиготных по делеции рецептора витамина D (VDR(-/-)), пероральное введение канцерогена 7,12-диметилбензатрацена (ДМБА) вызывало развитие папиллом на всех участках тела со средней опухолевой нагрузкой в 5,3 папиллом/мышь. Никаких папиллом или каких-либо других поражений кожи не наблюдалось у мышей соответствующего возраста и пола без делеции рецептора витамина D (VDR (+/+)) [33].
У мышей линии VDR(-/-) начиная с семинедельного возраста отмечалась гиперпролиферация клеток кожи, которая резко усиливалась после воздействия ДМБА. Без воздействия канцерогена у мышей VDR(-/-) образования опухолей не наблюдалось, но имел место прогрессирующий фенотип кожи, характеризующийся утолщенной морщинистой кожей, дермоидными кистами и длинными вьющимися когтями. Усиленная чувствительность мышей VDR(-/-) к химически индуцированному канцерогенезу кожи убедительно доказывает, что нарушение сигнализации VDR предрасполагает к неоплазиям, вызываемым ВПЧ [33].
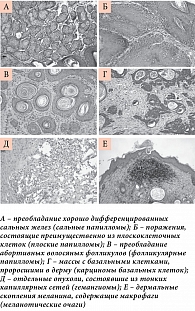
Согласно гистопатологическому анализу поражений кожи, у мышей VDR(-/-) обнаружены 94 опухоли на коже, которые были классифицированы по гистологическим подтипам (рис. 3). Большинство всех опухолей (40%) были сальными папилломами (рис. 3А) – доброкачественными поражениями, которые связаны с волосяными фолликулами, сальными железами и межфолликулярной дермой. Кроме того, встречались плоскоклеточные папилломы (25% поражений, рис. 3Б) и фолликулярные папилломы (15% поражений, рис. 3В). Такие виды поражений, как базально-клеточная карцинома (рис. 3Г) и гемангиома (рис. 3Д), выявлялись гораздо реже. Пигментированные поражения, классифицированные как меланотические очаги, которые обычно отсутствуют в мышиной коже, наблюдались у мышей с делецией VDR(-/-) (11% поражений). Меланотические очаги (рис. 3Е) состояли из агрегатов сильно пигментированных клеток с плохо выраженными цитоплазматическими признаками [33].
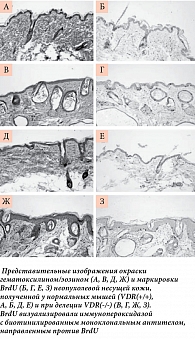
Витамин D оказывает антипролиферативное и продифференцирующее действие на кератиноциты, поэтому были исследованы биопсии кожи мышей VDR(-/-) посредством количественного определения пролиферативного маркера BrdU. Во всех опухолях мышей VDR(-/-) уровни BrdU были выше, чем рядом в здоровой коже (рис. 4 и 5). В большинстве опухолей пролиферация клеток ограничивалась одним слоем. В других случаях (особенно при плоских папилломах) BrdU-положительные клетки были сгруппированы в несколько слоев. Данные показывают, что расширение опухоли связано с дальнейшим усилением пролиферации эпидермальных клеток у мышей с делецией гена рецептора витамина D [33].
В клинико-эпидемиологическом исследовании более высокое потребление кальция и витамина D ассоциировалось с уменьшением риска развития неоплазии шейки матки (n = 2430, в том числе 405 случаев цервикальной неоплазии). По сравнению с самым низким квартилем потребления кальция риск заболевания дозозависимо понижался в двух верхних квартилях на 14% (ОШ 0,86, 95% ДИ 0,63–1,17) и 50% (ОШ 0,50, 95% ДИ 0,34–0,73) соответственно (p = 0,004). Более высокое потребление витамина D независимо снижало риск заболевания на 20% в третьем (ОР 0,80, 95% ДИ 0,56–1,15) и 36% в четвертом квартиле (ОР 0,64, 95% ДИ 0,43–0,94, p = 0,013) [34].
Таким образом, противовирусное и противоопухолевое действие витамина D позволяет предположить, что повышение обеспеченности этим витамином улучшит результаты терапии опухолевых заболеваний шейки матки. Действительно, в рандомизированном плацебоконтролируемом исследовании долгосрочное применение витамина D индуцировало регрессию цервикальной интраэпителиальной неоплазии [35].
Женщины с диагнозом интраэпителиальной неоплазии первой степени (n = 58) были рандомизированы на прием 50 000 МЕ витамина D3 (n = 29) или плацебо (n = 29) каждые две недели в течение шести месяцев. Через шесть месяцев регресс заболевания был выше среди женщин, принимавших витамин D – 85% (в группе плацебо только 54%, p = 0,01). Дотации витамина D повышали его концентрацию в сыворотке – +12,3 ± 11,4 (в группе плацебо -0,1 ± 3,7 нг/мл, p < 0,001) и приводили к значительному снижению уровня инсулина в сыворотке крови – -5,3 ± 7,3 МЕ/мл (+2,4 ± 5,9 МЕ/мл в группе плацебо, р < 0,001). Результатом приема витамина D также были значительное увеличение оксида азота (NO) в плазме – +15,5 ± 10,3 (в группе плацебо +4,0 ± 13,4 мкмоль/л, p = 0,001) и общего глутатиона – +11,8 ± 15 (в группе плацебо -294,2 ± 595,1 мкмоль/л, p = 0,01). Таким образом, долгосрочная дотация витамина D приводила к клинической регрессии цервикальной интраэпителиальной неоплазии на фоне нормализованного метаболизма инсулина, улучшенного кровообращения (NO – эффективный вазодилататор) и возрастанию антиоксидантного ресурса крови [35].
Заключение
Помимо ярко выраженного антибактериального эффекта витамин D также обладает противовирусным свойством, повышает устойчивость к действию проонкогенов. Увеличивая экспрессию интерферона альфа, кателицидина, дефенсина и противовирусных микроРНК, витамин D активирует различные механизмы врожденного противовирусного и противоопухолевого иммунитета. Результаты фундаментальных и клинических исследований показывают необходимость компенсации дефицита витамина D для успешной терапии вирусных гепатитов, респираторных инфекций, ВПЧ. Противовирусные эффекты витамина D весьма важны для повышения эффективности профилактики и терапии опухолевых заболеваний шейки матки.
Для адъювантной терапии с целью повышения иммунитета к ВПЧ, а также профилактики эрозии шейки матки, других неопластических изменений шейки матки, в том числе рака шейки матки, женщинам необходимо поддерживать достаточный для функциональной активности противовирусной системы иммунитета уровень 25(OH)D в сыворотке крови. При этом он должен быть даже немного выше общепринятой нижней границы нормы в 30 нг/мл – в диапазоне 40–100 нг/мл [1]. Женщинам с отягощенным анамнезом и клинической картиной папилломавирусного поражения кожи и шейки матки следует принимать витамин D в дозах не менее 1000–2000 МЕ/сут в течение достаточно длительного времени (не менее года). Женщинам, страдающим (в дополнение к ВПЧ) глюкозотолерантностью, ожирением, инсулинорезистентностью или диабетом, – в дозах 2000–4000 МЕ/сут и более (в этом случае доза подбирается индивидуально под контролем гинеколога-эндокринолога).
Для успешного восполнения содержания витамина D в организме врач может назначить лекарственный препарат Аквадетрим®, представляющий собой мицеллированную форму витамина в водном растворе. Мицеллы, содержащие витамин D, обеспечивают усвоение витамина D даже при нарушенном желчеобразовании и ожирении, а также при заболеваниях тонкого кишечника, дисфункции печени и др. и обусловливают возможность применения противовирусных препаратов и препарата Аквадетрим® для профилактики и лечения ВПЧ-инфекции в любом возрасте и при различном состоянии желудочно-кишечного тракта. Данный препарат характеризуется безупречной фармакологической историей и разрешен детям с рождения, беременным, кормящим, а также женщинам любого возраста для повышения противовирусного и противоопухолевого иммунитета.
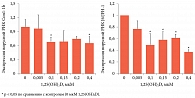
Ранее нами было показано, что Аквадетрим® проявляет достоверный противоопухолевый эффект, снижая рост и метастазирование перевиваемой эпидермоидной карциномы легких Льюис. Воздействие витамина D3 сопровождалось нарастающей тенденцией торможения роста опухоли на 25–30% (р = 0,016). Наблюдались отчетливые признаки подавления процессов метастазирования – число малых метастазов статистически значимо снижалось на 35–40% (p < 0,05) [4]. Полученные результаты открывают перспективы применения препарата Аквадетрим® в адъювантной терапии для повышения иммунитета к ВПЧ и одновременно для противодействия онкогенным эффектам этого вируса.
O.A. Gromova, I.Yu. Torshin, D.Ye. Frolova, A.N. Gromov, N.P. Lapochkina
Federal Research Center ‘Computer Science and Control’ of Russian Academy of Sciences, Moscow
Ivanovo State Medical Academy
Contact person: Olga Alekseyevna Gromova, unesco.gromova@gmail.com
In addition to the manifested antibacterial effect, vitamin D also has an antiviral effect. By increasing the expression of interferon-alpha, cathelicidin, defensin and antiviral microRNAs, vitamin D activates different mechanisms of innate antiviral immunity. The results of fundamental and clinical studies show the necessity to compensate vitamin D deficiency for successful therapy of viral hepatitis, respiratory infections and human papilloma virus. The antiviral effects of vitamin D are also important to increase the efficiency of the prevention and treatment of cervical tumor diseases.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.