количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Теория
О возможности использования стандартизированных форм омега-3 ПНЖК в терапии и профилактике тромбофилий. Биоинформационный анализ данных молекулярной физиологии и доказательной медицины*
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Акушерство и Гинекология" №5
- Аннотация
- Статья
- Ссылки
В статье рассмотрены основные физиологические механизмы возникновения тромбофилий (синтез тромбоксана, гиперкоагуляция, воспаление эндотелия сосудов, антифосфолипидный синдром, нарушения липидного профиля, эндокринные нарушения, структура соединительной ткани) и представляются результаты систематического анализа молекулярных эффектов влияния омега-3 ПНЖК на тромбообразование. Результаты клинических исследований позволяют утверждать: омега-3 ПНЖК воздействуют на большинство из этих факторов, что обусловливает их дезагрегационные и антикоагулянтные свойства.
Приводятся данные доказательной медицины по антитромботическим эффектам омега-3 ПНЖК, которые, в частности, показывают целесообразность использования данных средств для преодоления аспириновой резистентности и в сочетанной терапии с другими препаратами. Обсуждается роль омега-3 ПНЖК в акушерско-гинекологической практике (тромбозы при невынашивании, гестозе, флебопатиях, нарушение маточно-плацентарного кровотока и т.д.).
Авторами сделан вывод о том, что понимание механизмов воздействия омега-3 ПНЖК на коагуляцию на молекулярном уровне способствует более эффективному ведению пациенток и адекватному планированию исследований с позиций доказательной медицины в акушерстве и гинекологии.
Повышенная склонность к тромбообразованию (тромбофилия) играет значительную роль в этиологии не только сердечно-сосудистых и цереброваскулярных, но и акушерско-гинекологических заболеваний. Исследования экспериментальной фармакологии показывают, что баланс омега-3/омега-6 полиненасыщенных жирных кислот (ПНЖК) важен для поддержания физиологически необходимых уровней свертываемости крови.
В статье рассмотрены основные физиологические механизмы возникновения тромбофилий (синтез тромбоксана, гиперкоагуляция, воспаление эндотелия сосудов, антифосфолипидный синдром, нарушения липидного профиля, эндокринные нарушения, структура соединительной ткани) и представляются результаты систематического анализа молекулярных эффектов влияния омега-3 ПНЖК на тромбообразование. Результаты клинических исследований позволяют утверждать: омега-3 ПНЖК воздействуют на большинство из этих факторов, что обусловливает их дезагрегационные и антикоагулянтные свойства.
Приводятся данные доказательной медицины по антитромботическим эффектам омега-3 ПНЖК, которые, в частности, показывают целесообразность использования данных средств для преодоления аспириновой резистентности и в сочетанной терапии с другими препаратами. Обсуждается роль омега-3 ПНЖК в акушерско-гинекологической практике (тромбозы при невынашивании, гестозе, флебопатиях, нарушение маточно-плацентарного кровотока и т.д.).
Авторами сделан вывод о том, что понимание механизмов воздействия омега-3 ПНЖК на коагуляцию на молекулярном уровне способствует более эффективному ведению пациенток и адекватному планированию исследований с позиций доказательной медицины в акушерстве и гинекологии.
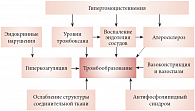
Рис. 1. Основные патофизиологические процессы, способствующие тромбообразованию
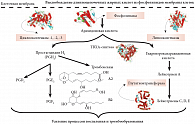
Рис. 2. Каскад биотрансформаций арахидоновой кислоты и химические структуры тромбоксанов А2 и В2
![Рис. 3. Активное удаление лейкоцитов из воспалительного экссудата (Адаптировано по [43]. )](/upload/resize_cache/iblock/042/195_350_1/042972eb0539d271fa077813ea5d17e6.png)
Рис. 3. Активное удаление лейкоцитов из воспалительного экссудата (Адаптировано по [43]. )
![Рис. 4. Молекулярные механизмы воздействия резолвинов и нейропротектинов на процесс физиологического окончания (разрешения) воспаления (Адаптировано по [8].)](/upload/resize_cache/iblock/f38/195_350_1/f38157367e9bc50f9591b557f5afa7be.png)
Рис. 4. Молекулярные механизмы воздействия резолвинов и нейропротектинов на процесс физиологического окончания (разрешения) воспаления (Адаптировано по [8].)
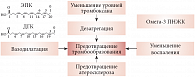
Рис. 5. Механизмы воздействия омега-3 ПНЖК на профилактику тромбоэмболии
Введение
Тромбофилия, то есть повышенная склонность к тромбообразованию, является одной из патогенетических основ патологии стенок кровеносных сосудов. К органам, особо нуждающимся в хорошо разветвленном кровотоке, относятся миокард, головной мозг, почки, печень и плацента. При нарушениях кровотока вследствие тромбофилии функции всех этих органов неизбежно страдают.
Гемостаз – основной процесс тромбообразования – сложный физиологический процесс, посредством которого происходит переход крови из текучего и жидкого состояния в сгущенное и нетекучее и обратно. Система гемостаза представляет собой совокупность молекулярных механизмов, обеспечивающих сохранение жидкого состояния крови и целостности кровеносных сосудов. Гемостаз может быть подразделен на четыре основных этапа:
- локальная вазоконстрикция для ограничения кровяного потока в месте повреждения;
- активизация тромбоцитов и образование первоначального тромба на месте повреждения;
- перекрестное сшивание первоначального тромба посредством фибриновых нитей (коагуляция);
- частичное, а затем полное растворение фибринового сгустка для восстановления нормального потока крови (фибринолиз).
Система коагуляции далеко не единственный фактор, влияющий на тромбообразование (рис. 1) [1]. Следует сказать также об атеросклеротических бляшках, сужающих просвет сосуда, провоспалительных процессах, инициирующих агрегацию тромбоцитов с образованием тромба, и т.д.
Вопросы, связанные с тромбообразованием, особенно актуальны при беременности, которая сама по себе является гиперкоагуляционным состоянием [2]. Нарушения баланса свертывания крови являются одним из ведущих факторов риска возникновения патологий беременности (невынашивание, замедление и остановка роста плода, преждевременные роды, артериальная гипертония) [3, 4]. Невынашивание встречается в 1–10% случаях и в 50–60% случаев является идиопатическим [5–7]. Для сохранения беременности необходимо нормальное функционирование тромбоцитов и системы свертывания крови в период инвазии трофобласта и формирования плаценты.
Эпидемиологические исследования и рандомизированные клинические испытания показали, что омега-3 ПНЖК способствуют снижению риска сосудистой патологии в терапии и акушерстве. В предотвращение кардиоваскулярной и цереброваскулярной патологии вносят свой вклад самые различные биологические и молекулярные эффекты омега-3 ПНЖК, такие как противовоспалительный [8], сосудорасширяющий [9], антиаритмический [10], антиатерогенный [11, 12] и антиагрегантный [13]. Детальные молекулярные механизмы воздействия омега-3 ПНЖК достаточно сложны и активно исследуются в настоящее время. Понимание этих механизмов важно для разработки будущих стратегий профилактики и лечения воспалительных и сосудистых заболеваний [14].
В настоящей статье будут проанализированы физиологические и молекулярные механизмы воздействия тромбообразования омега-3 ПНЖК (в том числе таких как докозагексаеновая кислота (ДГК), эйкозапентаеновая кислота (ЭПК)) на каждый из процессов, стимулирующих тромбообразование: синтез тромбоксана, коагуляцию, воспаление эндотелия сосудов, атеросклероз, структуру соединительной ткани и вазоконстрикцию.
В связи с тем что к настоящему времени имеется значительное количество публикаций, посвященных омега-3 ПНЖК (более 30 тыс.), поиск репрезентативных публикаций по данному вопросу значительно затруднен. Нами был разработан и использован специальный математический формализм [15–20] для решения проблемы высокоточного поиска специализированной научной литературы. Используя различные комбинации наиболее информативных терминов, проведен полный поиск среди 30 тыс. публикаций по омега-3 ПНЖК и установлен список из 73 работ, которые были проанализированы при написании данной статьи.
Синтез тромбоксанов, активация тромбоцитов и омега-3 ПНЖК
Тромбоксаны образуются в каскаде биотрансформаций арахидоновой кислоты (АРК) (рис. 2) и названы так вследствие их очевидного участия в тромбообразовании. Действительно, тромбоксаны являются мощными вазоконстрикторами и способствуют агрегации тромбоцитов – принципиально важных клеток для образования тромбов. Тромбоциты – это клетки 2–3 мкм в диаметре, не имеющие ядра и являющиеся результатом фрагментации мегакариоцитов, гигантских клеток-предшественников. Средняя продолжительность жизни тромбоцитов, как правило, составляет 5–9 дней. В тромбоцитах содержатся тромбоцитарный фактор роста и трансформирующий фактор роста бета, которые играют значительную роль в восстановлении и регенерации соединительной ткани [21].
Тромбоксан-синтетаза тромбоцитов преобразует простагландин H2 (производное АРК) в тромбоксаны, которые, в свою очередь, действуют на другие тромбоциты, соединяясь со специальным Gq-белок-связывающим рецептором, известным как тромбоксановый рецептор (TBXA2R) [22]. Тромбоциты, активированные тромбином, начинают производить многочисленные окисленные формы АРК посредством 12-липоксигеназы. Из этих окисленных форм АРК только некоторые являются специфическими активаторами агрегации тромбоцитов. Например, из 14 исследованных продуктов окисления АРК только производное 15-F2-изопростан значимо активировало тромбоциты [23]. Омега-3 ПНЖК, вытесняя все продукты биотрансформаций АРК, в том числе 15-F2-изопростан, способствуют снижению синтеза тромбоксанов и агрегации тромбоцитов.
В эксперименте прием ДГК и ЭПК на фоне снижения приема АРК сопровождался уменьшением синтеза тромбоксана А2 (TXA2) и простагландина I2 (PGI2) в тромбоцитах и в ткани аорты [24]. При этом наблюдалось снижение экспрессии генов тромбоцитарного фактора роста и тромбоцит-активирующего фактора [25]. При оценках активности ферментов в гомогенате печени омега-3 ПНЖК увеличивалась активность каталазы на 183%, а активность глутатионтрансферазы – на 34–39%. При этом уровень тромбоксана B2 в сыворотке снижался на 42%; степень и скорость агрегации тромбоцитов значительно уменьшились [26].
Наиболее очевидным молекулярным механизмом антиагрегантных эффектов омега-3 ПНЖК является воздействие на каскад арахидоновой кислоты. Омега-3 ПНЖК и их производные взаимодействуют практически с каждым из ферментов каскада АРК, замедляя синтез провоспалительных эйкозаноидов и стимулируя синтез противовоспалительных эйкозаноидов и докозаноидов [27]. Кроме того, омега-3 ПНЖК тормозят синтез тромбоксанов и активность циклооксигеназы, являющейся целевым белком воздействия аспирина, взаимодействуя с тромбоксан-синтетазой.
Производное ДГК, известное как нейропротектин D1, ингибирует агрегацию тромбоцитов при концентрации порядка 10-7 моль/л. Ингибирование агрегации тромбоцитов нейропротектином D1 наблюдалось при различных способах индукции: коллагеном, арахидоновой кислотой, тромбоксаном. Дальнейшие биохимические исследования показали, что антиагрегантный эффект нейропротектина D1 осуществляется как через снижение активности циклооксигеназы, так и путем связывания с рецепторами тромбоксана [28].
Проведено исследование с участием 12 здоровых добровольцев в возрасте 53–65 лет, которые принимали последовательно 200, 400, 800 и 1600 мг/сут ДГК (каждая доза в течение 2 недель). Прием омега-3 ПНЖК приводил к увеличению уровней ДГК в фосфолипидах тромбоцитов. Уже при дозах в 400 и 800 мг/сут ДГК реактивность тромбоцитов на АДФ и АРК значительно уменьшилась [29].
Антиагрегантный эффект омега-3 ПНЖК был продемонстрирован в исследовании, в которое было включено 59 пациентов с сахарным диабетом 2 типа. Участники принимали 4 г/сут ДГК или плацебо (оливковое масло) в течение 6 недель. По сравнению с группой плацебо, прием ДГК значительно снижал коллаген-индуцированную (на 16%, р = 0,05) и тромбоксан-B2-индуцированную (на 18%, р = 0,03) агрегацию тромбоцитов [30].
В другом исследовании 20 здоровых добровольцев были рандомизированы на получение либо 4 г/сут этиловых эфиров омега-3 ПНЖК, либо 4 г/сут плацебо (оливковое масло) в течение 4 месяцев. Прием омега-3 ПНЖК статистически значимо увеличивал уровни ЭПК и ДГК в плазме. Наблюдалось значительное снижение чувствительности тромбоцитов к коллагену, снижение уровней тромбоксана TxB2 в сыворотке и в моче [31–33].
Коагуляция и омега-3 ПНЖК
Молекулярные механизмы коагуляции крови хорошо изучены. Эти механизмы включают собственно каскад коагуляции (активация которого приводит к образованию фибриновых волокон и сеток, стабилизирующих структуру тромба) и фибринолитический каскад (осуществляющий деградацию тромба посредством гидролиза фибриновой сетки). Процессы коагуляции и фибринолиза занимают особое место в гемостазе, так как именно они приводят к образованию устойчивых тромбов, которые при соответствующих условиях вызывают тромбоз.
Взаимосвязь омега-3 ПНЖК и процессов коагуляции неоднозначна. В то время как влияние омега-3 ПНЖК на агрегацию тромбоцитов точно установлено, воздействие омега-3 ПНЖК и их производных на процессы коагуляции изучено меньше. С одной стороны, омега-3 ПНЖК не приводили к изменениям в экспрессии генов каскада свертывания крови [34]. С другой стороны, имеются данные экспериментальных, биохимических и клинических исследований, указывающие на антикоагулянтные эффекты омега-3 ПНЖК.
Омега-3 ПНЖК вызывают улучшение реологических свойств крови и коагуляции на моделях атеросклероза, созданного мегадозами холекальциферола (600 000 МЕ/кг), по сравнению с контрольной группой. Прием омега-3 ПНЖК снижает вязкость плазмы (1,6 ± 0,2 мПа×с, омега-3; 1,8 ± 0,2 мПа×с, контроль) и увеличивает протромбиновое время (13,9 ± 0,6 и 10,7 ± 0,3 с), тормозя образование атеросклеротических бляшек (р < 0,05) [35].
В экспериментах на животных крысы со спонтанным диабетом получали этиловый эфир ЭПК или гомогенизированное свиное сало путем введения через зонд (300 мг/кг/сут, 52 недели). По сравнению с контрольной группой, прием ЭПК не только способствовал подавлению АДФ-индуцированной и коллаген-индуцированной агрегации тромбоцитов, но и оказывал положительное влияние на коагуляцию. Прием омега-3 ПНЖК значительно улучшал параметры коагуляции (протромбиновое время, активированное частичное тромбопластиновое время, уровень фибриногена, активность факторов II, V, VII, VIII, IX, X, XI, XII и антитромбина III) и параметры фибринолиза (плазминоген, тканевой активатор плазминогена, альфа-2-ингибитор плазмина и ингибитор активатора плазминогена). Кроме этого, ЭПК значительно увеличивала миграционную активность сосудистых эндотелиальных клеток и уменьшала связывание эндотелиальными клетками фактора роста эндотелия сосудов [36, 37].
Омега-3 ПНЖК эффективно тормозят избыточное тромбообразование. Добровольцы с избыточной массой тела (но не с ожирением) получали по 3 г/сут омега-3 ПНЖК в течение 4 недель. Прием омега-3 ПНЖК приводил к снижению уровней триглицеридов в плазме, уровня активации тромбоцитов, а также к снижению плазменных уровней фибриногена и фактора V. Прием омега-3 ПНЖК не влиял на витамин-К-зависимые факторы свертывания крови [38], несмотря на то что в эксперименте ДГК и ЭПК снижают синтез витамина К в печени [39].
В крови пациентов с ишемической болезнью сердца наблюдается повышение уровня микрочастиц, содержащих белок каскада коагуляции, известный как «тканевой фактор». Циркуляция этих микрочастиц в крови способствует увеличению вероятности протромботических и провоспалительных реакций. В группе 46 пациентов, перенесших инфаркт миокарда, участники были рандомизированы на получение либо 5,2 г/сут омега-3 ПНЖК (n = 23), либо плацебо (оливковое масло, n = 23) в течение 12 недель. Концентрация микрочастиц тканевого фактора в крови была снижена в группе принимавших омега-3 ПНЖК (от 431 × 106/л до 226 × 106/л, р < 0,05), в то время как в группе плацебо изменений не наблюдалось [40].
Производные омега-3 ПНЖК, воспаление и эндотелий кровеносных сосудов
Во время беременности значительно повышается риск развития воспалительных процессов. У многих беременных буквально с первой недели наблюдается хроническая заложенность носа, обостряются аллергические реакции, часто повышаются биохимические маркеры воспаления (фактор некроза опухоли альфа, С-реактивный белок, иммуноглобулин Е, интерлейкин 1 и др.). Во-первых, это связано с реакцией иммунной системы матери на ткани плода. Во-вторых, воспалительный компонент необходим для успешного прикрепления и инвазии трофобласта [41]. В-третьих, активация иммунной системы матери важна и для защиты плода от возможных внутриутробных инфекций, поскольку по меньшей мере 25% всех преждевременных родов обусловлены именно внутриутробными инфекциями [42]. Следует подчеркнуть, что при физиологической беременности параллельно с активацией процессов воспаления также активируются и процессы физиологического разрешения (окончания) воспаления, которые требуют достаточной обеспеченности омега-3 ПНЖК. При недостатке омега-3 ПНЖК баланс между воспалением – разрешением воспаления нарушается, и воспаление переходит в хроническую стадию, что может стать причиной патологии беременности.
Хроническое воспаление поддерживается провоспалительными медиаторами, в том числе лейкотриенами и простагландинами, синтезируемыми из омега-6 арахидоновой кислоты. Разрешение воспаления не происходит «само собой» вследствие уменьшения провоспалительных хемотаксических сигналов, а является активным процессом, регулируемым специфическими липидными медиаторами – образующимися из омега-3 ПНЖК резолвинами и нейропротектинами. Эти сигнальные молекулы предотвращают чрезмерное воспаление, тормозят инфильтрацию лейкоцитов, способствуют удалению микробов и апоптотирующих клеток, ускоряя физиологическое разрешение острого воспаления и обеспечивая возвращение к нормальному тканевому гомеостазу [8]. Сам термин «резолвин» происходит от англ. resolution of inflammation – разрешение воспаления. Действительно, резолвин Е1 (RvE1) уже в нанограммовых количествах способствует удалению избытка фагоцитов во время острого воспаления посредством регуляции инфильтрации лейкоцитов и увеличения поглощения макрофагами апоптотирующих нейтрофилов как in vitro, так и in vivo [43] (рис. 3).
Биологические эффекты всех эйкозаноидов, в том числе резолвинов и нейропротектинов, опосредуются специфическими эйкозаноидными рецепторами (рис. 4). Большинство эйкозаноидных рецепторов передают сигнал через G-белки. Как правило, эффекты резолвинов опосредуются рецепторами CMKLR1 (хемокин-подобный рецептор 1, также обозначаемый ChemR23), GPR32 (G-белок-связанный рецептор 32), LTB4R (рецептор лейкотриена В4) и LXA4R (рецептор липоксина, или FPR2/ALXR-рецептор) [8].
Резолвин E1 – производное эйкозапентаеновой кислоты, генерируемое в процессе физиологического разрешения воспаления. В концентрациях 10–100 нмоль/л резолвин Е1 регулирует экспрессию лейкоцитами молекул межклеточной адгезии, значительно (в среднем на 20–25%) снижает взаимодействие лейкоцитов с эндотелием венул [44] и снижает риск тромбообразования. При этом наблюдается значительное снижение числа лейкоцитов, претерпевающих адгезию к эндотелиальному слою сосудов.
Атеросклероз и омега-3 ПНЖК
Потребность плода в строительных материалах (в частности, в жирах) приводит к интенсификации жирового обмена и повышению уровня липидов в крови беременной. Как правило, беременность наступает в возрасте 18–35 лет, когда сосуды находятся в хорошем состоянии. Однако неправильное питание, ожирение приводят к тому, что в последнее время атеросклероз «молодеет» и начинает оказывать все большее влияние на течение беременности и здоровье женщин.
Образование атеросклеротических бляшек провоцируется повышенным уровнем воспаления эндотелия сосудов и избыточными концентрациями липидов в плазме крови. Липиды, полученные из пищи, преобразуются в тонкой кишке в жировые частицы размером 200–500 нм, известные как хиломикроны. На 99% (по объему) хиломикроны состоят из триглицеридов, стабилизированных аполипопротеинами. Если беременная употребляет больше жиров, чем требуется ее организму и организму плода, избыток триглицеридов и холестерина экспортируются из печени в кровь в форме частиц липопротеина очень низкой плотности. Если диета беременной не сбалансирована по жирам, у пациентки происходит депонирование липопротеинов низкой плотности на стенках сосудов, в том числе сосудов плаценты. Атеросклероз, сопровождающийся хроническим воспалением эндотелия сосудов, особенно ярко проявляется в разветвленной сети мелких сосудов плаценты, приводя к микротромбообразованию и нарушению маточно-плацентарного кровотока.
Уменьшая выраженность воспаления, омега-3 ПНЖК способствуют профилактике атеросклероза [2]. Кроме того, омега-3 ПНЖК содействуют снижению уровня триглицеридов плазмы [11, 12] и предотвращают накопление холестерина в атеросклеротических бляшках [45]. Данные эффекты, вероятно, опосредуются транскрипционными факторами – рецепторами, активируемыми пероксисомными пролифераторами (рeroxisome proliferator-activated receptors, PPARs: PPAR-альфа и PPAR-гамма), стимулирующими бета-окисление липидов [46], и белком, связывающим стерол-регуляторный элемент (sterol regulatory element binding proteins, SREBP), изменяющим транскрипцию генов, вовлеченных в метаболизм холестерина, триглицеридов и жирных кислот [47]. Полногеномное исследование действия омега-3 ПНЖК на генную экспрессию в клетках печени показало:
- повышение экспрессии генов, способствующих окислению и деградации липидов;
- снижение экспрессии генов, способствующих синтезу липидов (гамма-глутамил-карбоксилаза, ряд транскрипционных факторов).
Таким образом, гиполипидемическое влияние омега-3 ПНЖК связано непосредственно с изменениями экспрессии генов метаболизма жирных кислот [34]. В эксперименте были изучены различия эффектов ДГК и ЭПК на агрегацию тромбоцитов при гиперхолестеринемии. Омега-3 ПНЖК принимались в количестве 300 мг/кг/сут в течение 12 недель. Диета с высоким содержанием холестерина значительно увеличивала агрегацию тромбоцитов. Напротив, прием ДГК значительно уменьшал агрегацию [48].
Сравнение пациентов с гиперлипидемией и пациентов контрольной группы показало, что экспрессия маркеров активации тромбоцитов (CD62P, CD63, PAC-1, аннексин V) была выше при гиперлипидемии и сахарном диабете 2 типа. После приема эйкозапентаеновой кислоты уровни маркеров CD62P, CD63, аннексина V и микрочастиц селектина SE существенно снизились [49].
Омега-3 ПНЖК и вазоконстрикция
Женщины во время беременности часто испытывают стрессорные воздействия. Следствием возрастающего постоянного стресса является хроническое повышение уровней катехоламинов (адреналина и норадреналина) в плазме крови. Физиологические воздействия катехоламинов многообразны: они увеличивают частоту сердечных сокращений и объем выброса крови, повышают артериальное давление, гликогенолиз и липолиз. Одним из основных эффектов катехоламинов является вазоконстрикция, которая нарушает кровообращение в системе «мать – плацента – плод» и способствует тромбообразованию. ЭПК и ДГК конкурируют с АРК путем взаимодействия с циклооксигеназами и липоксигеназами, что не только снижает синтез провоспалительных простаноидов, но и стимулирует синтез простаноидов, способствующих вазодилатации [50, 51].
Омега-3 ПНЖК влияют на тонус сосудов, увеличивая высвобождение оксида азота (NO) [52], снижая уровни вазоконстрикторных простагландинов, в том числе тромбоксана А2 [53]. Омега-3 ПНЖК способствуют снижению артериального давления при приеме в дозе 3–4 г/сут [54, 55] и усиливают гипотензивное действие других препаратов при ограничении потребления соли у пациентов с солезависимой формой гипертонии. Эпидемиологические исследования демонстрируют отчетливую взаимосвязь между потреблением рыбы и вазодинамикой [56, 57]. В эксперименте ДГК и ЭПК в микромолярных концентрациях ингибировали констрикторные реакции, вызываемые в аорте агонистами альфа-адренорецепторов [58], вызывающих сильнейший вазоконстрикторный эффект.
Как уже говорилось, омега-3 ПНЖК воздействуют на вазодилатацию через NO. В исследовании у 563 пациентов потребление омега-3 ПНЖК сопровождалось значительным повышением уровня аргинина в плазме (p < 0,05) [59]. Как известно, аргинин необходим для синтеза NO. В эксперименте омега-3 ПНЖК способствовали экспрессии индуцибельной синтетазы окиси азота, снижению экспрессии гена эндотелина (ЕТ1) и уровня эндотелина в плазме. По-видимому, эти изменения и соответствуют вазодилатации при приеме омега-3 ПНЖК.
Структура соединительной ткани
Соединительная ткань образует наружный каркас кровеносного сосуда. При беременности достаточно часто наблюдается дефицит соединительной ткани [60], в результате чего страдает наружная оболочка сосудов, увеличивается частота микроповреждений сосудов и склонность к тромбообразованию. Омега-3 ПНЖК обладают противовоспалительными свойствами, что прямо или косвенно оказывает воздействие на состояние артериальных стенок [61]. Кроме того, имеющиеся данные о положительном влиянии омега-3 ПНЖК на состояние костной ткани и ранозаживление указывают, что они могут воздействовать на состояние различных видов соединительной ткани через другие механизмы.
Омега-3 и омега-6 ПНЖК модулируют активность рецепторного белка RANK (receptor activator of nuclear factor-κβ), который находится на остеокластах и вызывает резорбцию кости. При этом омега-6 АРК вызывает повышение активности остеокластов и резорбцию кости, а синтезируемые из омега-3 ПНЖК резолвины, напротив, подавляют вызванную воспалением резорбцию кости [62]. ДГК увеличивает минеральную плотность кости у взрослых [63], а содержание омега-3 ПНЖК в пуповине значимо коррелирует с костной массой у здоровых новорожденных [64]. Омега-3 ПНЖК улучшают процессы заживления, при этом образуются более зрелые коллагеновые фибриллы с оптимальным содержанием коллагена типа III [65].
Клинические и эпидемиологические исследования антитромботических эффектов омега-3 ПНЖК
Рассмотрим данные крупных эпидемиологических исследований по использованию в терапии и профилактике тромботических осложнений стандартизированных препаратов на основе омега-3 ПНЖК (рис. 5). В исследовании M.K. Larson и соавт. (2011) 30 здоровых добровольцев получали 3400 мг/сут ЭПК + ДГК в течение 28 дней. Прием омега-3 ПНЖК привел к уменьшению количества тромбоцитов на 6,3% и одновременно к снижению коллаген-опосредованной активации тромбоцитов на 50% [66].
Еще раз отметим роль диеты, богатой омега-3 ПНЖК, в профилактике проагрегантных и прокоагулянтных состояний у беременных. Регулярное включение в пищу специальных сортов жирной рыбы с высоким содержанием омега-3 ПНЖК (сардины, анчоусы, сельдь, скумбрия, палтус и др.) может способствовать значительному снижению риска развития сосудистых осложнений. Следует принимать во внимание степень экологической чистоты морепродуктов: многие сорта рыбы с длинным жизненным циклом накапливают ртуть, кадмий и другие токсичные элементы.
В работе J.N. Din и соавт. рацион 14 добровольцев в течение 4 недель был дополнен употреблением жирных сортов рыбы в количестве 500 г/нед. В контрольной группе (n = 14) жирная рыба была полностью исключена из диеты. Регулярный прием рыбы привел к увеличению содержания омега-3 ПНЖК в плазме крови (14 ± 3%, в контрольной группе – 6 ± 1%, р < 0,001). В группе употреблявших рыбу уровни тромбоцитарных-моноцитарных агрегантов снизились на 35% (р < 0,01). Важно отметить, что эта положительная динамика полностью исчезла после исключения рыбы из рациона [67], что еще раз подчеркивает важность регулярного приема омега-3 ПНЖК для профилактики протромботических состояний.
Повышенные уровни гомоцистеина, фактора VIII и фактора фон Виллебранда в плазме крови являются факторами риска тромбоэмболии и в значительной мере зависят от адекватности пищевого рациона. В проспективном исследовании ARIC (Atherosclerosis Risk in Communities Study) 14 962 взрослых среднего возраста наблюдались в течение 12 лет. За этот срок было зарегистрировано 196 случаев венозной тромбоэмболии. Потребление рыбы 1 раз в неделю и более было связано с 30–45%-ным снижением риска тромбоэмболии, в то время как потребление красного жареного мяса соответствовало 2-кратному повышению риска данного осложнения [68].
Группа из 42 пациентов с сочетанной гиперлипидемией (уровень триглицеридов 2,0–15,0 ммоль/л, холестерин > 5,3 ммоль/л) получали лечение аторвастатином в дозировке 10 мг/сут в течение 10 недель. В течение последних 5 недель пациенты были рандомизированы на 2 группы: в первой группе дополнительно назначали омега-3 ПНЖК по 1680 мг/сут, во второй – плацебо (кукурузное масло). Дополнение терапии препаратом омега-3 ПНЖК вызывало дальнейшее снижение концентрации фактора FVIIa и также значительно снижало уровни и активность фактора FVII [69].
Омега-3 ПНЖК в дозе 1000 мг/сут повышает эффективность приема аспирина по 75 мг/сут и клопидогрела в нагрузочной дозе 600 мг, затем по 75 мг/сут, по сравнению с контрольной группой (р = 0,029) [70], в том числе преодолевает аспириновую резистентность. В когортном исследовании 485 пациентов со стабильной ишемической болезнью сердца все участники принимали низкие дозы аспирина (от 75 до 162 мг/сут) в течение 1 недели. Пациенты были обследованы на аспириновую резистентность с использованием анализа VerifyNow Aspirin (Accumetrics, Сан-Диего, Калифорния) и тестов на агрегацию тромбоцитов. Аспириновая резистентность была установлена по двум из трех критериев:
- балл по шкале VerifyNow более 550;
- агрегация тромбоцитов, вызванная 0,5 мг/мл АРК ≥ 20%;
- агрегация тромбоцитов, вызванная 10 мкмоль/л аденозиндифосфата (АДФ) ≥ 70%.
У 30 пациентов (6,2%) была выявлена аспириновая резистентность; эти больные были рандомизированы на получение либо низких доз аспирина и омега-3 ПНЖК (4 г/сут), либо аспирина в дозе 325 мг/сут. Через 1 месяц в обеих группах наблюдалось значительное сокращение пациентов с резистентностью к аспирину. В обеих группах также снизились уровни тромбоксана В2 в плазме (на 57% – в группе принимавших омега-3 ПНЖК, на 40% – в группе принимавших аспирин) [71]. В итальянском исследовании с участием женщин с антифосфолипидным синдромом было показано, что эффективность приема омега-3 ПНЖК была сравнима с эффективностью приема малых доз аспирина: роды в срок наступили у 80% женщин, принимавших аспирин, и у 74% женщин, принимавших омега-3 ПНЖК [72].
Традиционная «осторожность» по отношению к новым лекарственным препаратам в акушерско-гинекологической практике часто переносится на нутрицевтические препараты на основе витаминов, микроэлементов, омега-3 ПНЖК. Так, эффективность препаратов на основе омега-3 ПНЖК в кардиологии и терапии исследуется уже более 30 лет и имеет уровень доказательности класса А, а в акушерстве эти препараты только начинают внедряться. По данным опроса в 15 областях России в 2009 г., коррекцию теми или иными препаратами с омега-3 ПНЖК получали менее 1% беременных. При этом стандартизированные по ДГК и ЭПК препараты омега-3 ПНЖК, имеющие доказательную базу эффективного применения, используются еще реже.
На фармацевтическом рынке под маркой омега-3 ПНЖК активно продвигаются препараты рыбьего жира с недостаточной степенью очистки, с тяжелым рыбьим запахом, провоцирующим у беременных тошноту, не имеющие доказательной базы и даже официального разрешения к применению в период беременности [73]. У беременных, особенно склонных к тошноте, для компенсации дефицита омега-3 ПНЖК необходимо применять препараты омега-3 ПНЖК с достаточной степенью очистки не только от тяжелых металлов (ртуть, кадмий), но и от запаха рыбы (Омегамама, Фемибион II, Мультитабс Омега 3 ПНЖК, Наталбен Супра).
Европейский сертификат качества для применения у беременных имеет субстанция “Ropufa 30 n-3” (DSM, Швейцария) и производимые на основании этой субстанции препараты Омегамама, Мультитабс Омега-3 1000 мг, Фемибион и т.д. Например, в 2 капсулах препарата Омегамама содержится 300 мг омега-3 ПНЖК, что соответствует рекомендованной суточной потребности. Омега-3 ПНЖК в препарате Омегамама представлены преимущественно ДГК (ДГК:ЭПК = 7:1), что оптимально и для матери, и для развивающегося плода [73]. ДГК- и ЭПК-субстанции защищены от окисления посредством добавления альфа-, бета- и гамма-токоферолов, аскорбил-пальмитата и лимонной кислоты. Субстанция приготовляется на основе экстракта жира из анчоусов и сардин. Эти виды рыб имеют короткий жизненный цикл и практически не накапливают токсичных металлов (ртуть, кадмий и т.д.).
Заключение
Во время беременности зачастую возникают проблемы, связанные со здоровьем будущей матери. Например, тромбофилия, не имеющая клинических симптомов до беременности, может проявиться уже в течение первого триместра. Тромбофилия повышает риск тромбозов глубоких вен, сердечно-сосудистых осложнений и является одной из причин невынашивания беременности. Именно поэтому возникающие при беременности тромбоэмболические и гиперкоагуляционные состояния требуют особого внимания акушера-гинеколога и терапевта. Надо помнить о том, что система «мать – плацента – плод» крайне чувствительна к фармакологическим воздействиям, и избегать полипрагмазии, используя нутрициологические резервы: витамины, микроэлементы и особые микронутриенты, такие как омега-3 ПНЖК. Применение стандартизированных форм омега-3 ПНЖК особенно актуально при недостатке их употребления с пищей. Проанализированные в настоящей статье молекулярные механизмы воздействия омега-3 ПНЖК на систему гемостаза указывают на дезагрегантное, антикоагулянтное, противовоспалительное, антиатеросклеротическое, сосудорасширяющее и другие положительные воздействия этого микронутриента. Данные доказательной медицины подтверждают целесообразность использования стандартизированных форм омега-3 ПНЖК в составе комплексной терапии (в частности, с аспирином) для профилактики самопроизвольного прерывания беременности. После родоразрешения пациентки с тромбофилией должны регулярно наблюдаться терапевтом, так как они входят в группу риска по раннему развитию сердечно-сосудистых и цереброваскулярных заболеваний.
1. Тетруашвили Н.К., Громова О.А., Cеров В.Н. Использование цитрата магния позволяет осуществить профилактику преждевременных родов у беременных с высоким риском невынашивания // РМЖ. Акушерство и гинекология. 2012. № 3. С. 846–851.
2. Громова О.А., Торшин И.Ю., Калачева А.Г., Грачева О.Н. Крупномасштабные клинические исследования омега-3 ПНЖК: об эффективности, доказательности и перспективах // Сердце. 2011. № 5. С. 263–272.
3. Gates S., Brocklehurst P., Davis L.J. et al. Prophylaxis for venous thromboembolic disease in pregnancy and the early postnatal period // Cochrane Database Syst. Rev. 2002. № 2. CD001689.
4. Di Micco P., D'uva M., Strina I. et al. Recurrent pregnancy loss and thrombophilia // Clin. Lab. 2007. Vol. 53. № 5–6. P. 309–314.
5. Baek K.H., Lee E.J., Kim Y.S. Recurrent pregnancy loss: the key potential mechanisms // Trends Mol. Med. 2007. Vol. 13. № 7. P. 310–317.
6. Rodger M.A., Paidas M. Do thrombophilias cause placenta-mediated pregnancy complications? // Semin. Thromb. Hemost. 2007. Vol. 33. № 6. P. 597–603.
7. Gupta S., Agarwal A., Banerjee J., Alvarez J.G. The role of oxidative stress in spontaneous abortion and recurrent pregnancy loss: a systematic review // Obstet. Gynecol. Surv. 2007. Vol. 62. № 5. P. 335–347.
8. Громова О.А., Торшин И.Ю., Калачева А.Г., Рудаков К.В. Резолвины и нейропротектины: систематический анализ нейропротективных производных омега-3 ПНЖК // Журнал неврологии и психиатрии им. С.С. Корсакова. 2011. № 11.
9. Ueshima H., Stamler J., Elliott P. et al. Food omega-3 fatty acid intake of individuals (total, linolenic acid, long-chain) and their blood pressure: INTERMAP study // Hypertension. 2007. Vol. 50. № 2. P. 313–319.
10. Торшин И.Ю., Громова О.А., Егорова Е.Ю., Рудаков К.В. Систематический анализ молекулярных механизмов воздействия омега-3 на аритмию // Кардиология. 2011. № 5. С. 37–49.
11. Third Report of the National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III) final report / NCEP III // Circulation. 2002. Vol. 106. № 25. P. 3143–3421.
12. Sarwar N., Danesh J., Eiriksdottir G. et al. Triglycerides and the risk of coronary heart disease: 10,158 incident cases among 262,525 participants in 29 Western prospective studies // Circulation. 2007. Vol. 115. № 4. P. 450–458.
13. Goodnight S.H. Jr., Harris W.S., Connor W.E. The effects of dietary omega 3 fatty acids on platelet composition and function in man: a prospective, controlled study // Blood. 1981. Vol. 58. № 5. P. 880–885.
14. Torrejon C., Jung U.J., Deckelbaum R.J. n-3 Fatty acids and cardiovascular disease: actions and molecular mechanisms // Prostaglandins Leukot Essent Fatty Acids. 2007. Vol. 77. № 5–6. P. 319–326.
15. Torshin I.Yu. Bioinformatics in the post-genomic era: sensing the change from molecular genetics to personalized medicine. NY: Nova, 2009. 366 p.
16. Гусев Е.И., Громова О.А., Торшин И.Ю., Рудаков К.В. Систематический анализ мирового опыта изучения неврологических эффектов омега-3 ПНЖК. Часть 1. Омега-3 ПНЖК и когнитивный потенциал // Журнал неврологии и психиатрии им. С.С. Корсакова. 2011. № 12.
17. Журавлев Ю.И. Об алгебраическом подходе к решению задач распознавания или классификации // Проблемы кибернетики. 1978. Вып. 33. С. 5–68.
18. Рудаков К.В. Универсальные и локальные ограничения в проблеме коррекции эвристических алгоритмов // Кибернетика. 1987. № 2. С. 30–35.
19. Рудаков К.В., Торшин И.Ю. Вопросы разрешимости задачи распознавания вторичной структуры белка // Информатика и ее применение. 2010. Т. 4. № 2. С. 25–35.
20. Рудаков К.В. О проблемах классификации значений признаков в задачах распознавания // Международная конференция «Интеллектуализация обработки информации» (ИОИ-8). Кипр, г. Пафос, 17–23 октября 2010 г. Сб. докл. М.: МАКС Пресс, 2010. С. 81–82.
21. O'Connell S.M., Impeduglia T., Hessler K. et al. Autologous platelet-rich fibrin matrix as cell therapy in the healing of chronic lower-extremity ulcers // Wound Repair. Regen. 2008. Vol. 16. № 6. P. 749–756.
22. Громова О.А., Торшин И.Ю., Егорова Е.Ю. Интеллектуальные способности: омега-3 ПНЖК и когнитивное развитие детей // Практическая медицина. 2011. Т. 11. № 5. С. 16–21.
23. Barden A., Mas E., Henry P. et al. The effects of oxidation products of arachidonic acid and n3 fatty acids on vascular and platelet function // Free Radic. Res. 2011. Vol. 45. № 4. P. 469–476.
24. Nieuwenhuys C.M., Feijge M.A., Offermans R.F. et al. Modulation of rat platelet activation by vessel wall-derived prostaglandin and platelet-derived thromboxane: effects of dietary fish oil on thromboxane-prostaglandin balance // Atherosclerosis. 2001. Vol. 154. № 2. P. 355–366.
25. Kaminski W.E., Jendraschak E., Kiefl R., von Schacky C. Dietary omega-3 fatty acids lower levels of platelet-derived growth factor mRNA in human mononuclear cells // Blood. 1993. Vol. 81. № 7. P. 1871–1879.
26. Ramaprasad T.R., Baskaran V., Krishnakantha T.P., Lokesh B.R. Modulation of antioxidant enzyme activities, platelet aggregation and serum prostaglandins in rats fed spray-dried milk containing n-3 fatty acid // Mol. Cell. Biochem. 2005. Vol. 277. № 1–2. P. 19–26.
27. Akiba S., Murata T., Kitatani K., Sato T. Involvement of lipoxygenase pathway in docosapentaenoic acid-induced inhibition of platelet aggregation // Biol. Pharm. Bull. 2000. Vol. 23. № 11. P. 1293–1297.
28. Chen P., Vericel E., Lagarde M., Guichardant M. Poxytrins, аclass of oxygenated products from polyunsaturated fatty acids, potently inhibit blood platelet aggregation // FASEB J. 2011. Vol. 25. № 1. P. 382–388.
29. Guillot N., Caillet E., Laville M. et al. Increasing intakes of the long-chain omega-3 docosahexaenoic acid: effects on platelet functions and redox status in healthy men // FASEB J. 2009. Vol. 23. № 9. P. 2909–2916.
30. Massey R.U. Reflections from the Dean's office // Conn. Med. 1976. Vol. 40. № 3. P. 212.
31. Prisco D., Filippini M., Francalanci I. et al. Effect of n-3 fatty acid ethyl ester supplementation on fatty acid composition of the single platelet phospholipids and on platelet functions // Metabolism. 1995. Vol. 44. № 5. P. 562–569.
32. Tremoli E., Maderna P., Marangoni F. et al. Prolonged inhibition of platelet aggregation after n-3 fatty acid ethyl ester ingestion by healthy volunteers // Am. J. Clin. Nutr. 1995. Vol. 61. № 3. P. 607–613.
33. Umemura K., Toshima Y., Asai F., Nakashima M. Effect of dietary docosahexaenoic Acid supplementation on platelet function: studies in the rat femoral artery thrombosis model // Platelets. 1994. Vol. 5. № 4. P. 214–218.
34. Vanschoonbeek K., Wouters K., van der Meijden P.E. et al. Anticoagulant effect of dietary fish oil in hyperlipidemia: a study of hepatic gene expression in APOE2 knock-in mice // Arterioscler. Thromb. Vasc. Biol. 2008. Vol. 28. № 11. P. 2023–2029.
35. Yang Y.B., Li P., Liu M.L. Effects of n-3 polyunsaturated fatty acids on hemorheology and coagulation in atherosclerotic rats // Zhonghua Yi Xue Za Zhi. 2010. Vol. 90. № 28. P. 2004–2007.
36. Mori Y., Nobukata H., Harada T. et al. Long-term administration of highly purified eicosapentaenoic acid ethyl ester improves blood coagulation abnormalities and dysfunction of vascular endothelial cells in Otsuka Long-Evans Tokushima fatty rats // Endocr. J. 2003. Vol. 50. № 5. P. 603–611.
37. Nobukata H., Ishikawa T., Obata M., Shibutani Y. Long-term administration of highly purified eicosapentaenoic acid ethyl ester prevents diabetes and abnormalities of blood coagulation in male WBN/Kob rats // Metabolism. 2000. Vol. 49. № 7. P. 912–919.
38. Vanschoonbeek K., Feijge M.A., Paquay M. et al. Variable hypocoagulant effect of fish oil intake in humans: modulation of fibrinogen level and thrombin generation // Arterioscler. Thromb. Vasc. Biol. 2004. Vol. 24. № 9. P. 1734–1740.
39. Nieuwenhuys C.M., Feijge M.A., Vermeer C. et al. Vitamin K-dependent and vitamin K-independent hypocoagulant effects of dietary fish oil in rats // Thromb. Res. 2001. Vol. 104. № 2. P. 137–147.
40. Del Turco S., Basta G., Lazzerini G. et al. Effect of the administration of n-3 polyunsaturated fatty acids on circulating levels of microparticles in patients with a previous myocardial infarction // Haematologica. 2008. Vol. 93. № 6. P. 892–899.
41. Mor G. Inflammation and pregnancy: the role of toll-like receptors in trophoblast-immune interaction // Ann. N.Y. Acad. Sci. 2008. Vol. 1127. P. 121–128.
42. Romero R., Gotsch F., Pineles B., Kusanovic J.P. Inflammation in pregnancy: its roles in reproductive physiology, obstetrical complications, and fetal injury // Nutr. Rev. 2007. Vol. 65. № 12. Pt. 2. P. S194–S202.
43. Schwab J.M., Chiang N., Arita M., Serhan C.N. Resolvin E1 and protectin D1 activate inflammation-resolution programmes // Nature. 2007. Vol. 447. № 7146. P. 869–874.
44. Dona M., Fredman G., Schwab J.M. et al. Resolvin E1, an EPA-derived mediator in whole blood, selectively counterregulates leukocytes and platelets // Blood. 2008. Vol. 112. № 3. P. 848–855.
45. Von Schacky C., Angerer P. Kothny W. et al. The effect of dietary omega-3 fatty acids on coronary atherosclerosis. A randomized, double-blind, placebo-controlled trial // Ann. Intern. Med. 1999. Vol. 130. № 7. P. 554–562.
46. Sampath H., Ntambi J.M. Polyunsaturated fatty acid regulation of genes of lipid metabolism // Annu Rev. Nutr. 2005. Vol. 25. P. 317–340.
47. Worgall T.S., Sturley S.L., Seo T. et al. Polyunsaturated fatty acids decrease expression of promoters with sterol regulatory elements by decreasing levels of mature sterol regulatory element-binding protein // J. Biol. Chem. 1998. Vol. 273. № 40. P. 25537–25540.
48. Hashimoto M., Hossain S., Shido O. Docosahexaenoic acid but not eicosapentaenoic acid withstands dietary cholesterol-induced decreases in platelet membrane fluidity // Mol. Cell. Biochem. 2006. Vol. 293. № 1–2. P. 1–8.
49. Nomura S., Kanazawa S., Fukuhara S. Effects of eicosapentaenoic acid on platelet activation markers and cell adhesion molecules in hyperlipidemic patients with type 2 diabetes mellitus // J. Diabetes Complications. 2003. Vol. 17. № 3. P. 153–159.
50. Wada M., DeLong C.J., Hong Y.H. et al. Enzymes and receptors of prostaglandin pathways with arachidonic acid-derived versus eicosapentaenoic acid-derived substrates and products // J. Biol. Chem. 2007. Vol. 282. № 31. P. 22254–22256.
51. Serhan C.N., Chiang N., van Dyke T.E. Resolving inflammation: dual anti-inflammatory and pro-resolution lipid mediators // Nat. Rev. Immunol. 2008. Vol. 8. № 5. P. 349–361.
52. Mori T.A., Watts G.F., Burke V. et al. Differential effects of eicosapentaenoic acid and docosahexaenoic acid on vascular reactivity of the forearm microcirculation in hyperlipidemic, overweight men // Circulation. 2000. Vol. 102. № 11. P. 1264–1269.
53. Lorenz R., Spengler U., Fischer S. et al. Platelet function, thromboxane formation and blood pressure control during supplementation of the Western diet with cod liver oil // Circulation. 1983. Vol. 67. № 3. P. 504–511.
54. Mori T.A. Omega-3 fatty acids and blood pressure // Cell. Mol. Biol. (Noisy-le-grand). 2010. Vol. 56. № 1. P. 83–92.
55. Goodfellow J., Bellamy M.F., Ramsey M.W. et al. Dietary supplementation with marine omega-3 fatty acids improve systemic large artery endothelial function in subjects with hypercholesterolemia // J. Am. Coll. Cardiol. 2000. Vol. 35. № 2. P. 265–270.
56. De Berrazueta J.R., Gómez de Berrazueta J.M., Amado Señarís J.A. et al. A diet enriched with mackerel (Scomber scombrus)-derived products improves the endothelial function in a senior population (Prevencion de las Enfermedades Cardiovasculares: Estudio Santona: PECES project) // Eur. J. Clin. Invest. 2009. Vol. 39. № 3. P. 165–173.
57. Anderson J.S., Nettleton J.A., Herrington D.M. et al. Relation of omega-3 fatty acid and dietary fish intake with brachial artery flow-mediated vasodilation in the Multi-Ethnic Study of Atherosclerosis // Am. J. Clin. Nutr. 2010. Vol. 92. № 5. P. 1204–1213.
58. Lawson D.L., Mehta J.L., Saldeen K. et al. Omega-3 polyunsaturated fatty acids augment endothelium-dependent vasorelaxation by enhanced release of EDRF and vasodilator prostaglandins // Eicosanoids. 1991. Vol. 4. № 4. P. 217–223.
59. Eid H.M., Arnesen H., Hjerkinn E.M. et al. Effect of diet and omega-3 fatty acid intervention on asymmetric dimethylarginine // Nutr. Metab. (Lond.). 2006. Vol. 3. P. 4.
60. Грачева О.Н., Громова О.А. Дисплазия соединительной ткани во время беременности. М.: Миклош, 2012. 156 с.
61. Yaqoob P., Calder P.C. N-3 polyunsaturated fatty acids and inflammation in the arterial wall // Eur. J. Med. Res. 2003. Vol. 8. № 8. P. 337–354.
62. Kruger M.C., Coetzee M., Haag M., Weiler H. Long-chain polyunsaturated fatty acids: selected mechanisms of action on bone // Prog. Lipid. Res. 2010. Vol. 49. № 4. P. 438–449.
63. Hogstrom M., Nordstrom P., Nordstrom A. n-3 Fatty acids are positively associated with peak bone mineral density and bone accrual in healthy men: the NO2 Study // Am. J. Clin. Nutr. 2007. Vol. 85. № 3. P. 803–807.
64. Weiler H., Fitzpatrick-Wong S., Schellenberg J. et al. Maternal and cord blood long-chain polyunsaturated fatty acids are predictive of bone mass at birth in healthy term-born infants // Pediatr. Res. 2005. Vol. 58. № 6. P. 1254–1258.
65. Kanmaz T., Karakayali H., Sakallioglu A.E. et al. Polyunsaturated phosphatidylcholine protects against wound contraction in experimental skin burn injury // J. Invest. Surg. 2004. Vol. 17. № 1. P. 15–22.
66. Larson M.K., Shearer G.C., Ashmore J.H. et al. Omega-3 fatty acids modulate collagen signaling in human platelets // Prostaglandins Leukot Essent Fatty Acids. 2011. Vol. 84. № 3–4. P. 93–98.
67. Din J.N., Harding S.A., Valerio C.J. et al. Dietary intervention with oil rich fish reduces platelet-monocyte aggregation in man // Atherosclerosis. 2008. Vol. 197. № 1. P. 290–296.
68. Steffen L.M., Folsom A.R., Cushman M. et al. Greater fish, fruit, and vegetable intakes are related to lower incidence of venous thromboembolism: the Longitudinal Investigation of Thromboembolism Etiology // Circulation. 2007. Vol. 115. № 2. P. 188–195.
69. Nordoy A., Svensson B., Hansen J.B. Atorvastatin and omega-3 fatty acids protect against activation of the coagulation system in patients with combined hyperlipemia // J. Thromb. Haemost. 2003. Vol. 1. № 4. P. 690–697.
70. Gajos G., Rostoff P., Undas A., Piwowarska W. Effects of polyunsaturated omega-3 fatty acids on responsiveness to dual antiplatelet therapy in patients undergoing percutaneous coronary intervention: the OMEGA-PCI (OMEGA-3 fatty acids after pci to modify responsiveness to dual antiplatelet therapy) stady // J. Am. Coll. Cardiol. 2010. Vol. 55. № 16. P. 1671–1678.
71. Lev E.I., Solodky A., Harel N. et al. Treatment of aspirin-resistant patients with omega-3 fatty acids versus aspirin dose escalation // J. Am. Coll. Cardiol. 2010. Vol. 55. № 2. P. 114–121.
72. Carta G., Iovenitti P., Falciglia K. Recurrent miscarriage associated with antiphospholipid antibodies: prophylactic treatment with low-dose aspirin and fish oil derivates // Clin. Exp. Obstet. Gynecol. 2005. Vol. 32. № 1. P. 49–51.
73. Громова О.А., Баранов А.А., Кошелева Н.Г. и др. Роли различных форм омега-3 ПНЖК в акушерстве и неонатологии: публикация в рамках реализации Национального проекта «Здоровье». М., 2009. 64 с.
Новости на тему
Отправить статью по электронной почте
Ваш адрес электронной почты:
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.