Обострение идиопатического легочного фиброза
- Аннотация
- Статья
- Ссылки
Идиопатический легочный фиброз (ИЛФ, синонимы: идиопатический фиброзирующий альвеолит, криптогенный фиброзирующий альвеолит) является хроническим, неуклонно прогрессирующим заболеванием неизвестной этиологии, морфологическая основа которого – «обычная интерстициальная пневмония» (ОИП) (кистозные изменения, фибробластические фокусы, вовлечение периферической части ацинуса и пятнистый тип распределения морфологических изменений) [4]. Прогноз заболевания очень плохой: средняя выживаемость больных ИЛФ, по данным крупных эпидемиологических исследований, составляет около 3 лет, а выживаемость в течение 5 лет – около 30% [9].
Наиболее частой причиной смерти больных ИЛФ признана дыхательная недостаточность (около 40%), другими причинами летальности являются сердечная недостаточность (14%), бронхогенная карцинома (10%), ишемическая болезнь сердца (10%), легочные и внелегочные инфекции (7%), тромбоэмболия легочных артерий (3%) и др. [14]. Несмотря на относительно постепенное прогрессирование ИЛФ, течение заболевания может осложняться остро возникающими эпизодами ухудшения симптомов заболевания, не связанных с инфекцией дыхательных путей, тромбоэмболией ветвей легочной артерии, декомпенсацией сердечной недостаточности и другими известными факторами. Данные эпизоды острого ухудшения течения ИЛФ было предложено обозначать как обострение ИЛФ [2, 11]. Впервые на проблему развития обострений при ИЛФ обратили внимание японские врачи [11], впоследствии это осложнение ИЛФ было описано в работах клиницистов из Европы и США [3, 15].
Для определения обострения ИЛФ предложены следующие критерии [2, 11]:
- нарастание одышки в течение периода менее 1 мес;
- появление новых диффузных изменений на рентгенограмме легких;
- снижении РаО2 на 10 и более мм рт. ст.;
- отсутствие связи обострения с инфекционными факторами и сердечной недостаточностью.
Морфологические изменения при обострении иммуноферментный анализ (ИФА) включают сочетание картины ОИП и диффузного альвеолярного повреждения (ДАП) [6]. По данным исследования D.S. Kim и соавт., вероятность развития обострения у больных с ИЛФ составляет около 9% в течение 1 года [10]. Сегодня в мировой литературе представлено лишь небольшое число работ с описанием клинической и морфологической картины обострения ИЛФ [2, 3, 6, 10, 11, 15], поэтому клинико-морфологическое описание даже одного случая обострения ИЛФ представляет большой практический интерес.
Описание клинического случая больного с обострением ИЛФ
Больной П., 71 год, поступил в пульмонологическое отделение с жалобами на одышку в покое, мучительный кашель с продукцией небольшого количества слизистой мокроты, повышение температуры тела до 39 °С, потливость, слабость. Указанные жалобы появились за 10 дней до поступления в стационар. Явных причин данного ухудшения состояния (вирусные инфекции, прием новых лекарственных средств) больной назвать не мог.
В анамнезе: стаж курения около 45 пачек/лет, около 2 лет назад появление сухого кашля и одышки при физических нагрузках. При обследовании в НИИ пульмонологии Москвы установлен диагноз «Идиопатический легочный фиброз, хроническая дыхательная недостаточность», назначены преднизолон, N-ацетилцистеин. В течение последнего года больной 2 раза находился в стационаре, для проведения дополнительных обследований и коррекции терапии.
Во время предыдущей госпитализации при исследовании функции внешнего дыхания были выявлены выраженные рестриктивные вентиляционные расстройства и снижение диффузионной способности легких: FVC 51%, FEV1 47%, TLC 78%, FRC 97%, DLCO 27%, DLCO/Va 39%. Газовый анализ артериальной крови отражал умеренную гипоксемию и гипокапнию: РаО2 64 мм рт. ст., РаСО2 32 мм рт. ст., рН 7,46, SaO2 92%.
При настоящем поступлении в отделение состояние больного было расценено как тяжелое. При осмотре был выявлен диффузный теплый цианоз, тахипное (ЧД до 36 в мин), напряжение шейных мышц при дыхании в покое. Кожные покровы были теплые, сухие, периферические лимфоузлы не увеличены. Грудная клетка была обычной формы, ригидная. При аускультации легких выслушивалось ослабленное дыхание, преимущественно в нижних отделах, над всеми участками легочных полей – грубая инспираторная крепитация. Тоны сердца были приглушены, ритм правильный, тахикардия – 113 в мин, АД 100/70 мм рт. ст. Температура тела – 38,4 °С. Периферических отеков не было, отмечены изменения концевых фаланг пальцев по типу «барабанных палочек».
В связи с тяжестью состояния больного провести функциональное исследование легких не удалось. В газовом анализе артериальной крови – выраженная гипоксемия: РаО2 37 мм рт. ст., РаСО2 25 мм рт. ст., рН 7,49, НСО3 19 мэкв/мл, SaO2 76%. На ЭКГ: синусовый ритм, блокада правой ножки пучка Гиса, поворот электрической оси сердца по часовой стрелке. По данным эхокардиографии повышение систолического давления в легочной артерии до 68 мм рт. ст., среднего систолического давления в легочной артерии до 45 мм рт. ст.
По данным анализов крови: умеренный лейкоцитоз до 12,0×109, повышение СОЭ до 54 мм/час, повышение ЛДГ сыворотки крови до 618 Ед/мл (при норме до 450), повышение альвеомуцина 3EG5 до 179 Ед/мл (при норме до 70), других изменений биохимических и иммунологических параметров выявлено не было. При посеве мокроты патогенных микроорганизмов обнаружено не было.
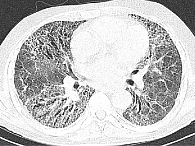
Рентгенография грудной клетки выявила картину диффузного пневмосклероза, больше выраженного в нижних и средних отделах; рассеянных очаговых теней, местами сливающихся между собой. Компьютерная томография грудной клетки соответствовала картине обычной интерстициальной пневмонии – изменения по типу «сотового легкого», нерегулярные линейные тени, утолщение междольковых перегородок, тракционные бронхоэктазы, кроме того, на фоне данных изменений выявлены диффузные изменения по типу «матового стекла» (рис. 1).
Больному проводилась терапия кислородом 5–6 л/мин через лицевую маску, терапия преднизолоном в/в 240 мг в сутки, терапия антибиотиками (цефотаксим, ципрофлоксацин). Однако, несмотря на назначенную терапию, состояние больного неуклонно ухудшалось, нарастали явления острой дыхательной недостаточности: (для поддержания SpO2 > 88% больной был переведен на маску с расходным мешком с FiO2 0,7–0,9), наблюдалось усиление одышки, увеличение тахипное до 58 в мин, тахикардии до 133 в мин. На 7-е сутки госпитализации больной умер.
На основании анамнеза, клинической картины и результатов обследования больному поставлен клинический диагноз: «Идиопатический легочный фиброз, обострение, ОДН III ст., гипоксемическая легочная гипертензия, легочное сердце».
Аутопсийное исследование. Множественные спайки плевральных полостей. Легкие с поверхности синюшно-красного цвета, средне-бугристые, при пальпации плотные, массой 1300 г. На разрезах темно-красные с выраженной сетью белесоватой ткани легких. В просветах бронхов всех калибров сероватая жидкая слизь в умеренном количестве. Стенки бронхов тонкие, сероватого цвета, не выступают над поверхностью разрезов. Лимфатические узлы бифуркации трахеи эластичные диаметром до 2 см, на разрезе черного цвета.
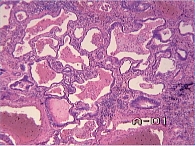
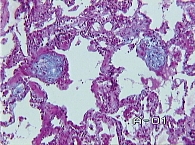
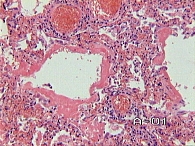
Гистологическое исследование. Легочная ткань деформирована за счет фиброза значительной части межальвеолярных перегородок с умеренным числом лимфоцитов, участки пролиферации фибробластов (рис. 2). Встречаются участки альвеол с врастающей в их просвет грануляционной тканью в виде полипов (рис. 3). В части полостей альвеол скопление альвеолярных макрофагов и альвеолоцитов II типа. В других участках широкие гиалиновые мембраны по контурам альвеол (рис. 4), очаговая пролиферация альвеолоцитов II типа и очаги плоскоклеточной метаплазии альвеолярного эпителия (бронхиолизация альвеол). Встречаются полости в 2–4 раза больше по диаметру, чем альвеолы, выстланные однорядным кубическим эпителием (см. рис. 2). Эпителий бронхов десквамирован в просвет, строение стенок бронхов и бронхиол обычное. Очаговая инфильтрация лимфоцитами стенок отдельных артериол.
Патологоанатомический диагноз.Обычная интерстициальная пневмония с микросотами в фазе обострения в виде диффузного альвеолярного повреждения.
Обсуждение
Обострение ИЛФ не является раритетным или даже редким событием: по данным D.S. Kim и соавт. развитие обострений в течение 1 года наблюдалось у 9% больных ИЛФ [10], а по данным другого крупного исследования, включавшего 168 больных ИЛФ, обострение ИЛФ предшествовало смерти больных в 47% случаев [12].
Клиническая картина обострения ИЛФ описана недостаточно полно, в основном во всех известных работах использовались критерии Kondoh и Akira [2, 11]. Наш больной полностью соответствовал данным критериям. Однако некоторые эксперты обращают внимание, что некоторые больные с обострением ИЛФ могут иметь длительность нарастания одышки больше, чем 30 дней, и тем не менее, с морфологической точки зрения, полностью укладываться в картину обострения ИЛФ, т.е. сочетание ОИП с ДАП [10]. Кроме того, есть предложения включить в критерии обострения ИЛФ маркеры альвеолярного воспаления/повреждения, например, ЛДГ или муцин KL-6 (аналог отечественного альвеоломуцина 3EG5) [19].
Причины обострения ИЛФ, как правило, остаются неизвестными. Так, в большинстве исследований, посвященных данной проблеме, предпринимались все диагностические возможности для исключения респираторных инфекций, сердечной недостаточности, но причинный фактор обострений так и не был найден [3, 10, 15]. Но иногда можно проследить связь развития обострения ИЛФ с причинным фактором. В исследовании D.S. Kim и соавт. у 3 из 11 больных обострение ИЛФ развилось после выполнения инвазивных диагностических процедур (хирургической биопсии легких или проведения БАЛ) [10]. Ассоциацию инвазивных процедур с обострениями у больных ИЛФ подтверждают описания единичных клинических случаев, в которых отмечено развитие обострений ИЛФ после проведения хирургической биопсии легких [5], резекции легких [17], БАЛ [7]. В исследовании J.P. Ultz и соавт., проанализировавшем исходы больных с интерстициальными заболеваниями легких (ИЗЛ) после хирургической биопсии легких за 10-летний период, была выявлена довольно высокая ранняя летальность больных ИЛФ через 30 дней после биопсии: 16,7%, в то же время летальность больных с другими ИЗЛ после биопсии легких составляла 1,7% [18]. В данном исследовании в 80% случаев причиной смерти больных ИЛФ после биопсии явилось острое повреждение легких. С учетом таких причинно-следственных связей, некоторые эксперты считают, что проведение инвазивных диагностических процедур является опасным мероприятием у ИЛФ в период быстрого ухудшения клинической картины, за исключением некоторых случаев, где высок риск инфекционных или онкологических осложнений. Среди возможных причин обострения ИЛФ некоторые авторы отмечают: использование противоопухолевых лекарственных средств, лучевую терапию, отмену или быстрое снижение противовоспалительных препаратов [19].
Методы имидж-диагностики, особенно компьютерная томография высокого разрешения (КТВР) –это важнейшее пособие в диагностике обострения ИЛФ. Характерными находками при обострении ИЛФ являются «новые» паренхиматозые затемнения по типу «матового стекла», реже по типу консолидации, возникающие на фоне изменений, типичных для ИЛФ (нерегулярные линейные тени, кистозные просветления, дезорганизация легочной паренхимы, тракционные бронхоэктазы) [2]. Распределение свежих паренхиматозных затемнений может иметь прогностическое значение: в исследовании M. Akira и соавт., летальность больных с диффузными паренхиматозными затемнениями составила 100%, с мультифокальными – 50%, с периферическими – 17% [2].
Морфологическим субстратом обострения ИЛФ, по данным большинства известных исследований, является сочетание ОИП и диффузного ДАП [2, 3, 6, 10, 11, 15], т.е. формирование гиалиновых мембран, реактивная гиперплазия альвеолоцитов II типа, замещение поврежденных эпителиальных клеток альвеол фибробластами и накопление коллагена (так называемая фибропролиферация) [1]. Полный набор данных признаков присутствует далеко не всегда, например в исследовании Y. Kondoh и соавт., при наличии всех признаков ДАП, ни в одном из 3 описанных случаев не было выявлено гиалиновых мембран [11]. В исследовании J.G. Parambil и соавт., при изучении биопсийного материала у больных с обострением ИЛФ были выявлены гиалиновые мембраны (в 5 из 7 случаев), плоскоклеточная метаплазия бронхиолярного эпителия (4 больных), фибриновые тромбы (1 больной) [15].
Прогноз больных с обострением ИЛФ очень плохой. Госпитальная летальность, по данным проведенных исследований, колеблется от 53 до 86% (в среднем – 75%) [2, 3, 10, 15]. Большинство больных в опубликованных работах находились на искусственной вентиляции легких. Основной причиной смерти больных с обострением ИЛФ является острая дыхательная недостаточность.
Медикаментозная терапия при обострении ИЛФ обычно включает стероиды и цитостатики. Данные об эффективности стероидов достаточно противоречивы: в исследовании Y. Kondoh и соавт., стероиды позволили значительно улучшить состояние больных с обострением ИЛФ, в других исследованиях положительный эффект стероидов показан не был [11]. Единодушного мнения о дозах стероидов также нет. Японские авторы рекомендуют проведение пульс-терапии метилпреднизолоном (500–1000 мг) в течение первых трех дней с последующим переходом на более низкие дозы [19]. O. Nishiyama и соавт. на основе успешного опыта терапии больного с обострением ИЛФ рекомендуют назначение метилпреднизолона по схеме, принятой для терапии больных с фибропролиферативной фазой острого респираторного дистресс-синдрома (ОРДС): 2 мг/с в течение 14 дней, с последующим снижением дозы [13]. Среди перспективных иммуносупрессивных препаратов для терапии обострения ИЛФ в последнее время большое внимание уделяется циклоспорину. В небольшом ретроспективном исследовании S. Homma и соавт. терапия циклоспорином в дозе 1–2 мг/кг/с привела к уменьшению летальности больных: среди 9 больных, получавших циклоспорин, выжило 6 больных (67%), эти данные выглядят очень обнадеживающими по сравнению со среднестатистическими показателями летальности больных с обострением ИЛФ [8]. В работе S. Sakamoto и соавт. средняя выживаемость среди больных с обострением ИЛФ, получавших циклоспорин, составляла 285 дней, в контрольной группе – 60 дней [16].
Антикоагулянты также входят в скудный список лекарственных препаратов, используемых у больных с обострением ИЛФ. Их потенциальная эффективность связана с предотвращением формирования тромбоза in situ, ослаблением протромботического стимула вследствие нарушения целостности альвеол и предотвращением депозиции фибрина в альвеолярном пространстве после острого повреждения легких. В проспективном исследовании, включавшем 56 больных ИЛФ, госпитализированных в стационар, в том числе и с обострением ИЛФ, было отмечено, что пациенты, получавшие терапию прямыми и непрямыми антикоагулянтами, имели лучший прогноз по сравнению с больными, не получавшими данной терапии [20]. Однако приведенное исследование не было рандомизированным и слепым, поэтому его результаты должны учитываться с определенной долей осторожности.
Респираторная поддержка и кислородотерапия являются обязательными компонентами терапии обострения ИЛФ. Тактика респираторной поддержки не отличается от той, что принята в настоящее время при остром респираторном дистресс-синдроме, – протективная вентиляция легких [21]. У ряда больных также возможно применение неинвазивной вентиляции легких, но необходимо подчеркнуть, что для данного метода респираторной поддержки необходим строгий отбор больных, главными критериями являются сохранение сознания и кооперативность больного, а также стабильная гемодинамика [22]. В целом, эффективность респираторной поддержки у больных с обострением ИЛФ очень мала [21].
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.