Мабтера (ритуксимаб) в терапии прогностически неблагоприятных вариантов В-клеточных лимфом у детей
- Аннотация
- Статья
- Ссылки
Современные программы полихимиотерапии (ПХТ), включающие дексаметазон, метотрексат, циклофосфамид, вепезид, цитозар, винкристин и антрациклиновые антибиотики, позволяют добиться выздоровления у 95–100% больных с начальными стадиями и 1–2-й прогностическими группами риска [4], в то время как при III–IV стадиях и прогностически неблагоприятных 3–4-й группах риска лечение менее эффективно – бессобытийная выживаемость (БСВ) составляет около 70% [5], что диктует необходимость поиска новых препаратов для совершенствования программ ПХТ прогностически неблагоприятных вариантов В-НХЛ. Одним из таких препаратов стала Мабтера (ритуксимаб) («Ф. Хоффман – Ля Рош Лтд», Швейцария), применение которой вместе с ПХТ (иммунохимиотерапия) значительно улучшило показатели БСВ при В-НХЛ у взрослых пациентов [6].
Ритуксимаб является химерным моноклональным анти-CD20 антителом, которое состоит из константного (человеческого) и вариабельных (мышиных) регионов. Такая структура обеспечивает высокоспецифическое связывание препарата с CD20-положительными клетками и низкую иммуногенность. Мишенью действия препарата является трансмембранный антиген CD20, который участвует в транспортировке ионов кальция через клеточную мембрану и дифференцировке В-клеток. В онтогенезе В-лимфоцита CD20 появляется на стадии пре-В-клетки и исчезает на этапе формирования плазматической клетки [7].
Механизм действия Мабтеры (ритуксимаба) обусловлен активацией компонентов комплемента (комплемент-зависимая цитотоксичность), антитело-зависимой цитотоксичностью, индукцией апоптоза, непосредственным антипролиферативным эффектом. Кроме того, ритуксимаб обладает синергизмом действия с глюкокортикостероидами и антрациклиновыми антибиотиками [8].
Максимальная концентрация Мабтеры (ритуксимаба) в плазме крови составляет 465 мг/л, а период полувыведения – 8,6 сут. Плазменный клиренс достигает 0,038 л/ч. Следы Мабтеры (ритуксимаба) можно обнаружить в организме даже через 6 мес. после его введения [9].
Исторически становление режимов ПХТ в лечении В-НХЛ шло по пути эскалации доз химиопрепаратов, результатом чего стало повышение показателей общей и БСВ [10]. В настоящее время ПХТ при В-НХЛ носит мультиагентный характер, при этом важным условием успешного лечения является соблюдение интервалов (тайминга) между блоками ПХТ [11]. Учитывая сравнительно низкие показатели БСВ при прогностически неблагоприятных группах риска у детей с В-НХЛ, предложено проведение иммунохимиотерапии с Мабтерой (ритуксимабом) у данной категории больных.
На современном этапе в детской онкогематологии режимы терапии с Мабтерой (ритуксимабом) только начинают отрабатываться. Предлагается использование Мабтеры в режиме терапевтического «окна» (за 5 дней до начала основного курса ПХТ) [12], а также непосредственно перед началом каждого блока ПХТ, изучаются возможности включения ритуксимаба в программы поддерживающей терапии [13].
Материалы и методы
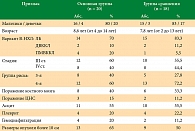
В исследование ДОГ РОНЦ было включено 38 детей, которым с октября 1999 г. по февраль 2010 г. впервые был установлен диагноз В-НХЛ, распространенная стадия (III–IV ст.), прогностически неблагоприятная (3–4-я гр.) группа риска. 18 детей составили группу сравнения, которым проводилось лечение по протоколу B-NHL-BFM95, а в программу лечения детей основной группы (n = 20) к протоколу B-NHL-BFM95 была добавлена Мабтера (ритуксимаб), которая вводилась в 0-й день каждого блока ПХТ в дозе 375 мг/м2. Согласно программе ПХТ B-NHL-BFM95 при 3-й прогностической группе риска проводится 5 блоков ПХТ, включающих дексаметазон, цитозар, винкристин, вепезид, высокие дозы метотрексата, циклофосфан, доксорубицин (АА-ВВ-СС-АА-ВВ), тогда как при 4-й группе – 6 блоков (АА-ВВ-СС-АА-ВВ-СС). Всего было проведено 112 введений Мабтеры (ритуксимаба) (при 3-й группе риска – по 5, а при 4-й группе риска – по 6 инъекций).
Стадия опухолевого процесса устанавливалась по классификации S. Murhpy [14], а прогностическая группа риска – согласно критериям, разработанным немецкой группой исследователей BFM [15]. Распространенность опухолевого процесса оценивалась с помощью методов лучевой диагностики (ультразвуковое исследование, рентгеновская компьютерная томография, а в ряде случаев – магнитно-резонансная томография) и радиоизотопных методов (67Ga и 99Tc). Статистическая обработка данных проводилась с помощью программы SRSS10.
Результаты и обсуждение
Согласно классификации опухолей кроветворной и лимфоидной тканей ВОЗ (2008) [16], на основании морфо-иммунологического и в ряде случаев цитогенетического исследования опухолевой ткани среди всех пациентов с В-НХЛ (38 детей) ЛБ была диагностирована у 76%, ДВККЛ – у 10% и ПМВККЛ – у 14% больных. Состояние детей при поступлении было тяжелым и крайне тяжелым, что обусловлено выраженным лимфопролиферативным синдромом, интоксикацией, кахексией, острой почечной недостаточностью, вызванной синдромом спонтанного опухолевого лизиса. При локализации опухоли в средостении отмечалось затруднение дыхания за счет сдавления опухолью трахеи и выраженного синдрома верхней полой вены. У большинства больных размеры опухоли превышали 10 см, у половины пациентов был выявлен опухолевый асцит, у 20% – плеврит, в 30% случаев отмечалось поражение костного мозга, у 15% больных – ЦНС. В период проведения префазы (дексаметазон и циклофосфан) протокола B-NHL-BFM95 развился синдром острого лизиса опухоли, потребовавший проведения гемодиафильтрации у 20% больных основной группы и у 11,2% детей из группы сравнения.
В целом основная группа и группа сравнения оказались сопоставимы по полу, возрасту, морфо-иммунологическому варианту В-НХЛ, стадиям и группам риска (табл. 1).
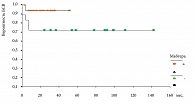
Полная ремиссия (ПР) была достигнута у 100% больных, получавших Мабтеру, показатель БСВ в этой группе составил 93,10 +/- 6,78% (медиана наблюдения 41,32 +/- 3,14 мес.). В группе сравнения ПР была получена у 72% больных, частичная ремиссия (ЧР) – у 20%. Следует отметить, что все случаи ЧР при прогностически неблагоприятных группах риска В-НХЛ закончились прогрессированием опухоли и БСВ составила 72,2 +/- 10,56% (медиана наблюдения 103,78 +/- 14,6 мес.) (рис. 1).
Переносимость ритуксимаба оказалась удовлетворительной. Побочные реакции отмечались, как правило, при первом введении препарата у 8 (40%) детей и были представлены крапивницей, кожным зудом и в одном случае бронхоспазмом. Данные реакции быстро купировались введением антигистаминных препаратов, дополнительное назначение глюкокортикоидов потребовалось 2 (10%) больным. При последующих введениях ритуксимаба побочных реакций не было.
Химиотерапию дети переносили удовлетворительно. Длительность циркуляции метотрексата после его введения в высоких дозах (5000 мг/м2) не увеличилась в обеих анализируемых группах пациентов и составила 66–72 часа. Инфекционные осложнения отмечались в различной степени у всех больных. Так, мукозит II–IV степени после проведения ПХТ с метотрексатом был выявлен у 100% детей в обеих группах. Длительность миелотоксического агранулоцитоза (МТА) составила от 3 до 7 дней, наиболее длительным был МТА после блока СС, включающего цитозар (3000 мг/м2 х 2 р/д). При оценке профиля безопасности терапии оказалось, что частота фебрильных нейтропений, гематологическая токсичность и инфекционные осложнения были сопоставимы в обеих группах больных.
Таким образом, иммунохимиотерапия по программе B-NHL-BFM95 с Мабтерой (ритуксимабом) в условиях адекватной сопроводительной терапии позволила увеличить число полных ремиссий до 100% против 72% в группе сравнения, а также улучшить показатели выживаемости детей с крайне неблагоприятными группами риска и поздними стадиями В-НХЛ. Включение Мабтеры (ритуксимаба) не привело к увеличению частоты инфекционных осложнений и усилению токсичности терапии. Следует полагать, что дальнейшие исследования, направленные на изучение молекулярно-генетических основ лимфомогенеза, позволят определить новые мишени для таргетной терапии НХЛ у детей, индивидуализировать лечение и повысить выживаемость большинства пациентов. В настоящее время можно рекомендовать использование Мабтеры в сочетании с химиотерапией у данного контингента больных.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.