Дексаметазон в терапии множественной миеломы
- Аннотация
- Статья
- Ссылки
- English
Согласно объединенным данным исследований MMY-2045, APEX и DOXIL-MMY-3001 (парный анализ 218 пациентов), вероятность достижения ответа была выше (75 против 41%, p < 0,001), а медиана выживаемости без прогрессирования (ВБП) продолжительнее (11,9 против 6,4 месяца; относительный риск (ОР) 0,595; p = 0,051) у больных, получавших комбинацию бортезомиба и дексаметазона
(40 мг в неделю), по сравнению с пациентами, принимавшими только бортезомиб.
В ранних исследованиях показано, что добавление дексаметазона к леналидомиду позволяет получить дополнительный ответ у 29% пациентов, не ответивших на монотерапию.
Все значимые клинические исследования, касающиеся применения леналидомида как при первичной, так и рецидивирующей и/или рефрактерной ММ, проводились в комбинации с дексаметазоном. В исследовании фазы II СС-4047-ММ-002 серьезно предлеченных пациентов с рецидивирующей и рефрактерной ММ с двойной рефрактерностью к леналидомиду и бортезомибу (n = 221) рандомизировали на две группы – группу помалидомида в комбинации с дексаметазоном (40 мг в неделю) и группу только помалидомида. Ответ на терапию продемонстрировали 33 и 18% больных (p = 0,013), а медиана ВБП составила 4,2 и 2,7 месяца (ОР 0,68, p = 0,003) соответственно.
Стартовую дозу дексаметазона в комбинации с другими препаратами подбирают в соответствии с возрастом и соматическим состоянием пациента.
Согласно объединенным данным исследований MMY-2045, APEX и DOXIL-MMY-3001 (парный анализ 218 пациентов), вероятность достижения ответа была выше (75 против 41%, p < 0,001), а медиана выживаемости без прогрессирования (ВБП) продолжительнее (11,9 против 6,4 месяца; относительный риск (ОР) 0,595; p = 0,051) у больных, получавших комбинацию бортезомиба и дексаметазона
(40 мг в неделю), по сравнению с пациентами, принимавшими только бортезомиб.
В ранних исследованиях показано, что добавление дексаметазона к леналидомиду позволяет получить дополнительный ответ у 29% пациентов, не ответивших на монотерапию.
Все значимые клинические исследования, касающиеся применения леналидомида как при первичной, так и рецидивирующей и/или рефрактерной ММ, проводились в комбинации с дексаметазоном. В исследовании фазы II СС-4047-ММ-002 серьезно предлеченных пациентов с рецидивирующей и рефрактерной ММ с двойной рефрактерностью к леналидомиду и бортезомибу (n = 221) рандомизировали на две группы – группу помалидомида в комбинации с дексаметазоном (40 мг в неделю) и группу только помалидомида. Ответ на терапию продемонстрировали 33 и 18% больных (p = 0,013), а медиана ВБП составила 4,2 и 2,7 месяца (ОР 0,68, p = 0,003) соответственно.
Стартовую дозу дексаметазона в комбинации с другими препаратами подбирают в соответствии с возрастом и соматическим состоянием пациента.

Множественная миелома (ММ) – злокачественная плазмоклеточная опухоль с характерными проявлениями в виде секреции моноклонального парапротеина, литического поражения костей, гиперкальциемии, анемии и почечной недостаточности. ММ чувствительна к терапии, но при этом не относится к излечимым заболеваниям [1]. Тем не менее достижения последних десятилетий в лечении ММ несомненны. С 1975–1977 гг. по 2002–2008 гг. фактическая пятилетняя общая выживаемость (ОВ) увеличилась с 25 до 46% [2]. Прогресс в лечении ММ обусловлен совершенствованием диагностических возможностей и трансплантационных технологий, а также появлением двух новых классов противоопухолевых препаратов – иммуномодулирующих агентов (талидомида, леналидомида, помалидомида) и ингибиторов протеосомы (бортезомиба, карфилозомиба).
Глюкокортикостероиды (ГКС) – производные холестерола с широким спектром биологической активности. Одним из ключевых свойств этих препаратов является способность индуцировать апоптоз в нормальных и опухолевых В-клетках, что определяет их важную роль в лечении ряда гемобластозов, включая ММ [3].
Дексаметазон – синтетический ГКС, представляющий собой метилированное производное фторпреднизолона. Широко используется в терапии ММ, обычно в комбинации с другими препаратами. Дексаметазон применяется во всех фазах лечения, включая индукцию, консолидацию и некоторые режимы поддерживающей терапии. Еще в 1992 г. исследователи из MD Anderson Cancer Center (США) установили, что высокие дозы дексаметазона (ВДД) (240 мг/м2/цикл) эффективны у 43% первичных пациентов с ММ [4].
Результаты рандомизированного исследования показали, что активность режима VAD (винкристин, доксорубицин, дексаметазон) сопоставима с таковой ВДД. Это свидетельствует о ключевой роли в данной схеме именно дексаметазона [4].
ВДД позволяют получить ответ у 40% пациентов с рецидивирующей или рефрактерной ММ [5].
Комбинация бортезомиба и дексаметазона достаточно эффективна у пациентов как с первичной [6], так и с рецидивирующей и/или рефрактерной ММ [7].
В исследованиях in vitro показано, что дексаметазон и леналидомид обладают синергичным противоопухолевым эффектом в отношении клеток миеломных линий [8]. Комбинация иммуномодулятора (леналидомида, помалидомида) и дексаметазона считается общепринятым стандартом в лечении рецидивирующей и рефрактерной ММ [9, 10].
Механизм действия дексаметазона при множественной миеломе
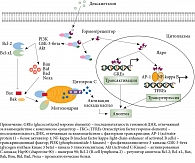
Все ГКС проникают через клеточную мембрану посредством пассивной диффузии и связываются с глюкокортикостероидным рецептором (РГКС), расположенным в цитоплазме. Диффузии способствуют небольшой размер и липофильная структура этих гормонов. РГКС относится к ядерным рецепторам и кодируется геном NR3C1, структурно расположенным на 5-й хромосоме (регион 5q31) [11]. Полимодальные эффекты РГКС в разных типах клеток зависят от его изоформ. В результате альтернативного сплайсинга (процесс, позволяющий одному гену производить несколько мРНК и соответственно белков) продуцируется пять изоформ РГКС: доминирующие GR-альфа и GR-бета и менее изученные, более редкие варианты GR-гамма, GR-A и GR-P [3].
Не связанный с гормоном РГКС находится в цитоплазме клетки в составе белкового комплекса, включающего помимо него белок теплового шока hsp90 и еще нескольких протеинов, оказывающих ингибиторное влияние на рецептор [12]. Молекула hsp90 действует как шаперон, который не позволяет РГКС попасть в ядро клетки в не связанном с гормоном состоянии. Транскрипция при этом не запускается. После присоединения лиганда комплекс «РГКС – белок теплового шока» распадается, рецептор фосфорилируется и переносится в ядро, где взаимодействует с другими транскрипционными факторами, кофакторами и ДНК (рис. 1).
Передвигаясь по ДНК, комплекс «гормон – рецептор» способен индуцировать или подавлять экспрессию специфических таргетных генов посредством связывания с отвечающими элементами, локализованными в промоторных регионах этих генов (трансактивация) [13]. При этом трансляция соответствующих белков либо усиливается, либо подавляется. Такой механизм действия получил название геномного эффекта ГКС. Ген BCL2L11 кодирует проапоптотический белок Bim и привлекается в качестве ключевого гена смерти, вовлеченного в механизм индуцированного ГКС апоптоза, в том числе лимфоидных клеток [14, 15]. Трансактивация строго регулируется и обязательна для индукции ГКС апоптоза, протекающего по внутреннему митохондриальному пути [3, 14]. Ген TSC22D3 кодирует индуцируемый ГКС белок, структурно представляющий так называемую лейциновую застежку (GILZ) – самый мощный регулятор подконтрольных ГКС генов [16]. Белок GILZ вовлекается в множество сигнальных путей, включая ядерный фактор NF-kappa B и Ras, а также служит критичным медиатором для реализации терапевтического эффекта ГКС [16]. После освобождения от ДНК рецептор экспортируется в цитоплазму и повторно становится полностью компетентным для связывания лиганда и проведения сигнала [17].
Кроме того, комплекс «гормон – рецептор» способен связываться с другими транскрипционными факторами, находящимися в цитоплазме (трансрепрессия), в результате чего запускаются механизмы, получившие название негеномных. Наиболее вероятными мишенями для репрессивного воздействия дексаметазона и других ГКС, приводящего к апоптозу, служат два транскрипционных фактора: NF-kappa B [18] и активирующий белок AP-1 [19].
MM – молекулярно гетерогенное заболевание с хромосомными нарушениями, которые включают полные и частичные делеции 13-й или 17-й хромосомы, амплификацию 1q21, рекуррентные транслокации 14q32 или гипердиплоидность [20]. В отличие от нормальных плазмоцитов в миеломных клетках отмечается высокая экспрессия генов MMSET, FGFR3, CCND3, CCND1, MAF и MAFB, которые являются партнерскими генами для транслокации 14q32 [21]. В случае возникновения мутации в области протоонкогена MAF прогноз крайне неблагоприятный. Подобные мутации сопровождаются гиперэкспрессией генов c-MAF, MAFB, MAFA и наблюдаются при транслокациях t(14;16) и t(14;20) [22].
В исследованиях in vitro миеломные клеточные линии с экспрессией MAF и MMSET оказались чувствительными к проапоптотическому эффекту дексаметазона, а CCND1 – рефрактерными [23].
Фармакокинетика дексаметазона
После приема внутрь дексаметазон быстро и хорошо всасывается из желудочно-кишечного тракта (биодоступность – 70–80%), а максимальная концентрация достигается через один-два часа. С белками плазмы крови связывается до 70% препарата, в основном с транскортином. Дексаметазон легко преодолевает гистогематические барьеры, включая гематоэнцефалический и плацентарный [24]. Объем распределения составляет 2 л/кг. Биотрансформация в основном осуществляется в печени посредством конъюгации с глюкуроновой и серной кислотами до неактивных растворимых метаболитов. Выводится почками (максимум) и через кишечник, проникает в грудное молоко. Период полувыведения из крови составляет 1,8–3,5 часа, из тканей – 36–54 часа. У пациентов с хронической почечной недостаточностью экскреция дексаметазона не нарушается, коррекции доз не требуется [25].
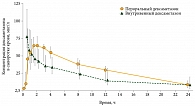
Фармакокинетика дексаметазона зависит от способа введения. В исследовании, проведенном с участием пациентов с внебольничной пневмонией, было показано, что 6 мг перорального дексаметазона эквивалентно приблизительно 4 мг препарата, введенного внутривенно (рис. 2) [26].
У больных с кожной патологией 300 мг перорального дексаметазона при расчете площади под фармакологической кривой соответствовало 184 мг при внутривенном способе введения [27].
Особенности фармакокинетики дексаметазона при разных способах введения у пациентов с ММ не изучены. В большинстве клинических исследований в данной области использовался пероральный дексаметазон.
Дексаметазон в комбинации с другими противомиеломными препаратами
Сведения об активности бортезомиба при рецидивирующей и/или рефрактерной ММ получены в ходе двух клинических исследований фазы III APEX [28] и DOXIL-MMY-3001 [29].
На монотерапии бортезомибом у пациентов, получивших от одной до трех линий терапии, частота достижения общего ответа составила 41–43%, включая 2–9% полных ремиссий, медиана времени до прогрессирования (ВДП) – 6,2–6,5 месяца, ОВ – 29,8 месяца. В нескольких исследованиях фаз II и III было продемонстрировано, что добавление дексаметазона к бортезомибу существенно улучшает результаты [30–32].
В ретроспективном анализе объединенных данных исследований MMY-2045, APEX и DOXIL-MMY-3001 были выделены для парного сравнения две группы по 109 пациентов, получавших бортезомиб в комбинации с низкими дозами дексаметазона (НДД) (160 мг/цикл) или только бортезомиб [33]. Медианы кумулятивной дозы бортезомиба (27,02 и 28,60 мг/м2) и продолжительности терапии (19,6 и 17,6 недели) были сходными в обеих группах. Вероятность достижения ответа была выше (75 против 41%; относительный риск (ОР) 3,467; p < 0,001), а медианы ВДП (13,6 против 7,0 месяца; ОР 0,394; p = 0,003) и выживаемости без прогрессирования (ВБП) (11,9 против 6,4 месяца; ОР 0,595; p = 0,051) продолжительнее у пациентов, получавших комбинацию бортезомиба и дексаметазона, по сравнению с больными, принимавшими только бортезомиб. Различий по частоте нежелательных явлений всех степеней и случаев прекращения терапии вследствие токсичности не выявлено. Эти данные подтверждают потенциальную пользу включения дексаметазона в бортезомиб-содержащие схемы лечения рецидивирующей и/или рефрактерной ММ.
Комбинация иммуномодулирующих препаратов (Immunomodulatory Drugs, IMiDs) с дексаметазоном также считается общепринятым стандартом лечения рецидивирующей и/или рефрактерной ММ [1]. Первые клинические данные о том, что дексаметазон повышает активность IMiDs, были получены для талидомида.
В одном из первых исследований 28 пациентов с первичной ММ принимали талидомид в стартовой дозе 100–200 мг/сут с еженедельным повышением до максимально переносимой 600 мг/сут [34]. Половина больных параллельно получала дексаметазон (240 мг/м2/цикл). У пациентов обеих групп терапия продолжалась не менее трех месяцев. На терапию ответили 36% больных из группы талидомида и 72% – из группы талидомида и дексаметазона. Только во второй группе в 16% случаев была документирована полная ремиссия. Медиана времени до достижения ответа составила 4,2 и 0,7 месяца соответственно. Различий в токсичности между группами не зафиксировано. Авторы сделали однозначный вывод в пользу комбинации талидомида и дексаметазона.
Все значимые клинические исследования, касающиеся тестирования леналидомида как при первичной [35], так и рецидивирующей и/или рефрактерной ММ, проводились в комбинации с дексаметазоном [36].
В ранних исследованиях было показано, что добавление дексаметазона к леналидомиду позволяет получить ответ у пациентов, которые не ответили на монотерапию. В частности, в одном из исследований фазы II с участием
102 пациентов ответа на терапию достигли 25% больных с рецидивирующей и рефрактерной ММ. Для усиления терапии рефрактерным пациентам добавили дексаметазон (40 мг/сут в 1–4-й и 15–18-й дни; суммарно 320 мг/цикл), что позволило получить дополнительный ответ еще у 20 (29%) из 68 пациентов [37].
Значимость дексаметазона в комбинации с помалидомидом была протестирована в сравнительном клиническом исследовании фазы II [38]. В протокол СС-4047-ММ-002 включались пациенты с рецидивирующей и рефрактерной ММ, которые ранее обязательно получали леналидомид и бортезомиб и прогрессировали непосредственно на последней линии терапии или в пределах 60 дней после ее окончания. Больные получали помалидомид (4 мг/сут в 1–21-й/28-й дни) ± НДД (160 мг/цикл). Ключевой целью исследования была оценка ВБП. Участников исследования (n = 221) (медиана количества линий предшествующей терапии – 5, разброс – 1–13) рандомизировали в группу помалидомида и НДД (n = 113) и в группу только помалидомида (n = 108). На терапию ответили 33 и 18% больных (p = 0,013) соответственно. Медиана ВБП составила 4,2 и 2,7 месяца (ОР 0,68; p = 0,003), медиана ОВ – 16,5 и 13,6 месяца соответственно. Основным нежелательным явлением 3–4-й степени была нейтропения, частота которой не различалась между группами (41 против 48%). В дальнейших исследованиях помалидомид тестировали исключительно в комбинации с НДД. Такая комбинация вошла в категорию рекомендованных методов лечения рецидивирующей и рефрактерной ММ [39].
Данные о токсичности дексаметазона у пациентов с множественной миеломой
Современные данные о токсичности дексаметазона у пациентов с ММ получены в результате проведения нескольких клинических исследований фазы III, в которых группу сравнения составляли пациенты, получавшие только ВДД [10, 36].
В общей сложности в два параллельных исследования фазы III ММ-009 и 010 было включено 704 пациента с ММ, прогрессирующей после по крайней мере одной линии терапии [36]. Больных рандомизировали на две равные группы – леналидомида (25 мг/сут в 1–21-й/28-й дни) и ВДД (40 мг/сут в 1–4-й, 9–12-й и 17–20-й дни; суммарно 480 мг/цикл) либо плацебо и ВДД. В случае прогрессирования заболевания пациенты из второй группы могли переходить в открытое исследование с леналидомидом. В группе ВДД основными проявлениями токсичности 3-й степени и выше были нейтропения (3,4%), тромбоцитопения (6,3%), анемия (6,0%), гипергликемия (7,7%), гипокалиемия (1,4%), пневмония (5,4%), тромботические осложнения (5,4%), слабость (4,9%), астения (5,1%).
В многоцентровое исследование фазы III СС-4047-ММ-003 было включено 455 пациентов с рецидивирующей и рефрактерной ММ, одновременно рефрактерной к бортезомибу и леналидомиду [10]. Это были серьезно предлеченные пациенты (медиана количества линий терапии в анамнезе – 5, разброс – 2–17), из которых 74% были одновременно рефрактерными к бортезомибу и леналидомиду. Пациентов в соотношении 2:1 рандомизировали в группу помалидомида (4 мг в 1–21-й/28-й дни) в комбинации с НДД (40 мг/сут в 1-й, 8-й, 15-й и 22-й дни; суммарно 160 мг/цикл) и группу только ВДД (480 мг/цикл). Около половины больных из группы ВДД в точке прогрессирования перешли в дополнительное открытое исследование с помалидомидом (ММ-003/С). Группа терапии ВДД состояла из 153 пациентов. Наиболее частыми нежелательными явлениями у них были анемия (37%), тромбоцитопения (26%), нейтропения (16%), пневмония (10%) и астения (6,0%). Благодаря введенной в этом исследовании профилактике (низкомолекулярные гепарин, аспирин) случаев тяжелых тромбоэмболических осложнений на фоне терапии ВДД не наблюдалось. Бóльшая частота нежелательных явлений в данном исследовании была обусловлена колоссальной предлеченностью набранной когорты больных.
Длительное применение ГКС в комбинации с IMiDs, очевидно, несет в себе определенные противоречия. С одной стороны, доказано, что дексаметазон и IMiDs обладают синергичным непосредственным цитотоксическим эффектом в отношении клеток ММ. С другой стороны, иммуносупрессивный эффект тормозит иммуномодулирующий эффект в отношении T- и NK-клеток, являющийся важной составляющей глобального успеха терапии [8]. Наиболее активно дексаметазон угнетает «наивные» Т-лимфоциты (CD45RA+) на ранних этапах активации, зависимых от интерлейкина 2, а примированные клетки памяти (CD45RO+) – на поздних независимых стадиях [40]. С клинических позиций важно, что длительное применение ВДД сопровождается повышением инфекционной смертности, особенно у пожилых пациентов [41]. Согласно консенсусу ведущих европейских экспертов в области ММ, стартовую дозу дексаметазона в комбинации с другими препаратами следует выбирать в соответствии с возрастом пациента (см. таблицу) [42, 43]. С учетом общего состояния пациента и спектра коморбидных состояний стартовая доза может быть снижена по сравнению с рекомендуемой.
В отношении первичной ММ однозначно показано преимущество комбинации леналидомида и НДД по сравнению с ВДД. В исследование Е4А03 Восточной онкологической группы (США) было включено 455 пациентов с первичной симптоматической ММ [35]. Все пациенты получали леналидомид (25 мг/сут в 1–21-й/28-й дни). Рандомизация заключалась в назначении в равной пропорции либо ВДД (480 мг/цикл), либо НДД (160 мг/цикл). После четырех циклов больные могли получать аутологичную трансплантацию стволовых гемопоэтических клеток либо продолжать принимать участие в исследовании вплоть до прогрессирования. Вероятность достижения ответа после первых четырех циклов была выше в группе ВДД (ОР 1,75; 80%-ный доверительный интервал (ДИ) 1,30–2,32; p = 0,008). Однако однолетняя ОВ в группе НДД оказалась лучше (96%; 95% ДИ 94–99), чем в группе ВДД (87%; ДИ 82–92; p = 0,0002). Терапия ВДД была остановлена, и больных перевели на НДД. Ухудшение ОВ было связано с большей токсичностью. Нежелательные явления 3-й степени и выше в течение первых четырех месяцев в группе ВДД имели место у 52% пациентов. В группе НДД этот показатель составил 35% (p = 0,0001). Наиболее частыми нежелательными явлениями 3-й степени и выше были тромбозы глубоких вен (26 против 12%; p = 0,0003), инфекции, включая пневмонию (16 против 9%; p = 0,04), и слабость (15 против 9%; p = 0,08).
Высокая стартовая доза дексаметазона (480 мг/цикл) рекомендуется только для пациентов с такими неотложными состояниями, как почечная недостаточность, гиперкальциемия и компрессия спинного мозга опухолевыми массами, когда необходимо получить максимально быстрый ответ [42]. В отношении пациентов, достигших стабильного ответа на терапии IMiDs и дексаметазоном, нет общепризнанного мнения и доступных данных о том, как долго следует применять дексаметазон и можно ли в какой-то временной точке прекратить его прием.
S.V. Semochkin
Russian National Research Medical University named after N.I. Pirogov
Contact person: Sergey Vyacheslavovich Semochkin, semochkin_sv@rsmu.ru
Dexamethasone is a synthetic glycocorticosteroid capable to induce apoptosis in tumor B cells. It is one of dexamethasone main properties that determines its important role in treatment of some hematology malignancies including multiple myeloma (MM). Dexamethasone is usually combined with other drugs and applied to all phases of treating MM including induction, consolidation and other regimens of supportive therapy. According to the combined data from three clinical trials MMY-2045, APEX and DOXIL-MMY-3001 (score-matched pairs analysis of 218 patients) the overall response rate was higher (75% vs. 41%; p < 0.001), and median progression-free survival (PFS) were longer (11.9 vs. 6.4 months; hazard ratio [HR] 0.595; p = 0.051) with bortezomib and dexamethasone (40 mg/week) versus bortezomib, respectively. In earlier studies, it has shown that combination of dexamethasone to lenalidomide allows to receive an additional therapeutic response for 29% patients resistant to monotherapy. All key clinical studies related to use of lenalidomide both during primary and relapsed and/or refractory MM were conducted with dexamethasone combination. In clinical phase II study СС-4047-ММ-002 all intensively pre-treated patients with relapsed and refractory MM and who were double resistant to both lenalidomide and bortezomib (n = 221) were randomized into two groups: patients treated with pomalidomide combined with dexamethasone (40 mg/week) and patients treated with pomalidomide alone. The overall response rate was documented for 33% and 18% patients (p = 0.013), and median PFS was 4.2 and 2.7 months (HR 0.68, p = 0.003), respectively. A starting dose of dexamethasone combined with other drugs shouldbe determined according to age and comorbidities of individual patient.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.