Оптимальный менеджмент коморбидных пациентов со спондилоартритами: фокус на сердечно-сосудистую безопасность
- Аннотация
- Статья
- Ссылки
- English
ИЛ-17А представляет собой универсальный провоспалительный цитокин Т-клеток. В то же время существуют данные о том, что ИЛ-17А участвует во многих других патологических процессах: ремоделировании костной ткани, развитии дисфункции эндотелия, формировании нестабильных атеросклеротических бляшек, ремоделировании желудочков сердца после ишемической атаки и др. Клинические данные подтверждают роль гиперпродукции ИЛ-17А в развитии тяжелых сердечно-сосудистых заболеваний. На примере препарата секукинумаб продемонстрировано, что ингибирование ИЛ-17А при ПсА и аксСпА сопровождается высоким уровнем сердечно-сосудистой безопасности и, вероятно, может способствовать снижению сердечно-сосудистого риска.
Наряду с общепринятыми методами коррекции традиционных факторов риска терапия ингибиторами ИЛ-17А, в частности секукинумабом, может быть перспективным направлением эффективного менеджмента пациентов с СпА и сопутствующими сердечно-сосудистыми заболеваниями.
ИЛ-17А представляет собой универсальный провоспалительный цитокин Т-клеток. В то же время существуют данные о том, что ИЛ-17А участвует во многих других патологических процессах: ремоделировании костной ткани, развитии дисфункции эндотелия, формировании нестабильных атеросклеротических бляшек, ремоделировании желудочков сердца после ишемической атаки и др. Клинические данные подтверждают роль гиперпродукции ИЛ-17А в развитии тяжелых сердечно-сосудистых заболеваний. На примере препарата секукинумаб продемонстрировано, что ингибирование ИЛ-17А при ПсА и аксСпА сопровождается высоким уровнем сердечно-сосудистой безопасности и, вероятно, может способствовать снижению сердечно-сосудистого риска.
Наряду с общепринятыми методами коррекции традиционных факторов риска терапия ингибиторами ИЛ-17А, в частности секукинумабом, может быть перспективным направлением эффективного менеджмента пациентов с СпА и сопутствующими сердечно-сосудистыми заболеваниями.

Введение
При ревматических заболеваниях (РЗ) коморбидность и мультиморбидность наблюдаются часто, причем развитие или прогрессирование сопутствующей патологии нередко находится в патогенетической взаимосвязи с активностью воспалительного процесса. Именно поэтому РЗ фактически могут рассматриваться как факторы риска возникновения различных общетерапевтических заболеваний [1].
Сложность патогенеза РЗ приводит к множественным патогенетическим перекрестам с другой патологией, поскольку активация иммунных механизмов и воспаление являются универсальными реакциями на воздействие внешней среды [2].
Сосуществующие с РЗ коморбидные состояния оказывают комплексное негативное влияние на организм. На примере ревматоидного артрита (РА) показано [2], что к серьезным последствиям коморбидности относятся:
- коморбидные заболевания, в первую очередь сердечно-сосудистые – риск преждевременной смерти;
- коморбидные состояния, например метаболический синдром, ожирение, – риск торпидного течения воспалительного процесса и более тяжелого течения РЗ;
- коморбидные состояния – ограничения при выборе методов лечения, например наличие хронических инфекционных процессов может препятствовать назначению иммуносупрессивной терапии.
Наличие коморбидности и мультиморбидности имеет важное значение не только в ревматологической, но и в общей врачебной практике. Негативное влияние коморбидных состояний хорошо известно при самых разных заболеваниях.
Предложено несколько вариантов количественной оценки коморбидности. С этой целью наиболее широко используется индекс Charlson [3], разработанный M.E. Charlson, профессором медицины, заведующей кафедрой общей внутренней медицины и председателем программы магистратуры в области клинической эпидемиологии и исследований служб здравоохранения в медицинском колледже Weill Cornell (Нью-Йорк, США) [4]. Исходя из оценки основных коморбидных состояний, а также возраста, с помощью данного индекса можно рассчитать прогноз риска смерти в ближайшие десять лет.
Мы использовали индекс Charlson для оценки влияния коморбидности на возможность назначения генно-инженерных биологических препаратов у пациентов с иммуновоспалительными ревматическими заболеваниями в реальной клинической практике ревматологического отделения ГБУЗ МО «МОНИКИ им. М.Ф. Владимирского». Ретроспективный анализ данных 218 пациентов, среди которых преобладали больные РА (38%) и спондилоартритами (СпА) (37%), показал, что генно-инженерные биологические препараты в отсутствие сопутствующей патологии назначались в 81,8% случаев, при наличии таковой – индекс Charlson 1–2 и 3 балла и выше – в 55,3 и 36,3% случаев соответственно. Таким образом, коморбидность оказывает непосредственное влияние на применение биологической терапии у больных РЗ, что ограничивает возможность контроля активности заболевания [5].
Результаты нашего исследования наряду с результатами многих других исследований подчеркивают значимость оценки коморбидности у больных СпА.
Роль сопутствующей патологии при СпА, которыми часто страдают лица молодого возраста, до сих пор недооценивается, хотя ее значение не менее важно, чем при РА и других РЗ.
Коморбидные состояния при спондилоартритах и их значение
К группе СпА относят пациентов с аксиальным спондилоартритом (аксСпА), включая анкилозирующий спондилит (АС) и нерентгенологический аксСпА, а также с периферическими СпА, наиболее частым и типичным представителем которых является псориатический артрит (ПсА).
Распространенность коморбидности среди лиц, страдающих СпА, весьма значительна и выше, чем в общей популяции. Так, в международном исследовании ASAS-COMOSPA с участием 3984 больных СпА из 22 стран четырех континентов установлено, что наиболее частыми сопутствующими заболеваниями были артериальная гипертензия (АГ) – 34%, гиперхолестеринемия – 27%, остеопороз – 13% и язвенная болезнь желудка и двенадцатиперстной кишки – 11% [6]. Авторы исследования также отметили широкую распространенность курения – 29% случаев. Коморбидность приводит к более выраженным функциональным нарушениям, ухудшению качества жизни, повышенному риску нетрудоспособности и смерти [7, 8].
Согласно рекомендациям экспертов Европейской лиги против ревматизма, в отношении регистрации, скрининга и профилактики сопутствующих заболеваний при хронических воспалительных РЗ в клинической практике СпА относятся к заболеваниям, требующим специального контроля над коморбидными состояниями [9]. При СпА, так же как при РА и многих других РЗ, на первом месте по значимости стоят сердечно-сосудистые заболевания (ССЗ), включая ишемическую болезнь сердца (ИБС) и острый инфаркт миокарда (ОИМ), инсульт и разнообразную цереброваскулярную патологию, заболевания периферических сосудов и венозную тромбоэмболию. Это связано с повышением риска смертельного исхода от ССЗ, занимающего ведущее место в структуре общей смертности [10].
Доказано, что у больных ПсА увеличен риск развития ССЗ по сравнению с общей популяцией [11]. Метаанализ 11 крупных исследований продемонстрировал, что у пациентов с ПсА по сравнению с общей популяцией риск развития ССЗ выше на 43%, ОИМ, цереброваскулярных заболеваний, сердечной недостаточности – на 68% [12]. Датское общенациональное исследование, в которое был включен 34 371 пациент с легкой формой псориаза и 2621 – с тяжелой, в том числе 607 больных ПсА, показало, что заболеваемость ССЗ и смертность от них возрастает у лиц с псориазом и ПсА, при этом указанные риски сопоставимы с таковыми при сахарном диабете [4].
В рамках российского исследования РЕМАРКА [14] при оценке традиционных факторов сердечно-сосудистого риска (ТФР) у пациентов с ранним ПсА (медиана возраста – 36 (27–46) лет, медиана длительности заболевания – 5 (3–7) месяцев) у 44% была выявлена АГ, у 56% – абдоминальное ожирение, у 64% – факт курения, у 56% – дислипидемия. Сочетание трех и более ТФР ССЗ обнаружено у 48% пациентов. При ультразвуковом исследовании сонных артерий атеросклеротические бляшки обнаружены у 32% больных, увеличение толщины комплекса «интима – медиа» более 0,9 мм также у 32%.
Несмотря на более молодой возраст пациентов с аксСпА, коморбидные состояния у них встречаются часто и отягощают течение болезни. У страдающих АС повышен риск возникновения множественных сопутствующих заболеваний, включая сердечно-сосудистые, неврологические, легочные, желудочно-кишечные, эндокринные, гематологические и психические. Однако чаще всего наблюдаются АГ и язвы верхних отделов желудочно-кишечного тракта [15]. Китайские исследователи при наблюдении за 4794 больными АС в возрасте от 18 до 45 лет обнаружили, что даже в такой молодой популяции риск развития ИБС примерно в полтора раза выше по сравнению с общей популяцией, при этом риск возрастал по мере увеличения продолжительности патологии [16].
Кластерный анализ коморбидных состояний у пациентов с аксСпА показал, что наиболее распространенными коморбидными кластерами были те, в которых доминировали АГ/ИБС и депрессия/тревожность. Кроме того, кластеры депрессии/тревожности и фибромиалгии/синдрома раздраженного кишечника были связаны с более низкими показателями качества жизни [17].
В крупном международном исследовании установлено, что коморбидные заболевания при СпА отрицательно влияли на физическую функцию, работоспособность и качество жизни [18], поэтому их важно учитывать в повседневной клинической практике.
На сегодняшний день разными группами экспертов разработаны разные варианты чек-листов для оценки коморбидных состояний при аксСпА [19, 20]. Реальную значимость этих методов еще предстоит установить.
Таким образом, становится общепринятым, что оценка коморбидных состояний при СпА должна внедряться в клиническую практику. Другим важным аспектом является возможность вторичной профилактики прогрессирования коморбидной патологии с помощью современной патогенетической терапии.
Патогенез спондилоартритов и коморбидность
Считается, что симптоматика СпА развивается как следствие активации воспалительных путей, вызванных дисбиозом кишечника, механическим стрессом и генетическими факторами [21]. Патогенетически близкие процессы происходят в коже при псориазе, кишечнике, суставах и энтезисах, что подчеркивает близость механизмов, лежащих в основе всех СпА, несмотря на значительное клиническое разнообразие. В коже стрессированные кератиноциты высвобождают ДНК. Это стимулирует дендритные клетки, которые запускают дифференцировку Т-хелперов (Th) 1 и 17. Активированные Th1- и Th17-лимфоциты в свою очередь высвобождают интерлейкин (ИЛ) 12, 17 и 22, а также фактор некроза опухоли (ФНО), которые способствуют пролиферации кератиноцитов и развитию воспаления. В кишечнике наблюдается микробный дисбиоз, который может вызвать воспаление в подвздошной кишке и стимулировать Th17 к высвобождению ИЛ-23, участвующего в активации Т-лимфоцитов. При травме или биомеханическом стрессе в месте прикрепления сухожилия (энтезис) высвобождается ИЛ-23, который активирует Th17 и индуцирует выброс цитокинов, таких как ИЛ-22 и ФНО, что приводит к воспалению, эрозированию и аномальному формированию кости. ИЛ-22 и другие факторы стимулируют дифференцировку мезенхимальных клеток в остеобласты, образующие энтезофиты в периферических энтезах и суставах и синдесмофиты в позвоночнике [22].
Исследования различного дизайна подтвердили, что ось цитокинов ИЛ-23/ИЛ-17 играет важнейшую роль в патогенезе СпА. Особый вариант ремоделирования костной ткани (костный фенотип), который имеет место при ПсА и АС, – потеря костной массы, появление костных эрозий и даже остеолиза, и в то же время новообразование периостальной и энтезиальной костей с формированием остеофитов/синдесмофитов, вероятно, является результатом совместного воздействия этих цитокинов на кость. За последние годы появилось все больше доказательств, что семейство ИЛ-17, а именно ИЛ-17A, может рассматриваться как ключевое при СпА [23].
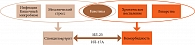
ИЛ-17A представляет собой универсальный провоспалительный цитокин Т-клеток, синтез которого может модулироваться элементами как врожденного, так и приобретенного иммунитета. ИЛ-17А стимулирует хроническое пролиферативное воспаление и активно влияет на метаболизм костной ткани. Многогранное воздействие ИЛ-17А на разные популяции иммунных и неиммунных клеток может обусловливать развитие коморбидных состояний параллельно с основным заболеванием (рис. 1) [21].
ИЛ-17 и сердечно-сосудистая патология
ИЛ-17А участвует в процессах повреждения миокарда. Повышение сывороточных уровней ИЛ-17А и ИЛ-18 ассоциировано с развитием ИБС (ОИМ и нестабильной стенокардией) [24]. Однако такая связь была выявлена не во всех исследованиях [25]. Может представлять интерес работа, в которой было обнаружено повышение сывороточного уровня ИЛ-17А у пациентов с ИБС и периодонтитом [26], особенно в свете рассмотрения дисбиоза/микробной контаминации ротовой полости как триггера аутоиммунных расстройств. В ходе компактного российского исследования установлена корреляционная связь между риском возникновения значимых сердечно-сосудистых событий, уровнем С-реактивного белка (СРБ) и носительством различных аллелей генов ИЛ-17A и ИЛ-17F [27]. В эксперименте показано, что ИЛ-17А участвует в ремоделировании желудочков сердца после ишемической атаки, способствуя развитию желудочковых аритмий [28]. В достаточно крупном (n = 502) исследовании с использованием коронарной ангиографии продемонстрировано, что комбинация сывороточных уровней ИЛ-17 и ИЛ-12 в сочетании с некоторыми ТФР позволяет оценить тяжесть поражения коронарных артерий [29]. Кроме того, установлено, что Th17-лимфоциты, для которых характерна продукция ИЛ-17, могут служить характерным признаком повреждения миокарда в острой фазе миокардита [30].
ИЛ-17А вовлечен в патогенез атеросклероза. Эта связь признана двусторонней. Ряд проатерогенных факторов, включая холестерин (ХС), модифицированные липопротеины низкой плотности (ЛПНП) и жирные кислоты, могут влиять на экспрессию ИЛ-17 как прямо, так и косвенно через цитокины, которые стимулируют секрецию ИЛ-17 [31, 32]. В то же время гиперпродукция ИЛ-17 может выполнять потенциально проатерогенную роль [33]. По-видимому, ИЛ-17A оказывает преимущественно провоспалительное воздействие на атерогенез, хотя в литературе представлены частично противоречивые результаты (главным образом в эксперименте). Несколько исследователей указали на проатерогенную роль ИЛ-17A посредством регуляции количества аортальных макрофагов, Th1-связанных цитокинов и экспрессии аортальных хемокинов. У людей экспрессия ИЛ-17A была связана с повышенным воспалением и уязвимостью бляшек при атеросклеротических поражениях.
Более того, ИЛ-17 оказывал провоспалительный, протромботический, дестабилизирующий бляшки эффект. В частности, показано, что цитокин семейства ИЛ-17, а именно ИЛ-17C из клеток гладкой мускулатуры, играет стимулирующую атерогенез роль посредством рекрутирования провоспалительных Т-клеток в ткани аорты [34–36]. Сывороточные уровни ИЛ-17 и ИЛ-23 положительно коррелировали с уровнями ХС (p < 0,001), ЛПНП (p < 0,001) и триглицеридов (p < 0,05) [37]. В эксперименте ИЛ-17A значительно повышал нестабильность атеросклеротических бляшек с накоплением липидов, Т-клеток и одновременным уменьшением числа гладкомышечных клеток. В условиях in vitro ИЛ-17A способствовал апоптозу макрофагов в присутствии окисленных ЛПНП. Кроме того, ИЛ-17A повышал экспрессию хемокинов MCP-1 и CXCL-10 в бляшках, регулировал накопление тучных клеток и макрофагов, а также апоптоз в бляшках [38].
ИЛ-17 существенно влияет на функцию эндотелия сосудов. В эксперименте показано, что ИЛ-17 активирует RhoA/Rho-киназу – один из важнейших ферментов, участвующих в регуляции специфических клеточных функций, таких как гладкомышечное сокращение или эндотелиальная секреция [39], что приводит к эндотелиальной дисфункции и гипертензии [40]. Более того, активация Th17-лимфоцитов и синтез ИЛ-17 индуцировали старение эндотелиальных клеток посредством активации сигнального пути NF-κB/p53/Rb и влияния на эндотелиальные прогениторные клетки [41, 42].
В исследовании, включавшем 210 больных с ОИМ, повышенные уровни сывороточных ФНО-α, ИЛ-1β и ИЛ-17A независимо коррелировали с риском серьезных неблагоприятных сердечно-сосудистых событий (Major Adverse Cardiovascular Events – MACE) [43].
Роль ИЛ-17А в возникновении ССЗ у больных псориазом и ПсА рассматривалась в целом ряде исследований. Так, в эксперименте гиперэкспрессия ИЛ-17A в коже вызывала системную эндотелиальную дисфункцию, сосудистый окислительный стресс, артериальную гипертензию и увеличивала частоту смертей [44]. В клинических исследованиях показано, что уровни ИЛ-17A были значительно выраженными как в псориатических элементах, так и в атеросклеротических бляшках. Эти данные свидетельствуют о том, что ИЛ-17A может быть решающим звеном в развитии псориаза и атеросклероза, а воспалительные реакции, индуцированные ИЛ-17A, вносят основной вклад в патогенез коморбидного псориаза [45].
Взаимодействие гиперпродукции ИЛ-17А при спондилоартритах и сердечно-сосудистых рисках представлено на рис. 2.
Ингибирование ИЛ-17А – подход к оптимальному менеджменту больных спондилоартритами и коморбидностью
Общепринятыми методами коррекции ТФР ССЗ у больных СпА признаны нормализация массы тела, повышение двигательной активности, диетотерапия, применение статинов, контроль АГ, коррекция нарушений углеводного обмена, отказ от курения. На основании указанных выше эпидемиологических данных и патогенетических схем представляется обоснованным включение в комплекс мер по вторичной профилактике сердечно-сосудистых катастроф препаратов, нейтрализующих ИЛ-17А, особенно с учетом того, что некоторые общепринятые методы, например аэробные упражнения, могут быть с трудом выполнимы пациентами с СпА и выраженными функциональными нарушениями. В пользу такой гипотезы свидетельствуют результаты ряда исследований, проведенных преимущественно на модели псориаза.
В экспериментах блокирование нейтрализующими антителами ИЛ-17 снижало нестабильность атеросклеротических бляшек [38] и выраженность сосудистого фенотипа с дисфункцией эндотелия и развитием АГ [44].
Клинические исследования при псориазе показали, что ингибиторы ИЛ-17A эффективно уменьшали псориатические поражения, а также симптомы атеросклероза у пациентов как с псориазом, так и с атеросклерозом [45].
По мнению E. Trovato и соавт., появление моноклональных антител, ингибирующих ИЛ-17 и ИЛ-23, позволило не только изменить терапевтический подход к псориазу, но и собрать большое количество данных, подтверждающих их эффективность в качестве терапии первой линии у пациентов с сопутствующими ССЗ и метаболическим синдромом [46]. Более того, некоторые авторы обосновывают подход лечения атеросклероза с помощью ингибирования провоспалительных цитокинов, включая ИЛ-17А [47].
Секукинумаб
Наиболее изученным препаратом из группы ингибиторов ИЛ-17А, несомненно, является секукинумаб (СЕК). Это полностью человеческое моноклональное антитело к ИЛ-17А на основе иммуноглобулина G1κ.
В крупном рандомизированном клиническом исследовании (РКИ) фазы III секукинумаба при псориатическом артрите FUTURE 1 продемонстрировано, что у больных со средним возрастом около 49 лет был достаточно низкий риск развития инсульта и ОИМ – 0,6 и 0,3 на 100 пациенто-лет соответственно [48]. В исследовании FUTURE 2 при сроке наблюдения 52 недели среди 299 пациентов с ПсА, получавших СЕК, отмечен лишь один случай развития ОИМ у больного с гиперлипидемией и АГ [49]. При этом данный больной продолжил получать СЕК с благоприятным исходом. В объединенном анализе результатов пяти исследований СЕК при ПсА FUTURE 1–5 был выявлен низкий риск наступления MACE – 0,4 на 100 пациенто-лет. Аналогичные результаты получены при проведении постмаркетингового наблюдения. В течение пяти последовательных периодических отчетных периодов (с декабря 2014 г. по декабрь 2018 г.) по безопасности частота серьезных инфекций, злокачественных новообразований и MACE составляла 1,4, 0,3, и 0,2 на 100 пациенто-лет соответственно [50, 51].
Таким образом, терапия СЕК при ПсА практически не сопровождается повышением сердечно-сосудистого риска, что может подтверждать возможность их коррекции на фоне применения данного препарата.
Достаточно много клинических данных получено в отношении псориаза. Объединенные данные рандомизированных контролируемых испытаний фазы III, таких как FIXTURE (NCT01358578), ERASURE (NCT01365455) и SCULPTURE (NCT01406938) (n = 3010), свидетельствуют, что лечение СЕК уменьшало уровень СРБ [52]. Кроме того, отмечена тенденция к снижению массы тела и уровня мочевой кислоты в течение 52 недель. В РКИ CARIMA в группе СЕК по сравнению с группой плацебо наблюдалось клинически значимое увеличение поток-опосредованной дилатации через год терапии [53]. Таким образом, была продемонстрирована потенциальная способность СЕК снижать факторы риска развития сердечно-сосудистых заболеваний благодаря улучшению эндотелиальной функции.
Комбинированный анализ исследований СЕК по показаниям псориаз, ПсА и АС, включавший 12 637 пациентов, продемонстрировал, что частота серьезных нежелательных явлений при наблюдении в течение пяти лет была низкой, без каких-либо идентифицируемых закономерностей по разным нозологиям [54]. Частота оппортунистических инфекций составляла < 0,2 на 100 пациенто-лет, злокачественных новообразований – ≤ 1 на 100 пациенто-лет, серьезных неблагоприятных сердечно-сосудистых событий – < 0,7 на 100 пациенто-лет без явного увеличения с течением времени. Таким образом, СЕК продемонстрировал благоприятный профиль безопасности в течение пяти лет лечения по трем показаниям.
Анализ ТФР ССЗ, в который было включено 9197 пациентов с псориазом, ПсА и аксСпА из 19 клинических исследований, показал, что все традиционные параметры сердечно-сосудистого риска оставались стабильными у получавших СЕК в течение года, при этом на фоне терапии быстро снижались такие лабораторные факторы риска, как уровень СРБ и индекс отношения нейтрофилов к лимфоцитам (р < 0,01 для всех показателей) [55]. При этом снижение сохранялось в течение как минимум года терапии СЕК по всем показаниям.
Высокая сердечно-сосудистая безопасность может быть следствием специфичного ингибирования ИЛ-17А, а не просто уменьшения воспалительной активности.
Так, при лечении СпА ингибиторами ФНО получены данные о возможном негативном их влиянии на риск развития ССЗ. Согласно результатам метаанализа 23 исследований, при воспалительных заболеваниях кишечника на фоне применения ингибиторов ФНО повышались масса тела, индекс массы тела и количество жировой ткани [56]. В ретроспективном исследовании с участием 450 больных аксСпА установлено, что, несмотря на снижение воспалительной активности, при применении ингибиторов ФНО не наблюдалось значимого уменьшения сердечно-сосудистого риска [57].
Заключение
Представленные данные позволяют сделать вывод, что ИЛ-17А является не только ключевым провоспалительным цитокином в патогенезе СпА, но и одним из важнейших факторов развития коморбидных состояний в целом и сердечно-сосудистой патологии в частности.
Ингибитор ИЛ-17А секукинумаб демонстрирует достаточно высокий уровень сердечно-сосудистой безопасности и, вероятно, может способствовать снижению сердечно-сосудистых рисков. В связи с этим целесообразно обсудить включение терапии ингибиторами ИЛ-17А, в частности секукинумабом, в программу эффективного менеджмента пациентов с СпА и сопутствующими ССЗ наряду с общепринятыми методами коррекции традиционных факторов риска.
D.E. Karateev, MD, PhD, Prof., E.L. Luchikhina, PhD, E.I. Markelova, PhD
Moscow Regional Research and Clinical Institute
Contact person: Dmitry E. Karateev, dekar@inbox.ru
Comorbidity and multimobidity are typical for rheumatic diseases (RD) in general. Comorbidities have a complex negative impact on the patient with RD: they are often a direct cause of the premature death of patients, they may contribute to the severe course of the inflammatory process, comorbidities reduce choice of treatment options. Spondyloarthritis, such as psoriatic arthritis (PsA) and axial spondyloarthritis (axSpA), is also characterized by the frequent presence of comorbid conditions, in particular, cardiovascular diseases. Pleiotropic effects of pro-inflammatory cytokines such as interleukin 17A (IL-17A) promote these processes.
IL-17A is a versatile pro-inflammatory T cell cytokine. At the same time, there is evidence that IL-17 involved in many other pathological processes: bone tissue remodeling, the development of endothelial dysfunction, formation of the unstable atherosclerotic plaques, heart ventricle remodeling after ischemic attack, etc. Clinical data confirm the role of hyperproduction of IL-17A in the development of cardiovascular diseases. On the example of Secukinumab IL-17A inhibition in PsA and axSpA, it has been shown that this treatment is associated with a high level of cardiovascular safety, and it is likely may help reduce cardiovascular risk.
Therapy with IL-17A inhibitors, in particular, Secukinumab, in combination with generally accepted methods of correction of traditional cardiovascular risk factors, may be a promising direction in the management of patients with SpA and concomitant cardiovascular diseases.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.


