В статье представлен клинический случай пациента с системной формой ревматоидного артрита, длительно протекавший без явных суставных поражений. Показана эффективность препарата тоцилизумаб (Актемра) при лечении системного ювенильного ревматоидного артрита.
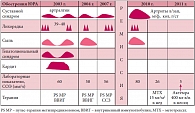
Рис. 1. Течение ЮРА у пациента Николая С., 14 лет, диагноз ЮРА, системная форма, РФ-, активность 3-1 ст., Rg 1 ст., НФ 2 б-1
Ювенильный ревматоидный артрит (ЮРА) – это гетерогенная группа заболеваний неясной этиологии, характеризующихся сложным патогенезом и преимущественным поражением суставов, возникающих в возрасте до 16 лет. Этиология заболевания до настоящего времени остается неизвестной. В основе заболевания лежит активация клеточного и гуморального звена иммунитета, так же как и при ревматоидном артрите взрослых [1, 4, 5]. Предполагается, что чужеродный или измененный собственный антиген воспринимается и обрабатывается антигенпрезентирующими клетками, в том числе макрофагами, которые представляют его Т-лимфоцитам.
В результате сложных взаимодействий активированные Т-лимфоциты, макрофаги, фибробласты, синовиоциты вырабатывают провоспалительные цитокины, вызывающие каскад патологических изменений с развитием прогрессирующего воспаления в полости сустава. При этом такие системные проявления ЮРА, как лихорадка, сыпь, лимфаденопатия, похудание и другие, больше связывают с повышением синтеза и активностью интерлейкинов (ИЛ) – ИЛ-1 и ИЛ-6, чем с фактором некроза опухоли (ФНО-альфа). Провоспалительные цитокины определяют не только появление экстраартикулярных проявлений, но и активность деструктивных изменений в суставах. Деструкция всех компонентов сустава вызывается формированием паннуса, состоящего из активированных макрофагов, фибробластов и активно пролиферирующих синовиальных клеток. Активированные лимфоциты вырабатывают большое количество протеолитических ферментов, что приводит к резорбции хряща и костной ткани. Таким образом, неконтролируемые реакции иммунной системы приводят к развитию хронического воспаления, необратимым изменениям в суставах и развитию экстраартикулярных проявлений. Классификация и номенклатура ЮРА включает семь вариантов течения заболевания.
- Системный артрит.
- Полиартрит, негативный по ревматоидному фактору (РФ-).
- Полиартрит, позитивный по ревматоидному фактору (РФ+).
- Олигоартрит: а) персистирующий; б) распространяющийся.
- Энтезитный артрит.
- Псориатический артрит.
- Другие артриты.
Диагноз системного ЮРА устанавливается при наличии артрита, сопровождающегося лихорадкой или с предшествующей лихорадкой в течение 2 недель в сочетании с двумя или более признаками – преходящие, нестойкие эритематозные высыпания, серозит, генерализованная лимфаденопатия, гепатомегалия и/или спленомегалия. При системной форме ЮРА имеются особенности суставного синдрома. Часто суставной синдром появляется в то же время, что и внесуставные проявления. Однако возможно отсроченное появление суставного синдрома с превалированием в дебюте заболевания лихорадки, сыпи, лимфаденопатии, гепатоспленомегалии, полисерозита [4, 5, 6, 8]. Многообразие клинических симптомов нередко вызывает сложности в диагностике системной формы ЮРА и выборе правильной тактики лечения. Следует дифференцировать системную форму ЮРА с сепсисом, злокачественными новообразованиями, диффузными болезнями соединительной ткани. Промедление в диагностике и лечении может привести к тяжелым осложнениям. До недавнего времени в дебюте системной формы ЮРА при отсутствии суставного синдрома применялись глюкокортикоиды (ГК), внутривенные иммуноглобулины в сочетании с традиционной иммуносупрессивной терапией. Одни пациенты хорошо отвечают на такую терапию, и системные проявления успешно купируются. Однако у значительного числа пациентов с системной формой ЮРА отмечается недостаточный эффект традиционных лекарственных препаратов, что побуждает врачей к поиску новых возможностей лечения данного заболевания.
На сегодняшний день решением этой проблемы стали генно-инженерные биологические препараты. Особенностью препаратов данной группы является селективное ингибирование определенных факторов патогенеза ЮРА. Ингибиторы ФНО-альфа – одни из первых биологических препаратов, однако, по данным международных клинических исследований, препараты этого класса далеко не всегда позволяют достичь желаемого результата у детей с системной формой ЮРА [3, 6]. Это обусловлено разными патогенетическими механизмами развития системной и суставной форм ЮРА. В настоящее время принято считать, что развитие системной формы в основном обусловлено избыточной продукцией ИЛ-6. В 2011 г. в США, странах Европейского Союза и в России был зарегистрирован первый препарат для терапии системной формы ЮРА, блокирующий эффекты интерлейкина-6, – тоцилизумаб (Актемра). Это единственный препарат, разрешенный для лечения системного ЮРА. Тоцилизумаб (Актемра) – рекомбинантное гуманизированное моноклональное антитело к человеческому рецептору интерлейкина-6 из подкласса иммуноглобулинов IgG1. Тоцилизумаб селективно связывается и подавляет как растворимые, так и мембранные рецепторы ИЛ-6. Интерлейкин-6 является многофункциональным цитокином, вырабатываемым различными типами клеток, участвующих в паракринной регуляции, системных физиологических и патологических процессах, таких как стимуляция секреции Ig, активация Т-клеток, стимуляция выработки белков острой фазы в печени и стимуляция гемопоэза.
В настоящее время продолжаются клинические исследования с целью оценки длительной эффективности и безопасности Актемры в детском возрасте. Исследования длятся около 5 лет, за это время тоцилизумаб зарекомендовал себя как высокоэффективный препарат для терапии именно системной формы ЮРА. Наиболее длительное применение препарата при системной форме ЮРА представлено в рандомизированном двойном слепом плацебоконтролируемом клиническом исследовании S. Yokota и соавт. (2008) [7]. Исследование состояло из 3 фаз: 6-недельной открытой, 12-недельной двойной слепой рандомизированной плацебоконтролируемой и 48-недельной открытой. В настоящее время завершилась 3-я фаза исследования. Через 48 недель отмечалась высокая частота ответов на терапию по критериям АКР педи. 98% детей достигли 30% улучшения (АКР педи30), 94% – 50% улучшения (АКР педи50); 90% – 70% улучшения (АКР педи70). Продемонстрировано стойкое сохранение эффекта с течением времени и хорошая переносимость препарата. Основываясь на данных исследования, можно сделать вывод об оптимальном соотношении пользы и риска при терапии Актемрой у пациентов с системной формой ЮРА.
Не менее важным является способ применения препарата. Тоцилизумаб вводится внутривенно капельно. Доза рассчитывается исходя из веса пациента. Во время введения препарата ребенок должен находиться в стационаре под наблюдением врача для того, чтобы в случае возникновения нежелательных реакций они могли быть немедленно купированы. Лечение биологическими препаратами является весьма дорогим методом, но в условиях макроэкономики государства эти затраты оправданы. Это дает ребенку возможность учиться в школе и общаться со своими сверстниками. Мы представляем успешный опыт использования тоцилизумаба у мальчика 14 лет с системной формой ЮРА, торпидного к стандартной противоревматической терапии.
Николай С., 14 лет, наблюдается в нашей клинике. Длительность заболевания составляет 8 лет. Ребенок заболел остро в возрасте 6 лет. Провоцирующим фактором явилась вакцинация против эпидемического паротита. В дебюте заболевания отмечалась фебрильная лихорадка, полиморфная пятнисто-папулезная сыпь, явления интоксикации, лимфаденопатия, гепатолиенальный синдром, артралгии. В этот период стандартное обследование в условиях стационара выявило высокую гуморальную и иммунологическую активность – СОЭ 60 мм/ч, СРБ +++, лейкоцитоз и тромбоцитоз. В связи с отсутствием стойкого суставного синдрома мальчику были исключены инфекционные заболевания, туберкулез, онкогематологическая патология. Диагноз трактовался как «ювенильный ревматоидный артрит, системная форма, аллергосептический вариант, активность 3 ст.». Клинических и рентгенологических признаков развития суставного синдрома не было. Проводилась стандартная противоревматическая терапия с использованием пульс-терапии метилпреднизолоном, переливания внутривенного иммуноглобулина (ВВИГ) пентаглобина, антибактериальной терапии (антибиотиками широкого спектра действия). На фоне лечения отмечалась положительная динамика в виде купирования лихорадки, кожного и гепатолиенального синдромов, гуморальной активности. В дальнейшем у ребенка отмечено 4 рецидива заболевания. Во время очередного обострения зимой 2003–2004 гг., протекавшего с лихорадкой, высокой гуморальной активностью, проявлениями кожного синдрома, интоксикацией, гепатолиенальным синдромом, отмечен эпизод миоперикардита. На фоне проведения пульс-терапии метилпреднизолоном и переливания ВВИГ достигнута медикаментозная ремиссия. Летом 2004 г. после перенесенной ОРВИ развилось очередное обострение заболевания, когда помимо проявлений аллергосептического синдрома впервые отчетливо выявлялись отек и боль в левом голеностопном суставе. При назначении сульфасалазина была зарегистрирована аллергическая реакция в виде сыпи. При проведении курса ВВИГ (пентаглобин) развилась анафилактическая реакция. Обострение было вновь купировано проведением курса пульс-терапии метилпреднизолоном, однократно проведена внутрисуставная пункция голеностопного сустава с введением ГК.
В дальнейшем проявления суставного синдрома отсутствовали в течение длительного времени. До 2007 г. отмечалась полная безлекарственная клинико-лабораторная ремиссия. В 2007 г. и летом 2010 г. на фоне ОРВИ отмечались эпизоды обострения заболевания в виде лихорадки, полиморфной сыпи, артралгий и высокой гуморальной активности. Лечился по месту жительства с использованием курсов пульс-терапии метилпреднизолоном в течение месяца с постепенной отменой. В январе 2011 г. развилось выраженное обострение основного заболевания (рис. 1). Помимо лихорадки, кожного, гепатолиенального синдромов, явлений интоксикации и лимфаденопатии, артралгий, высокой лабораторной активности (СОЭ 80 мм/ч, Нв 100 г/л, СРБ +++, IgG 2000), у ребенка отмечался эпизод острой надпочечниковой недостаточности. Впервые, через 7,5 лет от начала заболевания, появились признаки стойкого суставного синдрома в виде болезненности, отека, ограничения подвижности в лучезапястных, пястнофаланговых, межфаланговых, коленных, голеностопных суставах, нарастали нарушения осанки, появился перекос тазового и плечевого поясов, быстро нарастали контрактуры в локтевых суставах. При проведении рентгенографического исследования впервые был выявлен остеопороз кистовидного характера в локтевых суставах, равномерный метаэпифизарный остепороз в суставах кистей рук и лучезапястных суставах, сужение суставных щелей в костях запястьев, больше слева.
Ребенку назначена базисная терапия метотрексатом (Методжект 15 мг в нед., что составило 10 мг на м2 в нед.). Продолжен курс терапии нестероидными противовоспалительными препаратами (НПВП) – Вольтареном, пациент получал препараты кальция, проведен курс пульс-терапии метилпреднизолоном. На фоне лечения отмечена незначительная положительная динамика. Весной состояние пациента ухудшилось, прогрессировали изменения в суставах, нарастала инвалидизация, нарушилось самообслуживание за счет нарастания изменений в суставах кистей рук, сохранялась высокая гуморальная активность (СОЭ до 60 мм/ч, железодефицитная анемия, тромбоцитоз). В июне 2011 г. в связи с неэффективностью стандартной противоревматической терапии с использованием метотрексата и НПВП было решено подключить к лечению ГИБП. После проведения реакции Манту, диаскин-теста и консультации фтизиатром было дано разрешение начать биологическую терапию. Учитывая системный вариант ЮРА, высокую клинико-лабораторную активность и неэффективность метотрексата, было принято решение начать лечение биологическим препаратом тоцилизумабом (Актемра) 400 мг на 1 введение 1 раз в месяц.
Первое введение тоцилизумаба было проведено в июне 2011 г. Инфузию ребенок перенес хорошо, реакции на введение не было. На фоне лечения уже в первую неделю отмечено снижение гуморальной активности, купирование кожного синдрома, в течение 1 месяца прекратилась лихорадка. В течение последующих 4 месяцев снизилась активность суставного синдрома, уменьшились контрактуры в локтевых суставах, нарос объем движения в суставах кистей рук. Отмечена нормализация лабораторных показателей – СОЭ 5 мм/ч; СРБ 0, IgA – 70; IgG – 1200. Спустя 6 месяцев от начала лечения сохраняется стойкий положительный эффект. Улучшилось самообслуживание и, соответственно, качество жизни пациента. За 7 месяцев лечения достигнуто 70% улучшение по критериям АКР педи. Мальчик вырос на 5 см, поправился на 10 кг. Данный случай демонстрирует вариант отсроченного развития суставного синдрома при системной форме ЮРА, убедительно показывает эффективность препарата тоцилизумаб (Актемра) в лечении системной формы ЮРА.

