Опыт клинического применения Реминила (галантамина)
- Аннотация
- Статья
- Ссылки




Как известно, деменция обусловлена главным образом первичными нейро-дегенеративными процессами, сосудистой патологией или смешанным сосудисто-дегенеративным процессом. По данным литературы, перенесенный инсульт увеличивает риск возникновения сосудистой деменции (СоД) в 4-12 раз (9). На наш взгляд, современное состояние психофармакотерапии позволяет не оставлять без внимания и снижение когнитивной и психосоциальной деятельности, сопряженных с обычным процессом старения.
Общим механизмом для двух основных разновидностей деменций – болезни Альцгеймера (БА) и сосудистой деменции (СоД) – является холинергическая нейротрансмиттерная недостаточность, причастность которой к развитию слабоумия как при БА, так и СоД ныне общепризнанна, а ее компенсация холиномиметическими средствами стала одним из основных подходов к терапии этого заболевания. Доказано, что увеличение концентрации центрального ацетилхолина сопровождается усилением процессов и числа синаптических контактов (4).
Галантамин (Реминил) – селективный конкурентный обратимый ингибитор ацетилхолинэстеразы, способный усиливать эффекты ацетилхолина посредством модулирования никотиновых ацетилхолинергических рецепторов (нАХР). Потенцирование никотиновых рецепторов позволяет усилить никотиновый ответ поврежденных дегенеративным процессом, но продолжающих функционировать холинергических нейронов. Кроме того, Реминил моделирует выделение глютамата, допамина и GABA (ГАМК), ослабляя, таким образом, психологические и поведенческие симптомы деменции. В результате повышения чувствительности нАХР (за счет модулирующего действия галантамина (Реминила) на нАХР) доказана эффективность препарата не только при БА, но и смешанной деменции(СмД) и сосудистой деменции (СоД).
Целью настоящего исследования являлось изучение эффективности и переносимости Реминила в клинической практике. Нами было предпринято открытое неконтролируемое исследование эффективности и безопасности Реминила при лечении БА, СоД и СмД.
В задачу исследования входило сравнение результатов терапии в зависимости от типа слабоумия, его нозологической принадлежности и степени тяжести.
Методика исследования разработана совместно с исследователями Научного центра психического здоровья (руководитель – проф. В.А. Концевой). Согласно протоколу исследования отбирались пациенты с мягкой или умеренно выраженной деменцией (по Clinical Dementia Rating) (11), БА (согласно критериям NINCDS/ADRDA), СоД (по критериям NINСDS-AIREN) и «смешанной» деменцией (СмД) (по критериям NINCDS/ADRDA). В исследование включались больные с оценкой показателя шкалы MMSE в диапазоне от 12 до 24 баллов на момент скринингового визита. При диагностике учитывались данные клинико-лабораторного исследования, включая КТ или МРТ головы.
Критерии исключения: из исследования исключались пациенты с деменциями иного генеза – опухолью головного мозга, болезнью Паркинсона, лобно-височной деменцией и иной патологией мозга, а также с так называемыми метаболическими деменциями и псевдодеменцией. Также не включались больные с тяжелой и/или декомпенсированной соматической патологией. Исключалось одновременное назначение препаратов, оказывающих воздействие на когнитивные функции: ингибиторов ацетилхолинэстеразы, антагонистов NMDA-рецепторов, пептидных препаратов, антиоксидантов, ноотропов, нейролептиков и антидепрессантов с выраженным антихолинергическим действием, а также изменяющих абсорбцию препарата или снижающих частоту сердечных сокращений.
В соответствии с протоколом исследования предусматривалась 3-месячная терапия больных Реминилом в дозе препарата 8 мг/сут. (в 2 приема) в 1-й месяц терапии и 16 мг/сут. (в 2 приема) на протяжении последующих 2 месяцев.
Эффективность терапии анализировали с помощью следующих клинических и психометрических шкал: MMSE, шкалы оценки когнитивных функций ADAS-Cog и навыков повседневной активности (IADL), нарушения поведения при БА (BEHAVE-AD) и общего клинического впечатления (CGL). Кроме того, в специальной таблице фиксировали нежелательные эффекты терапии. Оценка по шкале MMSE производилась четырехкратно: при «нулевом» визите и далее через каждый месяц; по остальным шкалам – троекратно: при «нулевом» визите, через 1 и 2 месяца.
В исследовании участвовали 14 больных (7 мужчин и 7 женщин). У 4 из них диагностирована БА с поздним началом, у 6 имела место СоД и у 4 – СмД. У 11 пациентов имела место мягкая и у 3 – умеренно выраженная деменция. Средний возраст начала болезни (появления слабоумия) был равен 65,3 ± 6,4 г. Средний возраст больных к началу терапии был 71,7 ± 7,8 г. Продолжительность деменции составляла от 2 до 10 лет, в среднем – 5,8 ± 3,9 г. Более чем половина больных (n = 8; 57%) страдали теми или иными соматическими заболеваниями, преимущественно артериальной гипертонией, ИБС, кардиосклерозом, сосудистой энцефалопатией.
Все больные завершили трехмесячный курс лечения. При статистической обработке данных использовались программы SPSS 12.
Оценка динамики данных шкалы MMSE проводилась на основании вычисления суммарного ее показателя; анализ результатов шкал ADAS Cog, IADL и BEHAVE-AD опирался на данные разницы их суммарных показателей между начальной и последующей оценками (таблица 1). При этом рассчитывались средние показатели упомянутых шкал путем попарного сравнения их исходной величины с каждой из последующих методом Вилкоксона. Данные шкалы CGL подвергались частотному (в процентах) анализу.
Исходные данные демонстрируют достоверное соответствие между степенью тяжести слабоумия и его оценкой по данным шкал MMSE и ADAS-Cog, характеризующих различные параметры когнитивных функций больных, а также шкалы IADL, выявляющей степень адаптации их в быту. Подобная тенденция, не достигающая, однако, степени статистической достоверности, наблюдалась и по данным шкалы BEHAVE-AD, фиксирующей весьма разнородные симптомы, из числа которых наиболее часто у обследованных нами больных отмечались нерезко выраженные (в пределах 1-2 баллов) нарушения сна (98%), тревога и фобии (78,5%), субдепрессии (64%), отдельные бредовые симптомы (14,2%).
Результаты исследования
Рисунок 1 демонстрирует статистически достоверную позитивную динамику когнитивного функционирования больных, по данным шкалы MMSE, как по группе в целом, так и при мягкой и умеренной деменции уже к исходу первого месяца терапии. Обращает на себя внимание стабилизация данного показателя после двух месяцев терапии у больных с умеренной деменцией, тогда как у больных с мягкой деменцией статистически достоверное возрастание этого показателя имело место на протяжении всего периода наблюдения.
Сведения о динамике среднего показателя разницы суммарных показателей шкал ADAS-Сog, IADL и BEHAVE-AD приведены в таблице 2.
По данным шкалы ADAS-Cog, как при мягкой и умеренной тяжести деменции, так и по группе в целом статистически достоверное улучшение когнитивных функций больных отмечено уже после 2 месяцев терапии. Показатели этого улучшения возрастали примерно еще на половину к исходу 3 месяца терапии. Подобную динамику претерпевали и соответствующие показатели шкалы BEHAVE-AD, что свидетельствовало о редукции сопутствующих слабоумию продуктивных психопатологических симптомов и поведенческих расстройств. Показатели шкалы IADL у больных с мягкой деменцией демонстрировали достоверное улучшение функциональных возможностей пациентов ко 2 месяцу терапии, с небольшим последующим улучшением к концу 3 месяца. Тогда как у больных с умеренной деменцией такой тенденции не отмечалось, возможно, из-за малого числа больных.
По данным шкалы CGL (рисунок 2), различной степени положительная динамика состояния больных по группе в целом как после 1, так и после 3 мес. терапии отмечена у 80% больных. При всех вариантах слабоумия преобладало минимальное улучшение, при этом отсутствовали случаи ухудшения состояния. Выраженное улучшение наблюдалось только у трети пациентов с мягкой деменцией уже ко 2 месяцу терапии. По завершении терапии улучшение состояния в целом констатировано в 2 раза чаще при мягкой, чем при умеренно выраженной деменции.
В зависимости от диагностической принадлежности деменции удалось сравнить результаты терапии только при мягкой деменции, так как практически все случаи СоД соответствовали мягкой деменции. Отобранные для сравнения лица с БА (n = 3) и СоД (n = 4) отличались по возрасту начала слабоумия (74,3 ± 9,8 и 66,5 ± 6,3лет соответственно), а также по возрасту больных к началу терапии (79,2 ± 11,5 и 70,75 ± 9,5 лет соответственно).
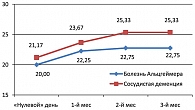
По данным шкалы MMSE (рисунок 3), при примерно одинаковом показателе оценка к началу терапии в группах БА и СоД после 3 месяцев терапии, улучшение когнитивных функций при СоД оказалось более выраженным (примерно на 2,5 балла), чем при БА. Аналогичная тенденция отмечена и по данным шкал ADAS-Cog и IADL. Средний суммарный показатель шкалы BEHAVE-AD улучшался более заметно при СоД. Однако малое число наблюдений делает некорректной статистическую обработку данных по вышеуказанным шкалам. После 1 месяца терапии при БА отмечались случаи с минимальным улучшением, а при СоД доминировали случаи с умеренным улучшением. При СоД уже на этом раннем этапе лечения примерно у 21% больных наблюдалось выраженное и у 9% – умеренное улучшение.
У включенных в исследование 4 больных со СмД тяжесть слабоумия была легкой. Средний возраст начала развития деменции составлял 64,0 ± 4,9 года, средний возраст больных к началу лечения – 67,75 ± 7,7 года.
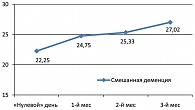
Рисунок 4 демонстрирует позитивную динамику когнитивных функций больных СмД по данным шкалы MMSE улучшение составило почти 5 баллов по сравнению с исходной оценкой. Явное улучшение больных СмД наблюдалось и по показателям других шкал, но особенно заметно оно было к моменту завершения терапии.
Нежелательные явления
Умеренно выраженные нежелательные явления наблюдались у 2 больных (14,2%). В одном случае отмечалась тошнота, во втором – головная боль, трудности засыпания при увеличении дозы препарата на втором месяце лечения. Снижение суточной дозы препарата (с 16 до 8 мг) привело к исчезновению нежелательных явлений и улучшению состояния пациентов к окончанию терапии, несмотря на применение дозы 8 мг/сут.
Обсуждение результатов
Таким образом, клиническое исследование Реминила позволило установить его эффективность при лечении основных вариантов деменций. По данным литературы, препарат демонстрирует комплексное терапевтическое воздействие на различные составляющие слабоумия: когнитивные и психопатологические расстройства, поведенческие нарушения, дезадаптацию больных в быту. Достоверное улучшение, согласно нашим данным, становится очевидным уже к концу первого месяца терапии и постепенно нарастает к моменту ее завершения. Обращает на себя внимание стабилизация показателей после двух месяцев терапии у больных с умеренной деменцией. Следует отметить, что, по данным шкалы CGI, не было отмечено ни одного случая ухудшения состояния больных в целом, а та или иная степень улучшения состояния выявлена у большей части больных (80%).
Несмотря на достаточно гармоничную редукцию проявлений слабоумия при всех его вариантах, наибольший терапевтический эффект в отношении состояния когнитивных функций и параметров общего состояния больных достигался при мягкой деменции (шкалы MMSE, ADAS-cog и CGI). Выраженное улучшение наблюдалось только при мягкой деменции (уже ко 2 месяцу терапии в 1/3 случаев). По завершении терапии улучшение состояния в целом констатировано в 2 раза чаще при мягкой, чем при умеренно выраженной деменции.
Редукция сопутствующих слабоумию продуктивных психопатологических симптомов и поведенческих расстройств, согласно динамике показателей шкал IADL и BEHAVE-AD, у больных с мягкой деменцией оказалась достоверной к концу 3 месяца терапии, тогда как у больных с умеренной деменцией таковой тенденции не отмечено.
Оценка эффективности терапии галантамином у больных с мягкой деменцией при СоД и БА показала, что при СоД показатели когнитивной сферы, навыки повседневной жизни улучшаются более отчетливо (по шкалам MMSE, ADAS-cog, IDAL). Состояние больных в целом при СоД определенно улучшалось уже ко второму, а при БА – к третьему месяцу лечения.
В изученной выборке больных умеренно выраженные нежелательные явления (преимущественно головная боль, тошнота) отмечены у двух пациентов. Они возникли при увеличении дозы препарата на втором месяце лечения до 16 мг/сут и исчезли после возвращения к первоначальной дозе. Это делает целесообразным лечение деменций даже низкими дозами препарата в тех случаях, где более высокие дозы приводят к нежелательным явлениям.
Таким образом, данное исследование продемонстрировало большую эффективность терапии галантамином СоД по сравнению с БА и его хорошую переносимость.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.