Oпыт применения эрибулина у пациенток с метастатическим раком молочной железы в реальной клинической практике
- Аннотация
- Статья
- Ссылки
- English



Введение
Рак молочной железы (РМЖ) занимает второе место в структуре общей онкологической заболеваемости, уступая по частоте раку кожи, и остается основной онкологической патологией в женской популяции (20,9%): за период с 2005 по 2015 г. зафиксирован прирост стандартизированного показателя заболеваемости на 21% [1].
Благодаря инновационным противоопухолевым препаратам метастатический РМЖ перешел в разряд заболеваний с «хроническим» течением. То есть появилась возможность сдерживать прогрессирование болезни на протяжении длительного периода. Пациентки при этом сохраняют социальную активность и работоспособность. Основной целью лечения является увеличение продолжительности жизни при максимальном сохранении ее качества [2].
Благодаря внедрению в клиническую практику таргетных препаратов существенно улучшился прогноз заболевания при HER2-положительном РМЖ. Однако серьезную проблему по-прежнему представляет лечение пациенток с HER2-негативным РМЖ. Речь, в частности, идет об опухолях с трижды негативным (ТН) фенотипом, при которых отсутствуют специфические мишени для таргетной и гормональной терапии, чем обусловлено крайне агрессивное течение и быстрое прогрессирование заболевания [3]. При этом единственным надежным критерием, определяющим влияние терапии на увеличение продолжительности жизни, является показатель общей выживаемости (ОВ).
Антрациклины и таксаны остаются наиболее эффективными препаратами для лечения РМЖ, но резерв их использования при распространенном процессе ограничен в силу частого применения в неоадъювантных, адъювантных режимах и первой линии метастатического РМЖ. Выбор режимов для последующих линий представляет сложную задачу в ежедневной практике врачей-онкологов из-за отсутствия доказанного преимущества какого-либо из зарегистрированных препаратов по показателю ОВ. В соответствии с регистрационным показанием эрибулин рекомендован при местнораспространенном или метастатическом РМЖ у пациенток, получивших ранее не менее одного режима химиотерапии по поводу распространенного заболевания [4]. При этом более раннее назначение эрибулина ассоциируется с более значимым увеличением продолжительности жизни [5].
Эффективность и безопасность эрибулина
По механизму действия эрибулин отличается от других препаратов, у которых мишенью служит тубулин. Эрибулин блокирует митоз посредством образования функционально неактивных тубулиновых агрегатов, необратимо подавляя фазу роста микротрубочек и не влияя на фазу укорачивания [4, 6]. Эрибулин также воздействует на микроокружение опухоли и ее фенотип с помощью механизмов, не связанных с его антимитотическим эффектом. Эти дополнительные эффекты включают ремоделирование сосудистого русла опухоли, при котором улучшается перфузия центральной части опухоли и снижается ее гипоксия, и фенотипический переход более агрессивных мезенхимальных фенотипов в менее агрессивные эпителиальные посредством инверсии эпителиально-мезенхимальной трансформации [4, 7, 8].
Эрибулин в режиме монотерапии достоверно и клинически значимо увеличивает продолжительность жизни больных метастатическим РМЖ, получивших в анамнезе несколько режимов химиотерапии, когда резервы антрациклинов и таксанов исчерпаны (в сравнении с терапией по выбору врача) (исследование EMBRACE) [9].
В исследовании III фазы сравнивали эффективность эрибулина и капецитабина. Основными конечными точками служили ОВ и выживаемость без прогрессирования (ВБП). При анализе всей популяции медиана ОВ была выше в группе эрибулина (15,9 против 14,5 месяца). Различия оказались близки к достоверным, но не достигли статистической значимости (р = 0,056) [10].
Изначально запланированный подгрупповой анализ в рамках данного исследования продемонстрировал, что в отдельных подгруппах эрибулина разница в ОВ была достоверно выше, чем в группе капецитабина. В группе эрибулина достоверная разница в увеличении ОВ на 2,4 месяца наблюдалась у пациенток с HER2-негативным РМЖ (15,9 и 13,5 месяца соответственно; p = 0,030) и на 3,9 месяца – с ЕR-негативным РМЖ (14,4 и 10,5 месяца соответственно; p = 0,0162). Максимальное различие в ОВ на пять месяцев зафиксировано у пациенток с ТН РМЖ (14,4 месяца в группе эрибулина и 9,4 месяца в группе капецитабина; p = 0,0062) [11]. Оценка качества жизни продемонстрировала улучшение показателей в обеих химиотерапевтических группах, причем выигрыш в группе эрибулина был более существенным, чем в группе капецитабина [12].
Помимо результатов исследований, упомянутых выше, в настоящее время доступны данные объединенного анализа. Из 1864 больных, участвовавших в двух исследованиях, 1644 пациентки получили химиотерапию эрибулином после первой линии по поводу распространенного заболевания. Достоверная разница в увеличении ОВ при использовании эрибулина отмечалась во всей популяции больных, а также в подгруппе ТН РМЖ (различия составили 4,3 месяца) и HER2-негативного РМЖ (3,1 месяца) [13]. Таким образом, объединенный анализ подтвердил существенные преимущества эрибулина перед другими видами терапии у больных распространенным РМЖ после применения антрациклинов и таксанов.
Кроме данных международных рандомизированных исследований для клиницистов особую ценность представляют результаты применения эрибулина в рутинной клинической практике.
Нами был проведен ретроспективный анализ эффективности и безопасности применения эрибулина в клинической практике у 26 пациенток с морфологически верифицированным распространенным РМЖ, получивших в условиях реальной клинической практики не менее двух курсов эрибулина после лечения антрациклинами и таксанами. Сбор данных проводился с января 2015 г. по январь 2017 г. Характеристики больных и особенности опухолевого процесса представлены в табл. 1.
Как видно из табл. 1, медиана возраста больных составила 50 лет. Статус – 0–2 балла по шкале ECOG. По результатам иммуногистохимического анализа у 14 пациенток диагностировали HER2-негативный, у девяти – ТН РМЖ. Две пациентки имели HER2-положительный статус и получали лечение эрибулином в комбинации с трастузумабом. У половины больных отмечались метастазы в двух и более органах, у 88,5% – висцеральные метастазы. Чаще метастазы были диагностированы в костях (34,6%), печени (46,2%) и легких (65,4%). Пациентки с метастатическим поражением костей получали стандартную терапию остеомодифицирующими агентами (бисфосфонаты, деносумаб).
Варианты предшествующего лечения приведены в табл. 2. Большинство больных (76,9%) получили терапию антрациклинами и таксанами, а 1/3 – дополнительно капецитабин. 5 (19,2%) пациенткам эрибулин назначали в первой линии терапии, 8 (30,8%) – во второй линии, 6 (23,1%) – в третьей, 4 (15,4%) – в четвертой, 2 (7,7%) – в пятой, 1 (3,8%) – в седьмой.
Лечение эрибулином проводилось в стандартном режиме. Препарат назначали в дозе 1,4 мг/м2 в виде 2–5-минутной инфузии в 1-й и 8-й дни 21-дневного цикла. 3 (11,5%) больным из-за нежелательных явлений потребовалась редукция дозы препарата до 1,1 мг/м2. Повторных редукций дозы не потребовалось. Терапия продолжалась до прогрессирования заболевания, развития неприемлемой токсичности или невозможности введения препарата по любой другой причине, включая отказ от продолжения терапии. Эффективность в рамках клинической практики оценивали после каждых двух курсов лечения по критериям RECIST [14].
Всего проведено 133 цикла терапии эрибулином. Медиана числа циклов эрибулина, полученных больными, достигла пяти, диапазон составил от двух до десяти циклов. Ни у одной пациентки не зафиксировано полной или частичной регрессии. Между тем более чем у половины (65,4%) удалось достичь стабилизации заболевания. Медиана времени без прогрессирования составила 4,01 месяца (95%-ный доверительный интервал 1,91–5,54).
Полученные результаты свидетельствуют о высокой противоопухолевой активности препарата (большинство больных имели висцеральные метастазы, половина из них получала препарат в качестве третьей и последующих линий терапии). Несмотря на то что медиана времени до прогрессирования составила четыре месяца, у 5 (19,2%) больных зафиксирована длительная стабилизация заболевания, в частности свыше шести месяцев.
Оценивая токсичные реакции, можно отметить, что у 8 (30,8%) пациенток каких-либо нежелательных явлений не зарегистрировано. Среди побочных реакций чаще наблюдались тошнота 1–2-й степени, нейтропения и нейропатия (табл. 3).
В обновленную инструкцию по применению эрибулина была добавлена информация об эффективности и безопасности эрибулина с трастузумабом и капецитабином по результатам исследований фазы II. Данные комбинации эффективны, при этом профиль безопасности соответствует известному профилю безопасности каждого препарата в отдельности [2, 15, 16].
Терапия эрибулином была отменена у 20 (76,9%) пациенток из-за прогрессирования заболевания, у 1 (3,9%) – из-за плохой переносимости.
На основании вышеизложенных данных применения эрибулина в реальной клинической практике у пациенток с метастатическим РМЖ можно сделать вывод, что препарат характеризуется клинической эффективностью, хорошей переносимостью, приемлемым и контролируемым профилем побочных эффектов.
Клинический случай
Больная З. 62 лет.
В 2008 г. проведено комплексное лечение по поводу рака левой молочной железы стадии IIB с включением радикальной мастэктомии слева, дистанционной гамма-терапии, адъювантной полихимиотерапии (шесть циклов без антрациклинов).
В 2009 г. при контрольном обследовании обнаружен рак правой молочной железы. Выполнена радикальная мастэктомия. Послеоперационная стадия – IIIС. Определен рецепторный статус опухоли – ЭР+; ПР-; Her2/neu++; дополнительное FISH-тестирование – амплификация отсутствует.
Проведены послеоперационная дистанционная гамма-терапия, восемь циклов дополнительнй полихимиотерапии – комбинация «циклофосфамид + доксорубицин + фторурацил». Дополнительная эндокринотерапия включала прием тамоксифена в стандартной дозе 20 мг/сут.
В июне 2010 г. на фоне эндокринотерапии обнаружена единичная опухоль мягких тканей правой половины передней грудной стенки. При дополнительном обследовании других очагов поражения не обнаружено. Проведено комбинированное лечение в виде удаления опухоли и локальной лучевой терапии на ложе метастаза. Определен рецепторный статус удаленной метастатической опухоли – ЭР+; ПР-; Her2/neu++; дополнительное FISH-тестирование – амплификация отсутствует.
По завершении комбинированного лечения выполнены сцинтиграфия скелета, рентгеновская компьютерная томография (РКТ) органов грудной полости, брюшной полости, малого таза. Выявлены единичные метастазы в поясничных позвонках. С учетом характера процесса, биологического профиля метастатической и основной опухоли принято решение о проведении эндокринотерапии второй линии в виде приема анастрозола в стандартном режиме 1 мг/сут внутрь ежедневно на фоне приема бисфосфонатов – золедроновой кислоты в стандартном режиме 4 мг внутривенно капельно один раз в 28 дней.
При контрольном обследовании в апреле 2011 г. обнаружена положительная динамика в виде значительного уменьшения размеров очагов в поясничных позвонках. Лечение продолжено в прежнем режиме.
При обследовании в июле 2011 г. (сцинтиграфия скелета, РКТ органов грудной полости, брюшной полости, малого таза) – полная ремиссия поражений костей скелета. Продолжено лечение в виде эндокринотерапии второй линии.
При контрольном обследовании в декабре 2011 г. и марте 2012 г. ремиссия сохранялась. В июне 2012 г. обнаружена небольшая опухоль в мягких тканях правой подмышечной области. Других патологических очагов не выявлено. 20 июня 2012 г. в хирургическом отделении Пятигорского онкологического диспансера опухоль мягких тканей правой подмышечной области была удалена. Гистологически – метастаз протокового рака. Определен рецепторный статус удаленной метастатической опухоли – ЭР++; ПР-; Her2/neu++. Выполнено дополнительное FISH-тестирование – амплификация отсутствует, Ki-67 – 30%.
Проведено шесть циклов дополнительной химиотерапии – паклитаксел в монорежиме.
При контрольных обследованиях в сентябре и декабре 2012 г. ремиссия сохранялась, метастатических очагов не обнаружено. От предложенной эндокринотерапии больная отказалась.
До июня 2013 г. пациентка за медицинской помощью не обращалась. В июне 2013 г. резко ухудшилось общее состояние, развился болевой синдром второй степени.
При контрольном обследовании выявлены множественные метастазы в кости таза и крестец. С учетом тяжести общего состояния принято решение о проведении эндокринотерапии третьей линии на фоне применения бисфосфонатов. Назначена терапия фулвестрантом в стандартной дозе на фоне регулярного приема золедроновой кислоты. До мая 2016 г. – стабилизация процесса без появления новых очагов поражения на фоне терапии фулвестрантом.
В мае 2016 г. пациентка обратилась с жалобами на наличие множества плотных образований в мягких тканях правой половины грудной стенки. Выполнена аспирационная биопсия одного из образований. Цитологически – метастаз протокового рака. В июне 2016 г. выполнены сцинтиграфия скелета, РКТ органов грудной полости, брюшной полости, малого таза, костей черепа. Картина обнаруженных ранее поражений костей скелета – без существенной динамики. Дополнительно – опухолевая деструкция грудины, в мягких тканях правой половины грудной стенки множественные опухолевые очаги от 3 до 14 мм в диаметре, в правой плевральной полости выпот толщиной до 5 мм.
Принято решение о прекращении эндокринотерапии и переходе на химиотерапию препаратом эрибулин в монорежиме. На момент начала лечения – 1 балл по ECOG, индекс Карновского – 80%. Первый цикл (июнь 2016 г.) проведен в стандартной дозе 1,4 мг/м² внутривенно болюсно в 1-й и 8-й дни лечения.
При контрольном обследовании в сентябре 2016 г. – выраженная положительная динамика: отсутствие плеврита, полная редукция мягкотканных очагов передней грудной стенки с сохранением деструкции грудины.
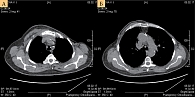
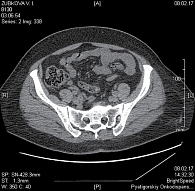
До февраля 2017 г. проведено восемь циклов химиотерапии эрибулином в стандартной дозе. В процессе лечения отмечались эпизоды гематологической токсичности, разрешившиеся самостоятельно и не потребовавшие отмены препарата или модификации его дозы. При контрольном обследовании в феврале 2017 г. сохранялись деструктивные изменения грудины. Мягкие ткани передней грудной стенки не изменены, данных о плеврите нет. РКТ органов брюшной полости (рис. 1А, 1Б) – без выраженной патологии, РКТ органов малого таза (рис. 2) – признаки немногочисленных мелких остеосклеротических и остеобластических очагов в костях таза и головках бедренных костей 5–10 мм – без динамики. Канцеро-эмбриональный антиген (СЕА) – в норме, углеводный антиген (СА 15-3) – в норме, тканевый полипептидный антиген (ТРА-М) – в норме. На момент консультации – ECOG – 0, индекс Карновского – 100%.
I.L. Kiselyov, L.A. Zhilyayeva, Yu.A. Mishina, V.I. Vladimirov
Kursk Regional Clinical Oncology Dispensary
Institute of Service, Tourism and Design, the branch of the North-Caucasian Federal University in Pyatigorsk
Pyatigorsk Oncological Dispensary
Contact person: Igor Leonidovich Kiselyov, kursk_ood@mail.ru
There is no the unified standard for the treatment of the patients with the metastatic breast cancer previously treated with the therapy. Eribulin mesylate is approved in Russia for the treatment of the patients with the locally advanced or metastatic breast cancer who have the disease progression after the application of at least one chemotherapy regimen, prescribed for the widespread disease and included anthracyclines and taxanes. The article presents the generalized experience of eribulin applying in the clinical practice for the metastatic breast cancer, and as well the clinical case is being discussed. The efficiency and safety of eribulin is analyzed, particularly with long-term use, unwanted events.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.