Опыт применения осимертиниба в рутинной клинической практике
- Аннотация
- Статья
- Ссылки
- English
Обзор
Парадигма ведения пациентов с распространенным немелкоклеточным раком легкого (НМРЛ) пережила революционный сдвиг с момента появления таргетной терапии. Поиск молекулярных мишеней в настоящее время включает в себя EGFR-мутацию, транслокацию ALK, мутацию ROS1, BRAF. К этому списку добавилось и определение PD-L1-экспрессии [2].
Однако в рутинной практике количество материала для проведения теста зачастую ограниченно. И если поиск генетических нарушений обычно идет от наиболее распространенной мутации к менее распространенной, так как они являются взаимоисключающими [3, 4], то с порядком определения экспрессии PD-L1 могут возникнуть вопросы.
Исторически пациенты с EGFRm или ALK+ НМРЛ исключались из исследований иммунотерапевтических препаратов, поскольку их эффективность у этой группы была неясна. Однако недавно исследование II фазы, в котором оценивалась эффективность и безопасность пембролизумаба у пациентов с мутацией гена EGFR, ранее не получавших ингибиторов тирозинкиназы (ИТК) EGFR, было остановлено из-за неэффективности лечения [5]. Кроме того, данные из исследований во второй/третьей линиях терапии показали, что частота ответа на иммунотерапию в монорежиме была существенно ниже у пациентов с EGFRm или ALK+ НМРЛ по сравнению с пациентами без соответствующих генетических нарушений (3,6 vs 23,3% соответственно) [6]. И в метаанализе исследований, сравнивавших иммунотерапевтические препараты в монорежиме (ниволумаб, пембролизумаб, атезолизумаб) и доцетаксел, у предлеченных пациентов с мутацией гена EGFR не было различий по общей выживаемости [7].
Важно отметить, что мутации гена EGFR могут характеризоваться различной чувствительностью к таргетной терапии. Так, в частности, инсерции в 20-м экзоне характеризуются нечувствительностью к таргетной терапии. Мутация T790M известна как основной механизм резистентности к ИТК EGFR первого-второго поколения и изредка (около 5%) встречается у пациентов de novo [8]. В настоящее время широко изучаются и другие редкие мутации. Согласно действующим рекомендациям, препаратами выбора в случае выявления редких мутаций являются осимертиниб и афатиниб [2]. Однако важно отметить, что в 95% случаев встречаются именно сенсибилизирующие мутации – делеции в 19-м экзоне гена EGFR и мутация L858R в 21-м экзоне [8]. Если сравнить эти два типа мутаций, то у пациентов с делецией в 19-м экзоне отмечается наилучший прогноз [9]. Так, например, по данным ретроспективного анализа [9], у 388 пациентов медиана общей выживаемости (ОВ) составила 29,9 месяца (95%-ный доверительный интервал (ДИ) 22,4–37,4) у пациентов с мутацией в 19-м экзоне и 20,6 месяца (95% ДИ 16,9–24,3) с мутацией в 21-м экзоне (p = 0,003). Если взять пациентов на терапии ИТК EGFR, ответивших на лечение, то различия будут еще более существенными: медиана ОВ 36,4 месяца (95% ДИ 30,5–42,3) у пациентов с мутацией в 19-м экзоне и 22,9 месяца (95% ДИ 19,6–26,2) с мутацией в 21-м экзоне (p = 0,010). Когорта включала 284 пациента [9]. Однако очень важно отметить, что, несмотря на различия, пользу от лечения ИТК EGFR получают обе группы: таргетная терапия позволяет достичь значительно большей частоты ответа, времени до прогрессирования (ВБП) и качества жизни, чем химиотерапия [10, 11]. В частности, пациенты, получавшие гефитиниб, имели преимущество по ВБП по сравнению с химиотерапией независимо от типа активирующей мутации [12]. Это же было отмечено и для осимертиниба при сравнении с ИТК EGFR первого поколения [13].
В последнее время в мире отмечается следующая тенденция: за счет старения населения увеличивается число пациентов старшей возрастной группы. В России средний возраст пациентов с диагнозом «рак легкого» – 65,8 года и более 50% случаев приходится на возраст 65 и старше [14]. У этих пациентов часто встречаются сопутствующие заболевания, хуже соматический статус и больше риск развития побочных эффектов [15, 16]. Влияет ли это на эффективность таргетной терапии?
В метаанализе 12 исследований на данных 4465 пациентов с мутацией гена EGFR изучалось влияние различных факторов на эффективность лечения ИТК EGFR. Было показано, что возраст не влиял ни на показатель ВБП (группы пациентов < 65 vs ≥ 65 лет; относительный риск (ОР) 0,93; 95% ДИ 0,77–1,13; p > 0,05; анализ включал 11 исследований), ни на ОВ (ОР 0,97; 95% ДИ 0,70–1,35; p > 0,05; анализ включал 4 исследования) [10]. Еще в одной работе был проведен анализ безопасности и эффективности терапии осимертинибом у 77 пожилых пациентов с НМРЛ при наличии мутации Т790М. Авторы выделили две группы пациентов: от 75 лет и старше (23%, n = 18) и младше 75 лет (77%, n = 59). Различий по частоте объективного ответа и ВБП между группами выявлено не было. В возрастной группе ≥ 75 лет чаще отмечались паронихии 2-й степени и выше (16,6 и 1,6% соответственно; р = 0,04), но частота нежелательных явлений (НЯ) любой степени тяжести не различалась между группами, так же как и частота снижения дозы или отмены препарата по причине НЯ [17].
Рассмотрим также пациентов с плохим соматическим статусом. Эта группа часто исключается из клинических исследований, и в рутинной практике эти пациенты тоже часто рассматриваются как кандидаты на симптоматическое лечение. Однако терапию ИТК EGFR можно считать исключением, поскольку у пациентов с положительным статусом мутации даже с плохим соматическим статусом часто наблюдается драматическое улучшение состояния и ответ на лечение, так называемый эффект Лазаря, при этом данный класс препаратов обладает благоприятным профилем безопасности. Так, в исследовании гефитиниба II фазы у 30 пациентов c EGFRm+ НМРЛ, которым нельзя было назначить химиотерапию (плохой соматический статус или возраст ≥ 80 лет), объективный ответ отмечался у 66% пациентов и медиана ВБП составила 6,5 месяца. Улучшение соматического статуса было отмечено у 23 из 30 пациентов (79%; p < 0,00005), и у 68% из пациентов c исходным ECOG 3–4 после приема гефитиниба ECOG снизился до ≤ 1 [18]. В недавнем ретроспективном японском исследовании осимертиниба у 30 пациентов с мутацией T790M и плохим соматическим статусом также отмечалось улучшение состояния пациентов. У 24 (80%) пациентов исходно был ECOG 2, у 6 (20%) – ECOG 3. Частота объективного ответа составила 53%, медиана ВБП – 8,2 месяца. Различий между пациентами с соматическим статусом 2 и 3 по медиане ВБП не отмечено (p = 0,35). У 19 (63%) пациентов отмечено улучшение соматического статуса, у 4/6 пациентов с соматическим статусом 3 ECOG снизился до ≤ 1 [19]. Безусловно, это исследования на небольшом количестве пациентов, но все же они позволяют составить какое-то представление об эффективности таргетной терапии для этой группы.
Наличие метастазов в головном мозге – еще один фактор, который обращает на себя внимание при выборе стратегии ведения пациента с НМРЛ. Лечение и профилактика метастазирования в центральной нервной системе (ЦНС) представляют собой сложную задачу из-за ограниченной способности ИТК EGFR первого-второго поколения проникать через гематоэнцефалический барьер (ГЭБ), как было показано в доклинических и клинических исследованиях. Соответственно на фоне таргетной терапии часто может отмечаться изолированное прогрессирование в ЦНС. Высокая частота метастазов в головном мозге у пациентов с мутацией гена EGFR может быть обусловлена не только ограниченной эффективностью ИТК EGFR из-за их фармакокинетических свойств, но и возрастающей вероятностью развития таких метастазов в связи с более длительным периодом жизни на фоне ИТК EGFR [20].
Осимертиниб является препаратом, который проникает через ГЭБ, в том числе у здоровых добровольцев. Препарат предотвращает или откладывает развитие метастазов в ЦНС, а также позволяет получать ответ на лечение, если метастазы в ЦНС были на момент начала терапии. Это очень важный аргумент для применения этого препарата в первой линии терапии как у пациентов с метастазами в ЦНС, так и без них [13, 20]. В настоящее время пока нет данных проспективных исследований, сравнивающих ИТК EGFR, проникающих через ГЭБ, таких как осимертиниб, и лучевую терапию, однако при выборе подходов для пациентов с метастазами в головной мозг и мутацией гена EGFR можно ориентироваться на данные ретроспективных анализов. Ретроспективный анализ по применению стереотаксической радиохирургии до начала терапии ИТК EGFR первого поколения показал возможность такого подхода к ведению пациентов с метастазами в головном мозге [21]. В другом ретроспективном анализе оценивалась эффективность лечения 40 пациентов с НМРЛ и метастазами в головном мозге, получавших осимертиниб. Пациенты были разделены на три группы: пациенты с прогрессирующими метастазами в головном мозге, не получавшие лучевую терапию до начала терапии осимертинибом (n = 11, группа A), пациенты с прогрессирующими метастазами в головном мозге, получившие радиохирургическое лечение до начала терапии осимертинибом (n = 9, группа B), и пациенты со стабильными метастазами в головном мозге, не получавшие специальной терапии по поводу очагов в головном мозге до начала терапии осимертинибом (n = 20, группа C). Семь пациентов получили радиохирургическое лечение (Кибернож) в течение месяца до после начала терапии осимертинибом по поводу прогрессирующих метастазов в ЦНС. Не отмечалось статистически значимых различий в выживаемости без прогрессирования заболевания (p = 0,960), времени до неудачи терапии (p = 0,775) или общей выживаемости (p = 0,282) между тремя группами [22]. В случае объемных образований в головном мозге, симптомных или жизнеугрожающих метастазов может быть рекомендовано проведение локального лечения с помощью лучевой терапии или хирургии с последующим применением активного в ЦНС ИТК EGFR – осимертиниба. Для пациентов с симптомными олигометастазами можно начать лечение со стереотаксической радиохирургии (SRS). Пациенты с солитарными или множественными мелкими метастазами в головном мозге могут начать лечение с осимертиниба, и лучевая терапия может быть отменена или отложена до признаков прогрессирования [23]. Полное облучение головного мозга можно оставить в резерве на случай, если метастазы рефрактерны к SRS и терапии ИТК EGFR, тем самым откладывая возникновение когнитивных нарушений, которые могут негативно сказаться на качестве жизни в целом длительно живущих на фоне таргетной терапии пациентов [24].
Клинический случай
Пациент М., 64 лет, отметил появление боли в области правого плечевого сустава (6 баллов по визуальной аналоговой шкале (ВАШ)) с ограничением подвижности, одышку при умеренной физической нагрузке, малопродуктивный кашель с мокротой белесоватого цвета, увеличение лимфоузлов шеи справа в конце декабря 2018 г. Курит около 40 лет по 0,5 пачки в день (индекс курения – 20).
Данные рентгенографии органов грудной клетки от 14 января 2019 г.: периферическая опухоль верхней доли правого легкого, лимфаденопатия средостения. Пациент был направлен в областной онкологический диспансер, где проведено уточняющее обследование и выполнена трепанбиопсия надключичного лимфоузла под УЗ-навигацией, верифицирована аденокарцинома легкого.
В феврале 2019 г. обратился в НИИ онкологии Томского НИМЦ.
Объективно: ECOG-статус 2; в шейно-надключичной области справа пальпируется конгломерат плотных, увеличенных до 4 см безболезненных лимфоузлов; ограничение движения в правом плечевом суставе (до 90˚) за счет болевого синдрома; дыхание везикулярное, справа в верхних отделах несколько ослаблено, хрипы сухие в небольшом количестве; перкуторный звук легочный, симметричный. Неврологический статус – без особенностей.
По данным ультразвукового исследования лимфоузлов шеи, в шейно-надключичной области справа определяется конгломерат гипоэхогенных лимфатических узлов размерами не менее 46 × 33 мм, слева аналогичные лимфатические узлы (три) до 31 × 19 мм.
При видеобронхоскопии визуализировалась перибронхиальная компрессия правого главного бронха, нижней трети трахеи.
По данным компьютерной томографии органов грудной полости, справа во втором сегменте расположена опухоль неправильной формы до 37 мм в наибольшем измерении; в области 3, 6, 10-го сегментов справа и 6-го сегмента слева определяются очаговые образования от 4 до 7 мм в диаметре; верхнее и среднее средостение занимал конгломерат увеличенных лимфатических узлов размерами 66 × 85 × 109 мм, инфильтрация с лимфатических узлов распространялась на стенку дуги аорты, трахеи, главных бронхов, легочной артерии.
По данным магнитно-резонансной томографии головного мозга, кортикально и субкортикально в структуре больших полушарий, обеих гемисферах мозжечка визуализировались многочисленные метастатические очаги размером 0,4–1,7 см с накоплением контрастного препарата, преимущественно на периферии.
Таким образом, установлен клинический диагноз: периферический рак верхней доли правого легкого с метастатическим поражением лимфоузлов средостения, шейно-надключичных лимфоузлов, поражением головного мозга сT4 N3 M1b, стадия IV. Гистологическое заключение: аденокарцинома легкого G3 (ICD-O code 8140/3). Материал направлен на молекулярно-генетическое исследование: наличие активирующих мутаций EGFR, транслокации гена ALK, транслокации ROS1.
20 февраля 2019 г. проведен курс химиотерапии – паклитаксел 350 мг/карбоплатин AUC5 450 мг. Перенес с нежелательными явлениями в виде астении 3-й степени, тошноты и артралгии 1-й степени.
После получения положительного результата EGFR-мутации (L858R), с учетом тяжелой переносимости курса химиотерапии и метастатического поражения головного мозга пациенту назначена молекулярно-направленная терапия осимертинибом 80 мг/сут с 22 марта 2019 г.
Через две недели после начала приема осимертиниба пациент отметил значительное улучшение самочувствия в виде уменьшения болевого синдрома, увеличения объема движения правой руки. При осмотре пациента через месяц: статус 1 по ECOG, уменьшение конгломерата лимфоузлов шейно-надключичной области, одышки и болевого синдрома (ВАШ 1–2 балла). Через два месяца после начала терапии – отсутствие жалоб, соматический статус ECOG 0.
При контрольном обследовании в январе 2020 г. (десять месяцев на фоне таргетной терапии) отмечена положительная динамика:
- полная регрессия множественных метастазов головного мозга;
- уменьшение в размерах лимфоузлов в шейно-надключичной области справа до 10 × 6 мм (-78,3%);
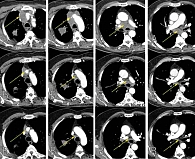
- уменьшение конгломерата лимфатических узлов средостения с 109 × 85 × 66 мм до 39 × 20 × 19 мм (-64,2%) (рисунок);
- стабилизация размеров основного опухолевого очага (по RECIST 1.1).
Заключение
В заключение хочется отметить, что все пациенты с распространенным неплоскоклеточным НМРЛ вне зависимости от клинических характеристик, а также молодые пациенты с плоскоклеточным НМРЛ должны проходить тестирование на мутацию гена EGFR [2]. Проведение такого исследования позволяет выделить группу пациентов, кому показана таргетная терапия, и эта группа получит от нее наибольшее преимущество вне зависимости от других характеристик. Кроме того, это позволяет избежать неэффективного расходования других препаратов, не работающих у пациентов этой группы.
Ye.O. Rodionov, PhD, S.A. Tuzikov, PhD, Prof., S.V. Miller, PhD, L.V. Levonyan, V.A. Markovich
Research Institute of Oncology, FSBRI ῾Tomsk National Research Medical Center of the Russian Academy of Sciences’
Siberian State Medical University
Contact person: Yevgeny O. Rodionov, rodionov_eo@oncology.tomsk.ru
The progress in the study of non-small cell lung cancer (NSCLC) allowed us to understand how important it is to know the specific characteristics of each tumor, because they can have significant impact on the prognosis and response to treatment, that is why the molecular genetic testing has become the obligatory stage in the diagnosis of a patient and determines the selection of management strategy for the patient. Conducting such a study allows to identify the group of patients who are recommended the targeted therapy. The most common genetic disorder in NSCLC is the mutation of the epidermal growth factor (EGFR) gene. In our country, among all patients with common NSCLC, the mutation in the EGFR gene is determined in 10% [1]. The first tyrosine kinase inhibitors (TKI) of EGFR significantly changed our ability to treat this group of patients, and today we are already using the third-generation TKI EGFR. However, in routine practice, other clinical characteristics are as well important. This article provides the overview of them, which is accompanied by a clinical example.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.


