Опыт рационального использования комбинации пептидных препаратов у коморбидных пациентов с хронической ишемией головного мозга
- Аннотация
- Статья
- Ссылки
- English


Введение
Терапия хронической ишемии головного мозга (ХИМ) у коморбидных пациентов является одной из самых актуальных проблем современной медицины [1, 2]. Это связано прежде всего с многофакторной этиологией и сложным патогенезом данного состояния [3]. Коморбидность, под которой понимается сочетание нескольких заболеваний (артериальной гипертензии, сахарного диабета, атеросклероза, последствий нейроинфекций, соматических заболеваний) у одного пациента, осложняет течение и прогноз ХИМ [4, 5]. Курильщики, пациенты с заболеваниями легких, включая хроническую обструктивную болезнь легких (ХОБЛ) и последствия новой коронавирусной инфекции, – одна из наиболее сложных групп для эффективной фармакотерапии. У таких пациентов развивается системный провоспалительный процесс с активацией хронического воспаления и усилением окислительного стресса с прогрессирующим поражением органов-мишеней (сердце, головной мозг) и вторичной гипоксией [6]. Нарушенная вентиляционная способность легких усиливает гиперкапнию, внося свой вклад в повреждение нейроваскулярной единицы. Дисфункция эндотелия, коррелируемая с повреждением гематоэнцефалического барьера (ГЭБ), запускает процессы гибели нейронов и активации нейродегенеративных процессов [6]. Гипоксия и повреждение нейроваскулярной единицы становятся основными мишенями медикаментозных стратегий цереброваскулярных заболеваний, особенно хронических форм, поскольку до настоящего времени не разработаны единые стандарты, а рациональная терапия складывается из двух направлений – профилактического и нейропротекторного [7]. Монотерапевтическое вмешательство, даже воздействующее на несколько молекулярных мишеней, не всегда позволяет достигать лечебных целей [8].
В Российской Федерации часто применяют препараты пептидного ряда [9]. Истоки нейропептидной терапии относятся к 1973 г., когда сотрудники Военно-медицинской академии им. С.М. Кирова В.Г. Морозов и В.Х. Хавинсон совместно со специалистами завода медицинских препаратов Ленинградского мясокомбината им. С.М. Кирова, впоследствии ООО «Самсон-Мед» (Санкт-Петербург, Россия), начали разработку группы отечественных препаратов пептидной природы для повышения ресурса организма военнослужащих, находящихся в условиях воздействия неблагоприятных факторов. Сейчас изолированное применение нейропептидов хорошо изучено и имеет большую доказательную базу [9]. Эти биомолекулы обладают выраженными нейротрофическими, медиаторными, эффекторными, ноотропными, антиоксидантными, нейропротекторными и противовоспалительными свойствами. Нейропептиды отличаются высокой эффективностью, возможностью использования в малых дозах и характеризуются небольшим числом побочных реакций. В то же время самостоятельный антигипоксический эффект нейропептидов незначителен, что требует дополнительного использования препаратов других групп [10]. Перспективной считается комбинация нейропептидов и пептидов антигипоксантов-цитопротекторов. Любые представители пептидных препаратов селективно связываются с эндогенными белками, образуя структурные конформации в ответ на различные патологические стимулы, что делает возможным использование терапевтической комбинации пептидных ансамблей [11]. Однако использование комбинации двух или более препаратов, особенно биологических, может нести в себе риск развития нежелательных реакций. Доступные научные публикации содержат ограниченное количество данных, в таких работах отсутствуют четкие рекомендации по комбинированной терапии препаратов указанной группы [12].
Представленный клинический случай наглядно иллюстрирует эффективность и безопасность комбинации препарата Цитохром С и полипептида коры головного мозга крупного рогатого скота Ренобрейн у пациентки с ХИМ, курением в анамнезе, ХОБЛ и артериальной гипертензией (АГ), длительно принимающей статины, ингибиторы ангиотензинпревращающего фермента.
Клинический случай
Пациентка К. 63 лет обратилась к терапевту с жалобами на одышку, головную боль, раздражительность, головокружение, повышение артериального давления (АД), потливость, нарушение сна, снижение памяти, нарушение речи по типу «каши во рту», поперхивание при глотании.
Анамнез заболевания. Длительное время отмечает подъем уровня АД до 200/100 мм рт. ст., адаптирована к уровню 140/90 мм рт. ст. Постоянно принимает эналаприл 10 мг (утро/вечер), аторвастатин 40 мг, Кардиомагнил 75 мг. Год назад перенесла новую коронавирусную инфекцию в легкой форме. Лечилась амбулаторно. Вакцинирована. Курит свыше 30 лет.
Обследована терапевтом: АД – 160/90 мм рт. ст., частота дыхания – 22 в минуту, частота сердечных сокращений (ЧСС) – 80 уд/мин. С учетом длительного анамнеза курения, наличия одышки рекомендовано проведение спирометрии и электрокардиографии (ЭКГ).
Заключение исследования функции внешнего дыхания (спирометрии): бронходилятационный тест положительный. Объем форсированного выдоха за первую секунду/форсированная жизненная емкость легких < 0,7 (70%).
Данные ЭКГ: ритм синусовый, ЧСС – 82 уд/мин. Электрическая ось сердца нормальная.
Результаты лабораторных исследований представлены в таблице.
Заключение терапевта: гипертоническая болезнь стадии II, АГ 2-й степени. Риск сердечно-сосудистых осложнений – 4. Дислипидемия. Абдоминальное ожирение 1-й степени.
Сопутствующий: ХОБЛ, стадия II, стабильное течение, с редкими обострениями. ХИМ.
Рекомендована консультация невролога.
Консультация невролога. Пациентка К. 63 лет обратилась с жалобами на постоянную головную боль без четкой локализации, раздражительность, плаксивость, головокружение, потливость, нарушение сна, снижение памяти, нарушение речи по типу «каши во рту», поперхивание при глотании.
Объективно: контактна, сконцентрирована на своих жалобах, эмоционально лабильна. Когнитивные функции снижены. Инструкции выполняет с трудом, на вопросы отвечает. Менингеальных знаков нет. Глазные щели, зрачки S = D. Фотореакции и корнеальные рефлексы сохранены. Движение глазных яблок в полном объеме. Нистагма нет. Лицевая мускулатура симметрична. Язык по средней линии. Глоточный рефлекс сохранен. Парезов нет. Мышечный тонус D = S, не изменен. Сухожильные рефлексы D = S, низкие, рефлекс Бабинского отрицательный с двух сторон. Координаторные пробы выполняет удовлетворительно. Четких чувствительных нарушений нет. Функции тазовых органов контролирует.
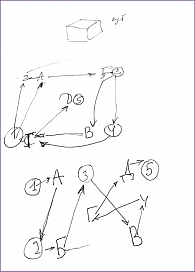
При проведении скрининга когнитивных нарушений по Монреальской шкале оценки когнитивных функций (Montreal Cognitive Assessment, MoCA) выявлено снижение концентрации внимания, нарушения зрительно-конструктивных навыков (куб), создания альтернирующих путей, незначительное нарушение беглости речи и памяти. Общий балл тестирования – 25 (рис. 1).
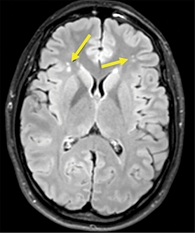
Данные магнитно-резонансной томографии (МРТ) головного мозга пациентки К. 63 лет (рис. 2): множественные очаги размером от 3 до 6 мм с повышенным МР-сигналом в Т2-В/И и в последовательности FLAIR, имеют сосудистый генез. Расширение пространств Вирхова.
Заключение невролога: ХИМ, стадия II, синдром умеренных когнитивных расстройств с сопутствующей патологией АГ, ХОБЛ.
Пациентке рекомендованы:
Цитохром С по схеме 10 мг внутримышечно утром в течение десяти дней с проведением кожной биопробы до введения;
Ренобрейн 10 мг внутримышечно днем в течение десяти дней;
- продолжение терапии сопутствующих заболеваний;
- телефонный контроль через два дня после начала терапии для оценки возможных побочных реакций;
- повторная консультация через 14 дней после начала терапии и через месяц по завершении курса.
После 14 дней терапии пациентка почувствовала значительное улучшение в виде уменьшения выраженности одышки, общей слабости, улучшилась концентрация внимания, нормализовались сон и настроение. Пациентка за время терапии не наблюдала побочных эффектов лекарственных препаратов, аллергических реакций.
Через месяц на повторном приеме у невролога отмечала улучшение состояния, полное физическое восстановление (нет слабости, ощущает «прилив сил», стала лучше усваивать новую информацию, появилась концентрация внимания). При объективной оценке не выявлено отрицательной динамики в неврологическом статусе, значительно улучшились показатели по шкале МоСА, особенно по пунктам, где фиксировалось наименьшее количество баллов (нарушения зрительно-конструктивных навыков (куб), создания альтернирующих путей, нарушение беглости речи и памяти). Общий балл возрос до 27 (рис. 3).
Рекомендованы повторный курс пептидной терапии через шесть месяцев и контроль факторов риска.
Обсуждение
Выбрать рациональную стратегию медикаментозной терапии коморбидных пациентов – сложная задача реальной клинической практики [13]. Это связано со сложными патогенетическими корреляциями нарушения мозгового кровообращения и патогенезом сопутствующих заболеваний [4]. Пациентка К. 63 лет имела длительный анамнез курильщика (свыше 30 лет), ХОБЛ, АГ. Каждое состояние само по себе провоцирует развитие митохондриальной дисфункции, нарушение ауторегуляции мозгового кровотока с развитием гипоксии, системного воспаления и окислительного стресса [14]. У курильщиков происходят системная утрата, деградация митохондрий, мутации митохондриальной ДНК [15, 16]. Дефекты в митохондриальных белках приводят к увеличению продукции активных форм кислорода (АФК), снижению митохондриального дыхания с изменениями клеточного метаболизма, усилением клеточной гибели и апоптоза, что способствует развитию патологических системных повреждений [6]. Системное воспаление инициирует и/или ухудшает сопутствующие состояния, такие как ХОБЛ, АГ, атеросклероз [17]. Сигаретный дым активизирует процессы окислительного стресса, которые характеризуются большим количеством долгоживущих свободных радикалов и АФК. АФК-генерирующие НАДФН-оксидазы относятся к ключевым факторам повреждения головного мозга и сосудов при церебральной ишемии [18]. Наличие у пациентки длительной вторичной гипоксии курильщика и АГ запустило процессы апоптоза со снижением эндогенной защитной системы и активации ядерного редокс-чувствительного транскрипционного фактора (Nrf2) [20]. Таким образом сформировался порочный круг: курение – ХОБЛ – гипоксия – ишемия – ХИМ. Учитывая одну из главных ролей в патогенезе окислительного стресса, в схемы терапии ХИМ обычно включают антиоксидантны. Применение традиционных антиоксидантов у коморбидных пациентов может быть незначительно эффективно из-за избирательного действия (коррекции повреждающего действия АФК, ослабления ингибирования реакций цикла Кребса, повышения использования митохондриями кислорода для предупреждения разобщения окисления/фосфорилирования и стабилизации мембран, стимуляции нейротрансмиттеров) [21, 22]. При длительно протекающих гипоксических состояниях с выраженной клинической картиной (одышка, астения, когнитивные нарушения, инсультоподобные состояния), приеме ряда лекарственных препаратов (статины, бета-блокаторы) митохондрии теряют часть своих компонентов, включая переносчики электронов, происходит истощение системы коферментов. Следовательно, дополнительно необходимо снижать экспрессию цитохрома C как сигнального маркера апоптоза при повреждении мембранных структур клетки для восстановления активного клеточного дыхания. В тканях цитохром С выполняет функцию заместительной терапии компонентов митохондрий. Однако в условиях патологического стресса (гипоксии, ишемии, вирусной инфекции) организм не может в полной мере обеспечить себя эндогенными пептидами [23]. Цитохром C активирует переход железа в составе гема из окисленного состояния Fe (III) в восстановленное Fe (II), усиливая перенос электронов между комплексами кофермента Q – цитохрома С-редуктазы и цитохрома С-оксидазы, не связывая кислород и участвуя в тканевом дыхании [24].
Препарат Цитохром C – биопетид, полученный из сердец крупного рогатого скота. Как любой неспецифический пептид, он способен к селективному связыванию с эндогенными белками [10, 24]. Это классический цитопротектор с выраженным метаболическим эффектом, что позволяет применять его при различной кардиальной патологии и любых гипоксических состояниях. Профилактическое введение препарата Цитохром C в клинических и экспериментальных исследованиях ассоциировалось с церебропротективным эффектом при гипоксии мозга, предотвращением или уменьшением патологических процессов (развитие внутриклеточного и внеклеточного отека ткани мозга). При экспериментальном инфаркте головного мозга Цитохром С снижал уровень белка S100b – основного маркера повреждения нервных клеток [24, 25].
Антиоксиданты компенсируют повреждающий эффект окислительного стресса, активируя внутриклеточную систему антиоксидантной защиты. Однако стратегии купирования пагубного воздействия только АФК недостаточно для восстановления трофики нейрональной единицы, особенно мозгового нейротрофического фактора, поэтому необходимо регенерировать поврежденные структуры нейронов [26]. Активация нейротрофического фактора головного мозга (BDNF) происходит путем стимуляции тропомиозинового тирозинкиназного рецептора B (TrkB), который является важным сигнальным путем для выживания и нормального функционирования зрелых нейронов. Передача сигналов TrkB и антиоксидантная система дополняют друг друга, одновременная активация этих путей обеспечивает дополнительную многофакторную нейропротекцию, клинически улучшая когнитивные функции и снижая/замедляя выраженность нейродегенерации [27]. Особенностью структуры нейропептидов является наличие нескольких лигандных групп связывания, обладающих разным сродством к отдельным клеточным рецепторам и обусловливающих в связи с этим разнообразие вызываемых ими эффектов [9]. Небольшие нейропептиды специфически взаимодействуют с соответствующими рецепторами, стимулируют синтез рилизинг-активных факторов в соответствующих регионах мозга [26]. Они легко проникают через ГЭБ, активируются в экспрессированных различными патогенами эндотелиальных клетках. Препараты группы нейропетидов характеризуются выраженными нейротрофическими, медиаторными, эффекторными, ноотропными, антиоксидантными, нейропротекторными и противовоспалительными свойствами [12].
Препарат Ренобрейн – комплекс водорастворимых нейрополипептидов с молекулярной массой до 10 кДа, выделенных из коры головного мозга крупного рогатого скота, является полным аналогом препарата Кортексин [28], имеющего большую доказательную базу в терапии ХИМ, когнитивных и астенических расстройств [25]. Ренобрейн, как и Кортексин, «минипептид», способный селективно связываться с нейротрофическими Trk-рецепторами, повышая нейротрофическую активность, может легко проходить через ГЭБ. Основные механизмы подобного феномена, вероятно, связаны с изменением экспрессии генов, регулирующих синтез собственных нейротрофических факторов, BDNF и фактора роста нервов (NGF). Пептиды Ренобрейна оказывают прямое и опосредованное нейротрофическое влияние на клетки, стимулируя рост нейритов или снижая гибель нейронов, клинически улучшая когнитивные функции и уменьшая проявления астении. Дополнительным положительным свойством пептидов является то, что, вероятно, проходя через ГЭБ, препараты данной группы обеспечивают более быструю доставку других лекарственных средств [29]. Комбинация пептидных препаратов Цитохрома C и Ренобрейна позволила суммировать лечебные эффекты неселективных цитопротекторов с выраженными антигипоксическими свойствами и нейропротекторов, воздействующих на нейропластичность и нейротрофику, и соответственно добиться значимого клинического результата у пациентки К., что особенно актуально у пациентов, перенесших новую коронавирусную инфекцию [30].
Заключение
В реальной клинической практике использование комбинации пептидов при любой неврологической патологии на начальных или более поздних стадиях позволит уменьшить риск развития полипрагмазии у коморбидных пациентов и повысит эффективность нейропротекции [31]. В то же время необходимо дальнейшее изучение совместного применения препаратов этой группы для выработки оптимальных схем терапии.
M.V. Putilina, PhD, Prof.
N.I. Pirogov Russian National Research Medical University
Contact person: Marina V. Putilina, profput@mail.ru
Therapy of chronic cerebral ischemia in comorbid patients is one of the most urgent problems of modern medicine. This is due primarily to the multifactorial etiology and complex pathogenesis of this condition. In the Russian Federation, peptide preparations are often used. The isolated use of neuropetides is well studied and has a large evidence base. However, there is little data on the combined use of these drugs, therefore, the experience of using a peptide therapeutic ensemble is of particular scientific and clinical interest. The presented clinical case illustrates the rational, effective and safe use of the combination of Cytochrome C with the neuropeptide Renobrain in a patient diagnosed with CCI, a long history of smoking, chronic obstructive pulmonary disease, arterial hypertension in a patient taking statins, angiotensin converting enzyme (ACE) inhibitors.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.