Основы профилактики и лечения наследственных тромбофилий
- Аннотация
- Статья
- Ссылки
В связи с этим важное значение для решения вопроса о необходимости обследования имеют тромботический семейный и собственный анамнез женщины, а также наличие репродуктивных потерь, особенно после 10 недель беременности. Что касается лечебно-профилактических мероприятий, то они уместны на этапе подготовки к беременности, во время беременности и в послеродовом периоде, а также в периоперационном периоде.
Вопросы выбора препаратов, режимы и дозы их применения решаются в первую очередь в зависимости от вида протромботического наследственного дефекта гемостаза и тромботического анамнеза женщины.
Многие исследователи пришли к единому мнению, что к тромбофилиям высокого риска относятся дефицит антитромбина III, гомозиготная мутация фактора V (Leiden), гомозиготная мутация гена протромбина, а также сочетание гетерозиготных мутаций фактора V (Leiden) и гена протромбина. У этих женщин целесообразно применение профилактических или промежуточных (средних) доз нефракционированного гепарина или НМГ. При наличии указаний в анамнезе на эпизод венозного тромбоза или тромбоэмболии у самой пациентки или ее родственников обоснованно применение терапевтических доз антикоагулянтов (нефракционированного гепарина или НМГ) во время беременности и в послеродовом периоде.
К тромбофилиям среднего риска относят гетерозиготные мутации фактора V (Leiden), гена протромбина, дефицит протеинов С и S.
Терапевтические мероприятия вне беременности определяются семейным тромботическим анамнезом, а также наличием провоцирующих факторов: ожирение, подготовка к операции, иммобилизация. Кроме того, общеизвестно влияние комбинированных оральных контрацептивных препаратов на возможное развитие тромбоэмболических осложнений даже у «бессимптомных» носителей тромбофилий среднего риска.
Женщины, имеющие в анамнезе эпизоды тромбозов или тромбоэмболий, имеют высокий риск тромбоэмболических осложнений во время беременности. Им необходимо проводить антикоагулянтную терапию на протяжении беременности и в течение 4–6 недель после родов.
Важно отметить, что во всех случаях носительства протромботических мутаций, даже при отсутствии отягощенного тромботического анамнеза, вопросы фармакологической профилактики должны решаться индивидуально (3,8,5,11) (категория 1С). Кроме того, не доказана обоснованность профилактического применения антикоагулянтов у женщин с привычным невынашиванием беременности в ранние сроки (до 10 недель беременности) (10,6).
Антикоагулянтная профилактика осложнений беременности у носительниц наследственных тромбофилий является вероятным фактором, благоприятно влияющим на течение и исход их будущей беременности.
Применительно к профилактике и лечению тромбозов, индуцированных генетически обусловленными дефектами, в настоящее время существует несколько классов препаратов, однако ведущая роль принадлежит антикоагулянтам, использование которых у женщин определяется наличием беременности и/или гестационным сроком.
К прямым антикоагулянтам относится нефракционированный гепарин (Na-Ca соли) (НФГ) и низкомолекулярные гепарины (НМГ). Преимущество – возможность контроля дозы. Однако именно НФГ вызывает аутоиммунную гепарининдуцированную тромбоцитопению II типа при которой, несмотря на снижение количества тромбоцитов, повышается риск тромбозов. Это связано с тем, что аутоиммунный комплекс гепарин-фактор 4 тромбоцитов (PF4) вызывает чрезмерную агрегацию и активацию тромбоцитов с высвобождением веществ с прокоагулянтной активностью, а также активацию эндотелия с образованием тканевого тромбопластина. Подобная стимуляция свертывающей системы крови значительно повышает риск тромбообразования, поэтому тромбоцитопения и наличие тромбозов определяют клиническую картину и исход заболевания. Обычно заболевание развивается через 5–20 дней после лечения. Кроме того, при длительном применении гепарин вызывает остеопению и даже остеопороз.
Доказанные рекомендации в отношении профилактики и лечения антикоагулянтами у носительниц тромбофилических мутаций заключаются в следующем (1,5):
Для беременных женщин предпочтительно применение НМГ, а не НФГ (категория 2С).
При неотягощенном тромботическом анамнезе, но при наличии дефицита АТ-III показана профилактика во время беременности и в послеродовом периоде (категория 2С). При этом при снижении антитромбина до 50% гепаринотерапия проводится по строгим показаниям, а при уровне антитромбина, равном 30%, гепаринотерапия противопоказана (вследствие высокого риска развития гепарин-индуцированых тромбозов). При остальных тромбофилических дефектах гемостаза рекомендованы лабораторный мониторинг или профилактические дозы НМГ (или НФГ) плюс антикоагулянты в послеродовом периоде (категория 2С).
С целью профилактики гестационных осложнений при отсутствии отягощенного тромботического осложнения в анамнезе рекомендуются профилактические или средние дозы НФГ или профилактические дозы НМГ в комбинациис аспирином (категория 1В).
- Профилактическая доза НФГ: 5000 Ед подкожно 2 раза в сутки.
- Умеренная доза НФГ: подкожно 2 раза в сутки, подобранная для достижения уровня Ха в пределах 0.1–0.3 ЕД/мл.
- Скорректированная доза НФГ: подкожно 2 раза в сутки, подобранная для значений АЧТВ в терапевтических пределах.
- Профилактическая доза НМГ: дальтепарин 5000 Ед 2 раза в сутки подкожно; Эноксапарин 40 мг 2 раза в сутки подкожно; Надропарин 30 мг 2 раза в сутки подкожно (дозы могут быть скорректированы в зависимости от массы тела).
- Средняя доза НМГ: дальтепарин 5000 Ед 2 раза в сутки подкожно; Эноксапарин 40 мг 2 раза в сутки подкожно; Надропарин 30 мг 2 раза в сутки подкожно.
- Скорректированная доза НМГ в зависимости от массы тела: лечебная доза НМГ, вводимая 1 или 2 раза в сутки: дальтепарин 200 Ед/кг; Эноксапарин 1 мг/кг.
- Антикоагулянтная терапия в послеродовом периоде: антагонисты витамина К (Варфарин) в дозе, соответствующей МНО в пределах 2.0–3.0 с первоначальным применением НМГ или НФГ до достижения МНО ≥ 2.0, или профилактические дозы НМГ в течение 4–6 недель после родов.
Низкомолекулярные гепарины (средняя молекулярная масса 4000–7000 дальтон) – высокоэффективные противотромботические и слабые противосвертывающие средства прямого действия; компенсируют процессы гиперкоагуляции.
Низкомолекулярные гепарины различаются по способу производства, молекулярному весу и активности. Они оказывают немедленное, выраженное и пролонгированное противотромботическое действие, практически не влияя на первичный гемостаз, адгезию и агрегацию тромбоцитов. Противосвертывающий эффект их обусловлен, в первую очередь, связыванием антитромбина плазмы и ингибированием фактора Xa и внешнего пути свертывания крови, поэтому НМГ не удлиняют АЧТВ и тромбиновое время (ТВ). Они обладают высоким отношением анти-Ха-факторной к анти-IIа-факторной активности и незначительно ингибируют образование тромбина. Вместе с тем, возможно, они влияют также на сосудистую стенку и систему фибринолиза. Являясь слабым антикоагулянтом, НМГ оказывают незначительное влияние на коагуляционные тесты, обладают минимальным геморрагическим эффектом.
В дозах, используемых для профилактики венозных тромбозов, НМГ практически не влияют на время кровотечения, время свертывания крови и активированное частичное тромбопластиновое время (АЧТВ). Активность НМГ выражается в единицах Европейской фармакопеи: в единицах анти-Ха (антифактор Ха) и единицах АЧТВ (активированное частичное тромбопластиновое время), которое отражает противосвертывающее действие (активность). Анти-Ха отражает антитромботическое действие (активность).
В отличие от нефракционированного стандартного гепарина, у которого соотношение анти-Ха к активности АЧТВ составляет 1:1, ингибирование Ха-фактора свертывания низкомолекулярными гепаринами значительно более выражено, чем его влияние на АЧТВ. Это оказывает более благоприятное влияние на эффективность и переносимость НМГ и, соответственно, на ожидаемую противотромботическую активность и уменьшение риска развития кровотечения.
В связи с этим НМГ имеют ряд преимуществ перед нефракционированным гепарином, включая улучшенную биодоступность, большее время полужизни, легкость назначения, не требуют мониторинга и имеют мало побочных эффектов. Исследования на животных и людях показали, что НМГ не являются тератогенными, фетотоксичными и не проникают через плаценту.
Выраженная биоактивность НМГ продолжается в течение 24 часов при условии однократного подкожного применения.
Среди НМГ в нашей стране наиболее популярны Эноксапарин (Клексан), дальтепарин (Фрагмин), Надропарин (Фраксипарин).
В очищенной системе in vitro Эноксапарин (Клексан) обладает высокой анти-Ха-активностью (примерно 100 МЕ/мл) и низкой анти IIа-активностью (примерно 28 МЕ/мл). При использовании в профилактических дозах препарат незначительно изменяет активированное частичное тромбопластиновое время (АЧТВ), практически не оказывает воздействия на агрегацию тромбоцитов и на уровень связывания фибриногена с рецепторами тромбоцитов. Анти-IIа активность его в плазме примерно в 10 раз ниже, чем анти-Ха активность. Средняя максимальная анти-IIа активность наблюдается через 3–4 часа, анти-Ха факторная активность – через 3–5 часов после подкожного введения препарата. При неблагоприятных исходах беременности в анамнезе в рандомизированных исследованиях было выявлено, что применение Эноксапарина у женщин с однократной потерей плода и тромбофилиями низкого риска увеличивало частоту рождения живых детей и массу при рождении (4).
Надропарин кальций (Фраксипарин) представляет собой низкомолекулярный гепарин (НМГ), в котором антитромботические и антикоагулянтные свойства стандартного гепарина разделены. Надропарин кальций характеризуется более высокой анти-Xа факторной активностью по сравнению с анти-IIa факторной или антитромботической активностью. Отношение между этими видами активности для Надропарина кальция находится в пределах 2.5–4. В профилактических дозах Надропарин не вызывает выраженного снижения АЧТВ. Кроме того, противотромботический эффект препарата обеспечивается также активацией ингибитора превращения тканевого фактора (TFPI), активацией фибринолиза (в результате высвобождения активатора тканевого плазминогена из эндотелиальных клеток) и модификацией реологических свойств крови (за счет снижения вязкости и повышения проницаемости мембран тромбоцитов и гранулоцитов). Именно поэтому при длительном применении Надропарин может влиять на функцию тромбоцитов вследствие более выраженного антитромботического эффекта, снижения уровня тромбина, который является агонистом тромбоцитов, а также усиления эффектов простациклина.
Предпочтительно применение препарата со II триместра беременности, хотя сведения о его тератогенном эффекте отсутствуют.
Далтепарин (Фрагмин) связывает антитромбин плазмы, вследствие чего ингибирует активность фактора Ха и тромбина. Противотромботический эффект Далтепарина натрия обусловлен в первую очередь ингибированием Ха-фактора; на время свертывания крови влияет незначительно. По сравнению с гепарином оказывает слабовыраженное влияние на адгезию тромбоцитов и, таким образом, оказывает меньшее влияние на первичный гемостаз. При применении у беременных не было выявлено неблагоприятного влияния на течение беременности, а также на здоровье плода и новорожденного. В последнее время получены данные об отсутствии биоаккумуляции Далтепарина натрия в профилактической дозе у пациентов с тяжелой почечной недостаточностью (12), что свидетельствует о безопасном применении препарата у пациентов с нарушенной функцией почек. При использовании Фрагмина во время беременности риск неблагоприятного влияния на плод оценивается как низкий. Однако поскольку возможность неблагоприятного влияния нельзя полностью исключить, Фрагмин, так же как и другие НМГ, можно назначать только по строгим показаниям, когда предполагаемая польза для матери превышает потенциальный риск.
Контроль эффективности НМГ – определение маркеров внутрисосудистого свертывания – комплекс ТАТ, фрагменты 1+2 протромбина.
Оральные антикоагулянты (Варфарин) редко используются при беременности из-за значительных побочных эффектов. Имеются данные о применении их во второй половине беременности, однако производные кумарина проникают через плаценту и связаны с эмбриопатиями. Оральные антикоагулянты остаются резервом для тех случаев, когда эффективность НМГ и гепарина ограничена. Это относится к ведению женщин с искусственными клапанами сердца и случаям, когда назначение препарата НМГ и гепарина противопоказано (кожная аллергия). НФГ, НМГ и производные кумарина не противопоказаны при грудном вскармливании (категория 1А).
Другим классом препаратов, с успехом применяемых с целью профилактики и лечения тромбозов у женщин – носительниц тромбофилических дефектов гемостаза, являются дезагреганты, в первую очередь аспирин и дипиридамол (Курантил) –
ингибиторы циклооксигеназы. Аспирин ингибирует циклооксигеназу и необратимо тормозит циклооксигеназный путь метаболизма арахидоновой кислоты, блокирует синтез простагландинов (A2, D2, F2aльфа, E2 и др.) и тромбоксана. Уменьшение содержания тромбоксана А2 в тромбоцитах приводит к необратимому подавлению агрегации, несколько расширяет сосуды. Существенное ингибирование склеиваемости кровяных пластинок достигается при дозах до 30 мг. Аспирин также увеличивает фибринолитическую активность плазмы и снижает концентрацию витамин K-зависимых факторов свертывания (II, VII, IX, X). Стимулирует выведение мочевой кислоты, поскольку нарушается ее реабсорбция в канальцах почек. Кроме того аспирин влияет на IL-3, ответственный за рост и дифференцировку трофобласта.
Применение аспирина в больших дозах в I триместре беременности может оказывать тератогенное действие (в терапевтических дозах этот эффект не наблюдается). В связи с особенностями накопления аспирина в организме следует прекращать его прием за 6–10 дней до родов, так как он переходит через плаценту и может вызывать геморрагические осложнения у матери и плода. Кроме того, вследствие необратимого ингибирования простагландинсинтетазы аспирин при длительном применении вызывает эрозивно-язвенные поражения желудка, кровотечения из желудочно-кишечного тракта, бронхиальную обструкцию, тенденцию к перенашиванию в связи с торможением синтеза простагландинов Е2 и F2a; возможно развитие тромбоцитопении.
Профилактические дозы аспирина составляют 60–80 мг/сут., лечебные – 375–500 мг через 36–48 ч внутрь (курсами по 14 дней).
При аспиринорезистентности, которая наблюдается в среднем в 38% случаев, вне беременности с успехом применяется Клопидогрел (Плавикс) – производное тиенопиридина, по механизму действия близкий к тиклопидину, но существенно эффективнее и безопаснее последнего.
Плавикс преимущественно подавляет АДФ-индуцированную агрегацию тромбоцитов и, вероятнее всего, влияет на их рецепторы GP Пb/Ша. Плавикс эффективнее, чем аспирин, предупреждает развитие ишемического инсульта, инфаркта миокарда и снижает смертность от сердечно-сосудистых заболеваний. Препарат назначают внутрь по 75 мг 1 раз в сутки (утром).
Дипиридамол (Курантил), согласно исследованиям, в том числе наших сотрудников, являясь противотромботическим препаратом, благотворно влияет на развитие ранней плаценты и, в отличие от аспирина, не влияет на агрегацию тромбоцитов, улучшает микроциркуляцию, тормозит тромбообразование, нормализует гемостаз, снижает общее периферическое сопротивление сосудов. Применяется внутрь в таблетках по 25 мг 3–4 раза в сутки. При этом рекомендуется исключить из рациона кофе, крепкий чай, ксантинсодержащие продукты.
Другим классом антикоагулянтных препаратов являются гепариноиды, к которым относятся Сулодексид (Вессел Дуэ Ф) и Пиявит. Гепариноподобная фракция Сулодексида обладает сродством к антитромбину, а дерматановая фракция – к кофактору гепарина II, который инактивирует тромбин.
Сулодексид (Вессел Дуэ Ф) прямой антикоагулянт с пролонгированным антитромботическим действием. Кроме того препарат обладает мягким антикоагулянтным, антиагрегантным, профибринолитическим эффектами, оказывает гиполипидемическое действие. Препарат способствует восстановлению функции эндотелия. Выраженный антитромботический эффект препарата обусловлен подавлением активированного фактора X; усилением синтеза и секреции простациклина простагладина l2, а также снижением уровня фибриногена в крови.
Фибринолитическое действие Вессел Дуэ Ф реализуется посредством повышения уровня тканевого активатора плазминогена (t-PA) в крови с соответствующим снижением содержания в крови ингибитора активатора плазминогена тканевого типа (PAI). Таким образом, Сулодексид эффективен как в целях профилактики тромбообразования в артериях и венах, так и в отношении лизиса уже сформировавшегося тромба.
Вессел ДУЭ Ф обладает также ангиопротекторным действием путем восстановления структурной и функциональной целостности клеток эндотелия сосудов за счет восстановления плотности отрицательного электрического заряда пор базальной мембраны сосудов. Кроме того, этот препарат оказывает положительное влияние на реологические свойства крови за счет снижения содержания в крови триглицеридов (через механизм активации липопротеинлипаз) и уменьшения вязкости крови.
Применяется внутримышечно во П и Ш триместрах беременности по 2.0 мл в течение 15–20 дней с последующим переходом на пероральный прием по 1 капсуле два раза в день в течение 30 дней. Рекомендуется контроль коагулограммы в начале и конце лечения. Обязательно следует определять показатель АЧТВ (удлиняется приблизительно в полтора раза по сравнению с нормой), антитромбин III, время кровотечения, время свертывания нестабилизированной крови.
Пиявит является антикоагулянтом прямого действия, блокирует одновременно плазменное и тромбоцитарное звено гемостаза. Обладает высоким сродством к коллагену, уменьшает адгезию тромбоцитов на субэндотелии. Оказывает защитное действие на эндотелий. Предотвращает рост внутрисосудистых тромбов и способствует их рассасыванию, снижает вязкость крови. Оказывает умеренное противовоспалительное и анальгезирующее действие. Пиявит принимают внутрь по 0,3 г (1 капсула по 0,3 г или 2 капсулы по 0,15 г) 3 раза в день. Курс лечения 10–20 дней. Повторный курс лечения – через 1–2 месяца. С профилактической целью принимают по 0,15 г 2 раза в день.
Важным компонентом лечебно-профилактических противотромботических мероприятий является применение Омега-3 жирных кислот (эйкозапентаеновая, докозагексаеновая, альфа-линоленовая кислоты), среди многообразных свойств которых в контексте разбираемой проблемы заслуживают внимания эффекты воздействия на гемостаз за счет уменьшения продукции метаболитов простагландина Е2 (ПГЕ2); снижения уровня тромбоксана А2 (мощного вазоконстриктора и активатора агрегации тромбоцитов); повышения концентрации тромбоксана А3 (слабого вазоконстриктора и индуктора агрегации тромбоцитов); повышения уровня простациклина I3 (ПГI3), что при отсутствии снижения простациклина I2 (ПГI2) приводит к увеличению концентрации общего простациклина. ПГI2 и ПГI3 являются активными вазодилататорами и подавляют агрегацию тромбоцитов. Тромболитическое действие связано с изменением под влиянием Омега-3 жирных кислот состава клеточных мембран, в т.ч. мембран тромбоцитов и эритроцитов, которое характеризуется уменьшением доли арахидоновой (АК) и увеличением уровня эйкозапентаеновой (ЭПК) кислот.
Среди тромбофилических дефектов гемостаза полиморфизм гена PAI-1, согласно нашим данным, может обусловить развитие как тромбозов (за счет подавления фибринолиза, усиления тромбообразования с повышением уровня PAI-1), так и геморрагических состояний во время беременности (образование ретрохориальных/ретроамниотических гематом (за счет усиления фибринолиза со снижением уровня PAI). В этих случаях применяются ингибиторы фибринолиза (транексамовая кислота) и ангиопротекторы (Этамзилат (Дицинон)).
К ингибиторам фибринолиза относится транексамовая кислота, которая блокирует связывание фибрина на плазминогене и плазмине. Режим применения препарата индивидуальный, в зависимости от клинической ситуации. Разовая доза для приема внутрь составляет 1–1,5 г, кратность применения 2–4 раза/сут.,длительность лечения 3–15 дней. Разовая доза для в/в введения составляет 10–15 мг/кг. При необходимости повторного применения интервал между каждым введением должен составлять 6–8 ч. Препарат разрешен к применению во время беременности. Категория действия на плод по FDA – B. Противопоказан при гематурии.
Этамзилат (Дицинон) активирует образование III фактора свертывания крови (тромбопластина) и увеличивает содержание мукополисахаридов с большой молекулярной массой в сосудистой стенке, нормализуя ее проницаемость. Не обладает гиперкоагуляционными свойствами и не повышает склонность к тромбообразованию. При кровотечении внутривенно вводят 0,5 г, а затем по 0,25 г каждые 4 ч. При внутривенном вливании действие начинается через 1–2 чи продолжается до 4–6 ч. Профилактически назначают внутривенно или внутримышечно 0,25–0,5 г за 1 ч до хирургического вмешательства либо 0,75 г внутрь за 3 ч до операции. Не рекомендуется использовать Этамзилат в качестве монотерапии при кровотечениях, вызванных антикоагулянтами.
В некоторых странах имеются официальные рекомендации для женщин, планирующих беременность, дополнительно получать фолиевую кислоту для предотвращения дефекта нервной трубки. Женщинам, которые прежде не имели детей с пороками развития нервной трубки, рекомендуется дополнительный прием фолиевой кислоты от 400 до 500 мг ежедневно, по меньшей мере, за 4 недели до планируемой беременности и до 8-й недели беременности. Это объясняется тем, что эффективность натуральных пищевых фолатов может быть меньше.
При гомозиготной мутации гена MTHFR и гипергомоцистеинемии наряду с антитромботической терапией с успехом применяется препарат Ангиовит, который является комплексом витаминов В6, В12 с фолиевой кислотой. Состав компонентов данного комплекса в 1 таблетке (витамины В6 – 4 мг/сут., В12 – 6 мкг/сут., фолиевая кислота – 5 мг), восполняет дефицит витаминов, являющихся донаторами ферментов, участвующих в метаболизме гомоцистеина. Кроме того дозировка фолиевой кислоты является адекватной для профилактики пороков развития плода (дефектов нервной трубки).
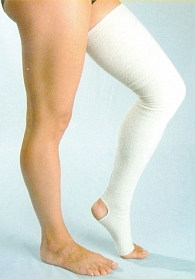
Компрессионный трикотаж особенно эффективен у женщин с тромбозами глубоких вен, рекомендован как во время беременности, так и в послеродовом периоде всем беременным с наследственными тромбофилиями.
Таким образом, надлежащее проведение лечебно-профилактических мероприятий у носительниц тромбофилических генетически обусловленных дефектов гемостаза, способствует снижению риска тромботических осложнений, благоприятному исходу беременности и повышению качества жизни женщины.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.