Особенности микробиоты желудка пациентов с Helicobacter pylori-ассоциированными заболеваниями
- Аннотация
- Статья
- Ссылки
- English
Цель исследования – оценить микробиоту желудка у пациентов с H. pylori-ассоциированными заболеваниями.
Материал и методы. В исследовании участвовали 20 пациентов с хроническими заболеваниями желудка: 10 пациентов – H. pylori-позитивных; 10 – H. pylori-негативных (группа контроля). Пациентам проводился забор образцов слизистой оболочки желудка с последующим гистологическим и микробиологическим исследованиями путем посева на питательные среды, определяли уреазную активность в биоптате и суммарные антитела к антигену CagA H. pylori.
Результаты. У 90% H. pylori-позитивных пациентов отмечен рост Enterococcus spp. на питательной среде против 30% лиц группы контроля (p = 0,02). Рост Enterococcus spp. у больных хеликобактериозом достигал 5,8 [5,2; 6,4] lg КОЕ/г, у H. pylori-негативных лиц – 4,8 [4,3; 5,0] lg КОЕ/г (p = 0,04). В группе контроля не обнаружена грибковая микрофлора, у 40% H. pylori-позитивных лиц рост Candida spp. достигал 5,9 [5,6; 6,4] lg КОЕ/г. Рост Staphylococcus spp. и Lactobacillus spp. не имел достоверных отличий в группах. У пациентов с более выраженными симптомами диспепсии в микробиоте желудка присутствовали Enterococcus spp. (r = 0,52, p < 0,05).
Выводы. Микробиота желудка у пациентов с H. pylori-ассоциированными заболеваниями полиморфна, в ее состав входят Enterococcus spp., Staphylococcus spp., Lactobacillus spp., Candida spp. Enterococcus spp. в три раза чаще присутствуют в микробиоте желудка у H. pylori-позитивных пациентов, чем у H. pylori-негативных лиц (p < 0,05). Присутствие в микробиоте желудка Enterococcus spp. было достоверно связано с более выраженными симптомами диспепсии.
Цель исследования – оценить микробиоту желудка у пациентов с H. pylori-ассоциированными заболеваниями.
Материал и методы. В исследовании участвовали 20 пациентов с хроническими заболеваниями желудка: 10 пациентов – H. pylori-позитивных; 10 – H. pylori-негативных (группа контроля). Пациентам проводился забор образцов слизистой оболочки желудка с последующим гистологическим и микробиологическим исследованиями путем посева на питательные среды, определяли уреазную активность в биоптате и суммарные антитела к антигену CagA H. pylori.
Результаты. У 90% H. pylori-позитивных пациентов отмечен рост Enterococcus spp. на питательной среде против 30% лиц группы контроля (p = 0,02). Рост Enterococcus spp. у больных хеликобактериозом достигал 5,8 [5,2; 6,4] lg КОЕ/г, у H. pylori-негативных лиц – 4,8 [4,3; 5,0] lg КОЕ/г (p = 0,04). В группе контроля не обнаружена грибковая микрофлора, у 40% H. pylori-позитивных лиц рост Candida spp. достигал 5,9 [5,6; 6,4] lg КОЕ/г. Рост Staphylococcus spp. и Lactobacillus spp. не имел достоверных отличий в группах. У пациентов с более выраженными симптомами диспепсии в микробиоте желудка присутствовали Enterococcus spp. (r = 0,52, p < 0,05).
Выводы. Микробиота желудка у пациентов с H. pylori-ассоциированными заболеваниями полиморфна, в ее состав входят Enterococcus spp., Staphylococcus spp., Lactobacillus spp., Candida spp. Enterococcus spp. в три раза чаще присутствуют в микробиоте желудка у H. pylori-позитивных пациентов, чем у H. pylori-негативных лиц (p < 0,05). Присутствие в микробиоте желудка Enterococcus spp. было достоверно связано с более выраженными симптомами диспепсии.

Актуальность темы хеликобактериоза обусловлена связью инфекции с хроническими, широко распространенными среди населения заболеваниями органов пищеварения [1]. Исследования последних лет указывают на полиморфный состав микробиоты желудка, меняющийся в присутствии Helicobacter pylori [2–6]. Полученные данные о многообразии и динамике количественного состава микроорганизмов позволяют расширить представления о патогенетических механизмах повреждения слизистой оболочки желудка. Наиболее часто в составе микробиоты желудка обнаруживают бактерии типов Proteobacteria, Firmicutes, Bacteroidetes, Actinobacteria, рода Fusobacterium, при этом превалирование каких-либо микроорганизмов рассматривается в качестве дополнительного фактора, приводящего к воспалительным и дистрофическим изменениям слизистой оболочки желудка [2–6]. Дисбиоз пищеварительной трубки, связанный с иммунологическими и метаболическими нарушениями, может влиять на дифференцировку и пролиферацию эпителия, в том числе и на физиологию эпителиальных клеток желудка [7–9]. Таким образом, можно полагать, что количественные и качественные изменения микробного сообщества желудка могут проявляться клиническими симптомами, прежде всего диспепсией, и усугублять H. pylori-индуцированные изменения слизистой оболочки желудка.
Основной целью исследования стала оценка микробиоты желудка у пациентов с H. pylori-ассоциированными заболеваниями.
Материал и методы
В исследовании участвовали 20 пациентов (11 женщин и 9 мужчин), обратившихся с диспепсическими жалобами в городской гастроэнтерологический центр для обследования, включающего эзофагогастродуоденоскопию. Средний возраст пациентов составил 54,5 ± 3,6 года. Критерий включения: наличие письменного согласия пациента на участие в исследовании. Критерии исключения: возраст менее 18 лет; прием ингибиторов протонной помпы, пробиотических, антибактериальных препаратов, висмута трикалия дицитрата на момент исследования и (или) в течение предшествующих четырех недель; проведенное в прошлом лечение хеликобактериоза.
При эндоскопическом исследовании всем пациентам проводился забор не менее двух биоптатов, в том числе из антрального отдела и тела желудка. Полученный биологический материал тестировался на наличие инфекции H. pylori путем качественного определения уреазной активности хромогенным методом в биоптате (экспресс-тест АМА RUT Pro, Россия). Диагностические характеристики экспресс-теста: чувствительность 99%, специфичность 99%.
Количество и видовой состав микробиоты желудка определяли путем прямого посева биоптата на питательные среды: энтерококкагар, стафилококкагар, лактобакагар, ГРМ-агар, Сабуро-агар, Эндо. Культивирование проводили при температуре 37 °С в течение двух и пяти суток в аэробных условиях для выделения бактерий и грибов соответственно. Количество микроорганизмов определяли путем подсчета колониеобразующих единиц (lg КОЕ/г), этиологически значимым считалось выделение микроорганизмов из биоптата в количестве ≥104 KОЕ/г [10]. Идентификация микроорганизмов проводилась на основании морфофизиологических, культуральных и биохимических свойств.
Инфицированность H. pylori подтверждалась положительным экспресс-тестом АМА RUT Pro и наличием диагностически значимого уровня суммарных антител классов A, M, G к антигену CagA H. pylori (тест-система «Helicobacter pylori-CagA-антитела-ИФА-БЕСТ», Россия). Чувствительность и специфичность тест-системы по иммуноглобулинам классов A, M, G к антигену CagA H. pylori по стандартной панели предприятия составляет 100%. В ходе проведенного исследования расхождения результатов быстрого уреазного теста и серологического метода не регистрировались. H. pylori-негативными пациентами считались лица с отрицательным быстрым уреазным тестом и отсутствием суммарных антител классов A, M, G к антигену CagA H. pylori.
Подробно изучались жалобы и анамнез заболевания пациентов, результаты имеющихся общеклинических и дополнительных лабораторно-инструментальных обследований.
Статистическая обработка материала исследования проводилась при помощи пакета программного обеспечения Microsoft Excel 2010, Statistica 13.0 с использованием точного критерия Фишера. Различия считались статистически значимыми при p ≤ 0,05. Качественные признаки описывали в процентном отношении, количественные – с помощью медианы и квартилей (Ме [25%; 75%]). Для сравнения медиан использовали U-тест Манна – Уитни. При проведении корреляционного анализа применялась ранговая корреляция Спирмена.
Результаты и обсуждение
В ходе проведенного тестирования у 10 пациентов (семи мужчин и трех женщин) выявлена инфекция H. pylori. Данную группу составляли лица с язвенной болезнью желудка и двенадцатиперстной кишки в стадии обострения, полипами желудка и (или) хроническим поверхностным гастритом.
У 10 больных (двух мужчин и восьми женщин) результаты обследования на хеликобактериоз были отрицательными, данные лица составили контрольную группу. H. pylori-негативные пациенты наблюдались с диагнозами: язвенная болезнь желудка в стадии обострения; полип желудка и (или) хронический поверхностный гастрит.
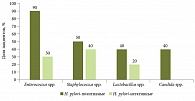
В обеих группах пациентов при посеве образца слизистой оболочки желудка на питательные среды наблюдался рост микроорганизмов (рисунок). Колонизация слизистой оболочки желудка смешанной микрофлорой при использовании простого питательного агара регистрировалась у 70% лиц с хеликобактериозом против 30% у H. pylori-негативных лиц (p = 0,18). Полученные результаты у пациентов с хеликобактериозом можно объяснить уменьшением разнообразия микробной флоры желудка с одновременным превалированием отдельных микроорганизмов, способных колонизировать питательную среду, что можно рассматривать как явление дисбиоза.
Достоверные отличия выявлены в отношении Enterococcus spp., рост которых на питательной среде обнаружен у 90% H. pylori-позитивных пациентов против 30% лиц группы контроля (p = 0,02). Количественный рост Enterococcus spp. у больных хеликобактериозом достигал большего уровня, чем у H. pylori-негативных пациентов, и составил 5,8 [5,2; 6,4] lg КОЕ/г против 4,8 [4,3; 5,0] lg КОЕ/г (p = 0,04) соответственно. Количественный рост Staphylococcus spp. не имел достоверных отличий в группах и регистрировался у H. pylori-позитивных лиц на уровне 4,9 [4,5; 5,5] lg КОЕ/г, а у H. pylori-негативных пациентов на уровне 4,6 [4,3; 5,0] lg КОЕ/г (p = 0,6). Рост Lactobacillus spp. у больных с хеликобактериозом составил 5,5 [4,5; 6,0] lg КОЕ/г, а в группе контроля – 4,8 [4,3; 5,3] lg КОЕ/г (p = 0,5).
Enterococcus spp., грамположительные факультативные анаэробы, относящиеся к типу Firmicutes, заселяют преимущественно дистальные отделы тонкой кишки. Однако при патологической транслокации и избыточном росте энтерококки, обладая факторами вирулентности, способны продуцировать цитокиноподобные вещества, повышать образование активных внутриклеточных форм кислорода [11–13]. Описано участие Enterococcus spp. в воспалительных заболеваниях билиарной системы, дисбиотических нарушениях в тонкой кишке, повреждении клеток эпителия желудка [11, 14, 15]. Уменьшение видового разнообразия микробиоты желудка, избыточный рост отдельных микроорганизмов и накопление продуктов их жизнедеятельности рассматриваются при хеликобактериозе в качестве дополнительных факторов прогрессирования хронического гастрита и канцерогенеза [4–6, 16, 17].
Таким образом, превалирование в микробиоте желудка Enterococcus spp. у H. pylori-позитивных лиц можно рассматривать как дисбиотическое нарушение.
Частота высева микроорганизмов Staphylococcus spp. и Lactobacillus spp. в исследуемых группах не имела достоверного отличия при наблюдающейся тенденции более частого выделения у пациентов с хеликобактериозом. Ни у одного из H. pylori-негативных лиц не обнаружена грибковая микрофлора, в то время как у 40% больных, инфицированных H. pylori, регистрировался высокий уровень колонизации слизистой желудка грибами Candida spp. в количестве 5,9 [5,6; 6,4] lg КОЕ/г.
Присутствие дрожжеподобных грибов у пациентов с хеликобактериозом установлено в ряде исследований и рассматривается как проявление дисбиоза желудочно-кишечного тракта [4, 6, 10, 18].
На основе полученных результатов оценки микробиоты желудка проведено сравнение имевшихся жалоб больных, у которых при посеве биоптата на питательной среде наблюдался рост Enterococcus spp., с жалобами пациентов, у которых присутствие данного микроорганизма не было обнаружено. Развитие дисбиотических процессов часто связано с нарушениями моторики органов пищеварения, которые в свою очередь могут быть следствием хеликобактериоза и проявляться диспепсическими жалобами пациентов [5, 19, 20]. Анализу подверглись симптомы, которые могли быть ассоциированы с нарушением моторики желудка: ощущение тяжести – полноты в эпигастрии после еды, раннего насыщения и вздутия живота. Для статистической обработки и сравнения полученных данных результаты переведены в баллы по методике, предложенной в работе [21]. При отсутствии жалобы присваивалось значение 0 баллов; при наличии жалобы один раз в неделю или реже – 1 балл; два-три раза в неделю – 2 балла; ежедневно – 3 балла; несколько раз в день – 4 балла (таблица).
Установлено, что больные, у которых при посеве биоптата на питательной среде наблюдался рост Enterococcus spp., имели достоверно более выраженные симптомы диспепсии, проявляющиеся ощущением тяжести – полноты в эпигастрии после еды (r = 0,52, p < 0,05), что могло быть следствием желудочного дисбиоза. Не установлено статистически достоверных различий тяжести диспепсии у лиц в зависимости от присутствия в микробиоте желудка Candida spp.
Полученные данные исследования указывают на значимость изучения микробиоты желудка у больных с симптомами диспепсии, открывающего перспективы для использования пробиотических препаратов в лечении данной группы пациентов.
Таким образом, у лиц с H. pylori-ассоциированными заболеваниями в составе аэробной и факультативно-анаэробной микробиоты желудка в три раза чаще присутствуют Enterococcus spp. (p < 0,05) и обнаруживаются Candida spp. в отличие от H. pylori-негативных лиц.
Выводы
Влияние H. pylori на резистентность слизистой оболочки желудка необходимо рассматривать с учетом баланса сопутствующей микрофлоры. Микробиота желудка у пациентов с H. pylori-ассоциированными заболеваниями полиморфна, в ее состав входят Enterococcus spp., Staphylococcus spp., Lactobacillus spp., Candida spp. Результат взаимодействия бактериальных симбиозов, колонизирующих слизистую оболочку желудка, может быть различным в зависимости от преобладания отдельных микроорганизмов. Enterococcus spp. в три раза чаще присутствуют в микробиоте желудка у H. pylori-позитивных пациентов, чем у H. pylori-негативных лиц (p < 0,05).
Присутствие в микробиоте желудка Enterococcus spp. было достоверно связано с более выраженными симптомами диспепсии (r = 0,52, p < 0,05).
Информация о финансовой поддержке.
Выполнение научно-исследовательской работы поддержано по итогам VII Конкурса внутривузовских грантов для молодых ученых ФГБОУ ВО РязГМУ Минздрава России.
T.V. Zhestkova, PhD, A.V. Sankin, O.V. Yevdokimova, PhD, O.N. Zhurina, PhD
Ryazan State Medical University named after academician I.P. Pavlov
Contact person: Tatiana V. Zhestkova, t-zhestkova@bk.ru
Scientists consider changes in the composition of the stomach microbiota in the presence of Helicobacter pylori as an additional factor inducing inflammation and dystrophy of the gastric mucosa.
Purpose. The assessment of the gastric microbiota in patients with H. pylori-associated diseases.
Material and methods. The study involved 20 patients with chronic stomach diseases: 10 patients were H. pylori-positive; 10 persons were H. pylori-negative (control group). Patients underwent sampling of the gastric lining followed by histological and microbiological examination of inoculation on nutrient media, determining the urease activity in the biopsy specimen and total antibodies to the H. pylori CagA antigen.
Results. 90% of H. pylori-positive patients showed growth of Enterococcus spp. on a nutrient medium against 30% of individuals in the control group (p = 0.02). Growth of Enterococcus spp. in patients with helicobacteriosis reached 5.8 [5.2; 6.4] lg CFU/g, in H. pylori-negative persons 4.8 [4.3; 5.0] lg CFU/g (p = 0.04). In the control group, no fungal microflora was found, in 40% of H. pylori-positive individuals, the growth of Candida spp. reached 5.9 [5.6; 6.4] lg CFU/g. Growth of Staphylococcus spp. and Lactobacillus spp. did not have significant differences in the groups. In patients with more severe symptoms of dyspepsia, Enterococcus spp. were present in the stomach microbiota (r = 0.52, p < 0.05).
Conclusion. Microbiota of the stomach in patients with H. pylori-associated diseases is polymorphic; it includes Enterococcus spp., Staphylococcus spp., Lactobacillus spp., Candida spp. Enterococcus spp. are three times more likely to be present in the stomach microbiota in H. pylori-positive patients than in H. pylori-negative individuals (p < 0.05). The presence of Enterococcus spp. in the microbiota of the stomach was significantly associated with more severe symptoms of dyspepsia.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.


