Оценка выживаемости без прогрессирования в подгруппах больных метастатическим раком молочной железы на фоне лечения ингибиторами CDK4/6
- Аннотация
- Статья
- Ссылки
- English
Рак молочной железы (РМЖ) является наиболее распространенным злокачественным новообразованием у женщин. В 2022 г. РМЖ занял второе место в структуре онкологической заболеваемости [1]. В настоящее время РМЖ классифицируют по четырем основным молекулярным подтипам в зависимости от экспрессии рецепторов эстрогена (ЭР), рецепторов прогестерона (ПР) и статуса рецептора эпидермального фактора роста 2-го типа (HER2): люминальный А и люминальный B, HER2-позитивный и тройной негативный подтипы [2]. Из них доля гормонозависимого или эстрогенрецептор-положительного (ЭР+) люминального А- и В-подтипа РМЖ составляет приблизительно от 60 до 70% [3]. Основным видом лечения при распространенном и метастатическом ГР+HER2- РМЖ остается гормонотерапия [4], однако у значительной доли пациенток с мРМЖ спустя некоторое время развивается резистентность к эндокринной терапии (ЭТ) [5]. Изучение механизмов эндокринной резистентности привело к разработке нового класса препаратов – ингибиторов циклин-зависимых киназ 4 и 6 (CDK4/6) [5].
CDK4/6 являются одними из ключевых регуляторов клеточного цикла. CDK4/6 в комплексе с циклином D фосфорилируют белки, необходимые для прохождения клеткой пресинтетического периода (G1) и перехода из G1- в S-фазу, а нарушение контроля на любом этапе клеточного цикла может стать причиной нерегулируемой пролиферации клеток. Когда CDK4/6 активируются циклинами D-типа, комплекс CDK4/6 – циклин D фосфорилирует белок ретинобластомы (pRb), запускает высвобождение транскрипционного фактора E2F из состава комплекса и инициацию экспрессии генов, ответственных за репликацию ДНК. Ингибиторы CDK4/6 связывают и ингибируют сформированный комплекс CDK4/6 – циклин D, что приводит к гипофосфорилированию белка pRb и уменьшению экспрессии генов, контролирующих клеточный цикл, вследствие чего клеточный цикл останавливается и клетка переходит в апоптоз [6].
Рибоциклиб, один из трех представителей класса ингибиторов CDK4/6, предназначен для лечения ГР+HER2- мРМЖ в первой линии у женщин в постменопаузе на основании результатов исследования III фазы MONALEESA-2. В исследовании MONALEESA-2 пациенток с ГР+HER2- мРМЖ разделили на две группы: первая получала комбинацию рибоциклиб + летрозол, вторая — плацебо + летрозол [7]. Допускалась предшествующая терапия ингибиторами ароматазы с условием, что она была прекращена за 12 месяцев до включения пациентки в исследование. Медиана выживаемости без прогрессирования (ВБП) в группе получавших комбинацию рибоциклиб + летрозол составила
25,3 месяца по сравнению с 16 месяцами в группе плацебо + летрозол [8].
В исследовании III фазы MONALEESA-7 рибоциклиб в комбинации с эндокринной терапией в качестве начальной терапии сравнивался с моноэндокринотерапией у женщин с ГР+HER2- распространенным РМЖ в пре- и перименопаузе; медиана ВБП в группе рибоциклиба составила 23,8 месяца, в группе плацебо – 13 месяцев [9].
Еще одно исследование, в котором изучалась эффективность рибоциклиба, – исследование III фазы MONALEESA-3. В нем оценивались эффективность и безопасность рибоциклиба в комбинации с фулвестрантом у женщин в постменопаузе с ГР+HER2- распространенным РМЖ в первой и второй линии терапии. Медиана ВБП в группе рибоциклиб + фулвестрант составила 20,6 месяца; в группе плацебо + фулвестрант – 12,8 месяца [9, 10].
Целью настоящего ретроспективного анализа стала оценка ВБП у 43 пациенток, получавших рибоциклиб в комбинации с ЭТ, а также изучение влияния различных факторов (возраст, ECOG, линия терапии, Ki-67) на время до прогрессирования и ВБП у данной группы пациенток.
Материал и методы
В исследование включены 43 пациентки с первично метастатическим или рецидивирующим ГР+HER2- РМЖ, получавшие рибоциклиб в сочетании с ЭТ независимо от линии терапии с 2019 г. в Красноярском онкологическом диспансере.
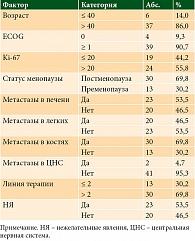
Конечной точкой в ретроспективном исследовании являлась оценка ВБП у пациенток, разделенных на группы по биномиальным категориальным признакам: возраст (≤ 40 и > 40), статус ECOG (0 и ≥ 1), индекс пролиферативной активности Кi-67 (≤ 20 и > 20), статус менопаузы (постменопауза и пременопауза), метастазы в печень (да и нет), метастазы в легкие (да и нет), метастазы в кости (да и нет), метастазы в центральную нервную систему (ЦНС) (да и нет), линия терапии (≤ 2 и > 2), нежелательные явления (НЯ) (да и нет).
Для представления количественной характеристики – количества месяцев до прогрессирования – использовалась медиана (Me) с указанием интерквартильного диапазона (Q1–Q3). Категориальные данные описывались с указанием абсолютных значений и процентных долей. Сравнение двух групп по количественному показателю выполнялось с помощью U-критерия Манна – Уитни, t-критерия Уэлча и t-критерия Стьюдента. Оценка функции ВБП у пациенток проводилась по методу Каплана – Мейера. Анализ ВБП у пациенток проводился по методу регрессии Кокса, подразумевающему прогнозирование риска наступления события для рассматриваемого объекта и оценку влияния заранее определенных независимых переменных (предикторов) на этот риск.
Результаты
В анализ были включены 43 пациентки в возрасте от 31 до 74 лет (средний возраст 55 лет). У 27 (62,8%) из 43 пациенток наступило прогрессирование заболевания на фоне проводимой терапии. Медиана ВБП составила 16 месяцев.
Исследуемая группа была разделена на категории, представленные в табл. 1. Большинство пациенток были старше 40 лет (32/43, 86%); статус ECOG ≥ 1 регистрировался у 39/43 (90,7%) пациенток. 30 из 43 (69,8%) пациенток получили более двух линий терапии до начала лечения рибоциклибом в сочетании с ЭТ; 38 из 43 (88,4%) пациенток имели множественное метастатическое поражение.
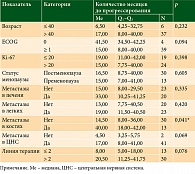
Проведен статистический анализ влияния показателя на прогрессирование заболевания на фоне проводимой терапии. Обнаружено, что пациентки с метастазами в костях получают преимущество в показателе времени до прогрессирования заболевания на фоне проводимой терапии (р < 0,041). Такие факторы, как возраст, ECOG, метастазы в легких, метастазы в ЦНС, линия терапии и НЯ не оказали значимого влияния на время до прогрессирования (табл. 2).
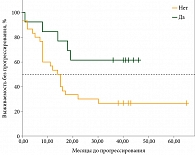
Анализ ВБП показал, что значимое различие в медианах было достигнуто только в подгруппе пациенток, разделенных по признаку наличия/отсутствия метастазов в костях: медиана ВБП в подгруппе без метастазов в костях составила 14,0 месяца (95% допустимый интервал (ДИ): 8,00–22,00), медиана ВБП в подгруппе с метастазами в костях не была достигнута (p = 0,026) (рис.).
В других подгруппах пациенток с ГР+HER2- РМЖ, получавших рибоциклиб в комбинации с ЭТ, значимых различий в медиане ВБП обнаружено не было.
Обсуждение
В ходе работы проведен ретроспективный анализ базы данных пациенток с первично метастатическим или рецидивирующим ГР+HER2- РМЖ, получающих терапию ингибитором CDK4/6 в региональном онкологическом диспансере. Показаны статистически значимые различия во времени до прогрессирования в зависимости от наличия метастазов РМЖ в костях (р = 0,043). Среди пациенток, разделенных на группы в зависимости от возраста, статуса ECOG, наличия метастазов в легких и ЦНС, линии терапии и НЯ, значимых различий во времени до прогрессирования получено не было.
Анализ выживаемости показал статистически значимые различия в ВБП в зависимости от наличия или отсутствия костных метастазов (р = 0,026). Анализ выживаемости для других показателей (ECOG, Кi-67, статус менопаузы, метастазы в печени, легких, ЦНС, НЯ) не показал статистически значимых различий (р > 0,05).
Во всех исследованиях MONALEESA для участия в исследовании требовалось наличие заболевания, поддающегося измерению, в соответствии с критериями оценки ответа при солидных опухолях (RECIST) версии 1.1 или по крайней мере одно преимущественно литическое поражение кости.
В исследовании MONALEESA-2 участвовали 668 пациенток, из них в группе с рибоциклибом у 69 (20,7%) пациенток наблюдалось наличие метастазов только в костях, у 246 (73,7%) пациенток – множественное поражение (включая кости). Для пациенток с метастазами только в костях статистически значимые результаты не были получены (р > 0,05), для пациенток с множественным поражением, включая кости, – p < 0,05.
В MONALEESA-3 зарегистрировано 726 пациенток, из них в группе с рибоциклибом у 103 (21,3%) пациенток наблюдалось только поражение костной ткани, у 367 (75,8%) пациенток – множественные метастазы (включая кости). Относительный риск (Hazard ratio (HR)) наступления прогрессирования у пациенток с костными метастазами при терапии рибоциклибом составил 0,4 при р < 0,05. При множественных метастазах (< 3 и ≥ 3) HR = 0,6 (p < 005) [11].
Клиническое исследование MONALEESA-7 включило 672 пациентки пре- и перименопаузального периода, из них в группе с рибоциклибом 81 (24%) случай единичных метастазов в кости, 251 (75%) – множественные метастазы.
Все характеристики больных в группе с рибоциклибом и в группе с плацебо в рамках исследований были сбалансированы. Показатели HR были в основном одинаковыми, в том числе и при разделении пациенток на группы в зависимости от метастазов в костях (HR = 0,7) и множественных метастазов, включая кости, при количестве очагов метастазирования < 3 (HR = 0,6) и при количестве очагов метастазирования ≥ 3 (HR = 0,5) [11]. Во всех трех исследованиях первичная конечная точка была достигнута и ВБП значительно улучшилась в группе лечения, содержащий рибоциклиб.
Заключение
Проведенный анализ показал, что у пациенток с ГР+HER2- распространенным РМЖ с метастазами в костях при приеме рибоциклиба в сочетании с ЭТ время до прогрессирования и медиана ВБП достоверно больше, чем у пациенток без костных метастазов.
A.V. Zyuzyukina, V.A. Komissarova, R.A. Zukov
V.F. Voyno-Yasenetsky Krasnoyarsk State Medical University
A.I. Kryzhanovsky Krasnoyarsk Regional Clinical Oncology Dispensary
Contact person: Alena V. Zyuzyukina, alena-vz@mail.ru
The emergence of palbociclib, ribociclib and abemacyclib, representatives of a new class of cyclin-dependent kinase 4 and 6 (CDK4/6) inhibitors, in clinical practice has made it possible to achieve a breakthrough in the treatment of patients with hormone-positive HER2-negative breast cancer, especially in the treatment of patients with a high prevalence of the disease and the risk of visceral crisis. The manageable safety profile is a significant argument in favor of choosing the tactics of using CDK4/6 inhibitors.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.