Клинические аспекты классификации меланомы кожи
- Аннотация
- Статья
- Ссылки
- English
![Таблица 1. Частота встречаемости активирующих мутаций при меланоме, % [29]](/upload/resize_cache/iblock/267/195_350_1/korchagina2.jpg)
![Таблица 3. Клинические аспекты генетической классификации меланомы кожи [39]](/upload/resize_cache/iblock/504/195_350_1/korchagina4.jpg)
Меланома – злокачественная опухоль, возникающая из трансформированных меланоцитов. Эти пигментпродуцирующие клетки имеют нейроэктодермальное происхождение и в процессе эмбриогенеза мигрируют из нервного гребешка в эпидермис и другие сайты, включая менингеальные, слизистые оболочки и сетчатку глаза.
Несмотря на то что меланома может развиваться в любой ткани, где в норме присутствуют меланоциты, кожная локализация остается наиболее распространенной – до 90% всех случаев заболевания [1].
Уровень заболеваемости в мире варьируется от 37 на 100 000 в Австралии до 0,2 на 100 000 в Южной и Центральной Азии. Это напрямую связано с уровнем инсоляции как ведущим фактором развития меланомы. Кроме того, имеет значение фототип кожи по Фитцпатрику, преобладающий среди населения [1].
К сожалению, в отличие от многих солидных опухолей заболеваемость меланомой растет. Так, в США, Великобритании, Швеции и Норвегии число случаев меланомы увеличилось более чем на 3% за последние несколько лет. По оценкам ряда авторов, такая тенденция сохранится по крайней мере до 2022 г. [2].
Прогноз заболевания зависит главным образом от стадии на момент постановки диагноза. При увеличении толщины опухоли по Бреслоу возрастает риск регионарных и отдаленных метастазов.
До недавнего времени приемлемо эффективной терапии для пациентов с метастатической меланомой не существовало. Фундаментальные открытия в области изучения генетических нарушений при меланоме привели к значительному увеличению продолжительности жизни больных с продвинутыми стадиями. Это делает молекулярную классификацию меланомы не только интересной с точки зрения научных изысканий, но и практически значимой при выборе индивидуализированной терапии.
Морфологическая классификация
Согласно морфологической классификации Всемирной организации здравоохранения, выделяют следующие гистологические типы первичной меланомы кожи: поверхностно распространяющуюся, узловую, меланому типа злокачественного лентиго, акрально-лентигинозную, невоидную, меланому у детей, десмопластическую, меланому, возникающую на фоне гигантского врожденного невуса, меланому, развивающуюся на фоне голубого невуса, персистирующую [3]. Среди всех подтипов наиболее распространены узловая и поверхностно распространяющаяся – до 85% всех случаев меланомы. В целом прогностической значимости между гистологическими подгруппами не отмечается, значение имеет скорее присущая каждой из них толщина опухоли [4]. Так, показатель по Бреслоу узловой меланомы выше такового поверхностно распространяющейся меланомы. В то же время прогноз злокачественного лентиго не лучше, чем у других гистотипов при их стратификации по толщине. Интересна связь морфологических особенностей строения меланомы и драйверной мутации [5]. Десмопластической меланоме присущи особенности морфологической и иммуногистохимической диагностики. Способность опухолевых клеток к пери- и интраневральному распространению обусловливает частые местные рецидивы после хирургического лечения [6].
Меланома детского возраста крайне редка, частота ее возникновения в возрасте до 15 лет около 1/1 000 000, или 1,2% всех случаев злокачественных опухолей в этой группе [7].
К акральным относят меланомы, развивающиеся на ладонях, подошвах, и подногтевые меланомы. На их долю приходится около 3% общего числа меланом. Этот тип наиболее выражен у чернокожих пациентов. Считается, что акральная локализация связана с неудовлетворительным прогнозом. Однако это скорее обусловлено не столько морфофенотипическими особенностями, сколько поздней диагностикой [8].
Злокачественное лентиго и злокачественная лентиго-меланома развиваются на коже, подвергающейся хроническому солнечному облучению, что предопределяет их преимущественную локализацию на лице, шее, голове. Кроме того, заболевания чаще наблюдаются у пациентов старшей возрастной группы [9].
Факторы, влияющие на стадию заболевания
Толщина по Бреслоу
Толщина первичной опухоли была введена как прогностический фактор Александром Бреслоу еще в 1970 г. Впоследствии ее значение было подтверждено в исследованиях [10].
Увеличение толщины означает рост метастатического риска и коррелирует со снижением выживаемости.
Установлено, что с увеличением толщины опухоли значительно уменьшается пяти- и десятилетняя выживаемость [4].
Толщину опухоли измеряют только при микроскопическом исследовании, с использованием микрометра. Измерение проводят от вершины рогового слоя или основания язвенного дефекта до самой глубокой точки инвазии опухолевых клеток. При этом не учитываются распространение вдоль придатков кожи, участки регресса и сателлиты. В тех случаях, когда проведена панч- или поверхностная шейв-биопсия, разрешается суммирование двух максимальных размеров в биопсийном и операционном материале с обязательным указанием в морфологическом заключении. Если иссечение проведено не на всю толщу образования, рекомендуется указывать толщину по Бреслоу с формулировкой «не менее».
Изъязвление
Изъязвление – второй крайне важный параметр, на основании которого Т-критерий разделяют на подгруппы «а» и «б». При многофакторном анализе установлено, что наличие изъязвления соотносится с более высоким риском развития метастазов и значительно худшим прогнозом [4]. Отмечается положительная корреляция между изъязвлением и толщиной опухоли [11].
Истинное изъязвление подразумевает комбинацию признаков: полнослойное повреждение эпидермиса (включая шиповатый слой и базальную мембрану), реактивные изменения (отложения фибрина, инфильтрация нейтрофилами, истончение или реактивная гиперплазия окружающего эпидермиса).
При оценке этого параметра важно учитывать анамнестические данные о наличии травмы или предшествующей биопсии образования.
Некоторые авторы рекомендуют указывать степень изъязвления в виде диаметра в миллиметрах или процентах к общему объему поражения. По данным C.M. Balch и соавт., пятилетняя выживаемость у пациентов с поверхностью изъязвления менее 6 мм составляет 44% (5% в группе с диаметром более 6 мм) (p < 0,001) [12].
Митотическая активность
Пролиферативная активность первичной меланомы, определяемая по митотическому индексу, – сильный и независимый прогностический фактор выживаемости [13]. Не случайно в 7-м издании Международной классификации стадий злокачественных новообразований TNM (tumor, nodus, metastasis) митотический индекс первичной опухоли вошел в число обязательно определяемых показателей. Статистической проверке подверглось множество пограничных значений митотического индекса. Наибольшая корреляция с выживаемостью установлена для пограничного значения 1/мм2.
Согласно базе данных по меланоме (Melanoma Staging Database) Американского объединенного онкологического комитета (American Joint Committee on Cancer, AJCC), существует выраженная корреляция между увеличением митотического индекса и снижением выживаемости (p < 0,0001). При многофакторном анализе у 10 233 пациентов с клинически локализованной меланомой митотический индекс был вторым наиболее сильным прогностическим фактором выживаемости после толщины опухоли (p < 0,0001).
Хотя меланомы толщиной до 1 мм относят к группе с хорошим прогнозом, в зависимости от вторичных характеристик (митотический индекс и изъязвление опухоли) десятилетняя выживаемость колеблется от 85 до 99%. При многофакторном анализе 4861 случая T1-меланом толщина опухоли, митотический индекс и изъязвление были наиболее сильными прогностическими факторами выживаемости. При включении в анализ этих показателей уровень инвазии по Кларку больше не имел статистической значимости. В 7-й редакции TNM показатель митотической активности используется наряду с изъязвлением для разделения тонких меланом Т1 на подгруппы «а» и «б» [14].
Митотическая активность определяется как число митозов на 1 мм2, что составляет примерно четыре поля зрения при большом увеличении микроскопа. Подсчет начинают с поиска «горячего пятна», то есть участка дермы с максимальным количеством митозов. Далее последовательно доводят площадь измерения до 1 мм. Если «горячее пятно» не обнаружено, подсчет начинают с любого репрезентативного участка.
Сателлиты, транзитные метастазы
Сателлиты и транзитные метастазы представляют собой скопления в лимфатических сосудах опухолевых клеток меланомы диаметром более 0,05 мм, четко отграниченные от основного инвазивного компонента меланомы нормальной дермой или клетчаткой и расположенные на расстоянии не менее 0,3 мм от первичной опухоли. Структуры, удовлетворяющие названным критериям, расположенные на расстоянии до 2 см от опухолевого узла, относят к сателлитам, более 2 см, но расположенные до регионарных лимфатических узлов, – к транзитным метастазам. Сателлиты и/или транзитные метастазы служат фактором неблагоприятного прогноза, прежде всего за счет риска локорегионарного рецидива, и стадируются как N2c или N3 в зависимости от наличия или отсутствия поражения регионарных лимфатических узлов.
Все остальные кожные метастазы, не подпадающие под указанные критерии, относятся к отдаленным и стадируются как М1.
Факторы, влияющие на прогноз
Согласно данным AJCC, прогностические параметры обязательно отражаются в гистологическом заключении.
Уровень инвазии по Кларку
Выделяют пять анатомических уровней инвазии по Кларку в соответствии с наибольшей степенью инвазии опухолевых клеток.
Согласно AJCC7, митотическая активность по сути заменяет уровень Кларка в качестве параметра, влияющего на стадию Т1 в отсутствие изъязвления [4].
Исключение составляют случаи, когда изъязвление отсутствует и пролиферативная активность не может быть измерена. Уровень инвазии по Кларку 4 или 5 в такой ситуации позволяет отнести меланому к Т1b.
Фаза роста
Радиальная фаза роста может иметь in situ, или инвазивный компонент (так называемая микроинвазивная меланома). Основными признаками перехода в вертикальную фазу роста являются уровень инвазии по Кларку 3 и более, преобладание гнезд в дерме по сравнению с эпидермисом, отсутствие признаков «созревания», редукция лимфоцитарной инфильтрации по сравнению с фазой радиального роста, меньшая пигментация и больший атипизм клеток. Вертикальная фаза роста всегда инвазивная и имеет более высокий потенциал метастазирования [15].
Узловые меланомы не имеют фазы радиального роста [16].
Лимфоцитарная инфильтрация
По данным многочисленных исследований, наличие опухоль-инфильтрирующих лимфоцитов связано с более благоприятным прогнозом [17, 18]. Кроме того, выраженная лимфоцитарная инфильтрация ассоциирована с менее частым обнаружением позитивных сигнальных лимфатических узлов [19]. По степени и расположению лимфоцитарного инфильтрата в опухоли выделяют:
- brisk – лимфоциты диффузно инфильтрируют всю опухоль, разбивая ее на группы или отдельные клетки (непрерывная инфильтрация всего периферического края);
- non-brisk – лимфоциты инфильтрируют опухоль только фокально (прерывистая/неполная инфильтрация периферического края);
- absent – лимфоциты присутствуют, но не инфильтрируют опухоль (отсутствие лимфоцитарной инфильтрации).
Регрессия
При меланомах феномен регрессии встречается в шесть раз чаще, чем при других солидных опухолях [20]. Точка в споре о прогностическом значении этого параметра до сих пор не поставлена. Одни авторы регрессию в тонких меланомах связывают, как правило, с метастазированием [21], другие подобной корреляции не обнаруживают [22].
Данные последних исследований показывают, что в основе регрессии лежит активация иммунных механизмов защиты. Кроме того, наличие регрессии обусловлено уменьшением риска поражения позитивных лимфатических узлов [23].
Морфологически регрессия проявляется в виде вариабельного разрушения клеток меланомы с частичным или почти полным отсутствием опухолевых клеток в дерме, вариабельного лимфогистиоцитарного инфильтрата, фиброза в дерме, меланофагоцитоза, отека и вертикально ориентированных эктатических кровеносных сосудов [24].
Полный регресс опухоли стадируется как T0.
Лимфоваскулярная инфильтрация и нейротропизм
Лимфоваскулярная инвазия определяется наличием клеток меланомы в просвете лимфатических или кровеносных сосудов. В первичной меланоме она связана с более высоким риском метастазов в лимфатических узлах, а также сателлитов и транзитных метастазов [25], хотя это подтверждается не всеми авторами. В исследовании F. Tas и K. Erturk с участием 705 пациентов показано влияние лимфоваскулярной инвазии на безрецидивную и общую выживаемость [26].
Определение нейротропизма включает наличие клеток меланомы вокруг нервных волокон (периневральная инвазия) или внутри волокон (интраневральная инвазия). Периневральная инвазия/нейротропизм коррелирует с более высокой частотой рецидивов [27].
Изменения в 8-й редакции TNM
С 2018 г. вступит в силу 8-я редакция TNM [28].
Т (tumor)
Основные изменения коснулись разделения категории Т1 на подгруппы «а» и «б». В настоящей классификации митотическая активность больше не влияет на стадирование, однако остается важным прогностическим параметром и указывается для всех инвазивных меланом. Вместо данного параметра, наряду с изъязвлением, введен показатель по Бреслоу с пороговым значением 0,8 мм. К T1a относятся меланомы с толщиной по Бреслоу менее 0,8 мм без изъязвления, к T1b – с толщиной от 0,8 мм до 1 мм и изъязвлением независимо от толщины меланомы.
Изменения коснулись и непосредственно порядка измерения. Значение толщины рекомендовано указывать с точностью до 0,1 знака после запятой. Измерение до 0,01 мм имеет низкую воспроизводимость. Исключением может быть меланома толщиной менее 1 мм.
N (nodus)
Термины «макрометастазы» и «микрометастазы», характеризующие состояние зон регионарного лимфооттока, в новой редакции заменены на «клинически выявляемые» и «клинически недетектируемые и обнаруженные при биопсии сигнального лимфатического узла».
Метастазы, определяемые только по результатам биопсии сигнального лимфатического узла, стадируются на N1a, N2a, N3a в зависимости от количества пораженных узлов. Клинически определяемые метастазы стадируются на N1b, N2b, N3b также в зависимости от количества пораженных узлов. Особое внимание уделено сателлитам и транзитным метастазам. При их наличии имеют место стадии N1с, N2с, N3с в зависимости от статуса регионарных лимфатических узлов.
При подгрупповом анализе выживаемости пациентов со стадией III заболевания с учетом одновременно категорий Т и N выделена новая подгруппа IIID (T4bN3a/b/cM0) с самым неблагоприятным прогнозом.
M (metastasis)
При определении М-критерия значение имеют локализация отдаленных метастазов и уровень лактатдегидрогеназы (ЛДГ).
M1a – поражение кожи и мягких тканей, включая мышцы, M1b – поражение легких, M1c – поражение других висцеральных органов, кроме центральной нервной системы (ЦНС).
В новой редакции в отдельную группу M1d выделены пациенты с метастатическим поражением ЦНС как самую прогностически неблагоприятную. Уровень ЛДГ указывается и влияет на субкатегории при любом анатомическом сайте метастатического поражения M1a/b/c/d (0/I).
Молекулярно-генетическая классификация меланомы кожи
Современный уровень знаний в области молекулярной биологии меланомы и связанные с этим успехи таргетной терапии диктуют необходимость разделения меланомы кожи на молекулярно-генетические подтипы.
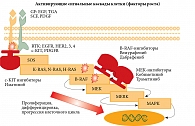
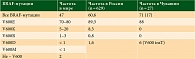
С практической точки зрения целесообразно выделять меланому кожи с мутациями BRAF V600, RAS и KIT. Данные мутации определяют активацию MAP-киназного каскада, отвечающего за пролиферацию и прогрессию клеточного цикла, и лежат в основе современной таргетной терапии (рисунок). Частота встречаемости различных мутаций зависит от локализации меланомы и характера ультрафиолетового воздействия (табл. 1) [29].
Мутации в гене BRAF являются наиболее частыми активирующими мутациями у пациентов с меланомой кожи (более 50%) и могут обнаруживаться как в первичном очаге, так и в метастазах [29, 30]. По данным Российской скрининговой программы, мутация BRAF встречается с частотой 60,6% (627 мутаций из 1035 исследований), чаще у молодых пациентов (до 50 лет – 72,9%, старше 50 лет – 57,1%; p = 0,00003). В возрастной группе 30–39 лет частота мутации BRAF достигает 81% [31]. Подавляющее большинство мутаций в гене BRAF определяются в кодоне V600 (табл. 2) [29]. Это, с одной стороны, существенно облегчает диагностику, с другой – предопределяет сходные конформационные изменения белка, приводящие к активации сигнального каскада, и позволяет разработать единый подход к таргетной терапии. В исследовании BRIM3 отмечалась сопоставимая эффективность таргетной терапии при мутациях BRAF V600E/K [32]. Эффективность ингибиторов BRAF при других типах мутаций требует дальнейшего изучения ввиду незначительного числа наблюдений. Оптимальной стратегией таргетной терапии меланомы кожи при наличии мутаций BRAF V600E/K на сегодняшний день считается комбинация ингибиторов BRAF и MEK (дабрафениб + траметиниб или вемурафениб + кобиметиниб) [33, 34].
Мутация в гене NRAS является второй по частоте у пациентов с меланомой кожи и составляет от 10 до 20% в зависимости от локализации и уровня инсоляции (табл. 1) [29]. Данная мутация также характеризуется наличием «горячих точек» (hot-spot) (85% мутаций локализуются в 61-м кодоне, еще 15% – в 12-м и 13-м кодонах) и сопряжена с агрессивным течением и неудовлетворительным прогнозом [35]. Основными стратегиями таргетной терапии при мутациях NRAS являются использование ингибиторов MEK (биниметиниб, NEMO trial) [36] и комбинаций ингибиторов MEK и CDK4 (биниметиниб + рибоциклиб) [37], однако эти подходы нуждаются в дальнейшем изучении.
Мутация в гене рецепторной тирозинкиназы c-KIT может играть ключевую роль в патогенезе до 20% меланом слизистой локализации и до 15% – акральной [29]. До 73% мутаций составляют пять hot-spot-мутаций в кодонах 6, 11, 13, 17 и 18, и частота объективного ответа на ингибиторы с-KIT (иматиниб, нилотиниб) может достигать 16–29% [38].
Наиболее фундаментальной является генетическая классификация меланомы кожи, разработанная коллективом авторов в рамках Cancer Genom Atlas Network (TCGA) [39]. На основании полногеномного изучения ДНК и экспрессионного анализа РНК, микро-РНК и протеинов 333 опухолевых образцов меланомы от 331 пациента (67 первичных и 266 метастатических меланом) было выделено четыре генетических подтипа в зависимости от ведущих повреждений генома: BRAF-мутированная, RAS-мутированная, NF1-мутированная и трижды негативная (triple-wild-type) меланома. Интересно, что мутационная нагрузка при меланоме выше, чем при других типах опухолей, изученных ранее по программе TCGA. До 76% мутаций в первичных меланомах и 84% мутаций в метастатических меланомах связаны с ультрафиолетовым воздействием.
BRAF-подтип считается самым распространенным (52%) и характеризуется hot-spot-мутациями в гене BRAF (V600E, V600K, V600R, K601) и более молодым возрастом пациентов.
Второй по распространенности RAS-подтип (28%) характеризуется hot-spot-мутациями (Q61, G12, G13) и гиперэкспрессией AKT3-сигналинга.
Для NF1-подтипа (14%) свойственны мутации в гене нейрофиброматоза 1-го типа и альтернативные (not-hot-spot) мутации в гене BRAF. Большая часть мутаций NF1 относится к мутациям «потери функции» (loss-of-function) и приводит к альтернативной активации MAP-киназного каскада. Для данного подтипа характерны более старший возраст пациентов и большая мутационная нагрузка.
Triple-wild-type – самый редкий подтип (6%). При таком подтипе имеют место мутации и амплификации гена KIT, PDGFRa, VEGFR1, GNA11 и GNAQ. Данный подтип имеет низкие показатели сигнатур, ассоциированных с ультрафиолетовой компонентой (30% против > 90% для остальных трех типов), и высокую частоту изменения копийности генов и сложных комплексных перестроек.
Следует отметить, что частота гиперэкспрессии иммунных сигнатур и лимфоидной инфильтрации сопоставима при всех генетических подтипах и служит основным благоприятным прогностическим фактором.
Клиническое значение генетической классификации меланомы кожи отражено в табл. 3 [39].
K.S. Korchagina, S.V. Gamayunov, L.A. Voropayeva
Republican Clinical Oncologic Dispensary of Ministry of Health of the Chuvash Republic
I.N. Ulyanov Chuvash State University
Privolzhsky Federal Medical Research Center
Contact person: Kseniya Sergeyevna Korchagina, ksenija-korchagina@rambler.ru
The article describes the main clinical aspects of the classification of skin melanoma, including the parameters influencing the staging, prognostic and predictive factors as well as changes in the TNM classification of the 8th edition. Special attention is paid to modern conceptions of genetic disorders in melanoma and targeted therapy strategies.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.