Патофизиология и современные возможности профилактики развития и снижения количества поствоспалительных (атрофических) рубцов при акне
- Аннотация
- Статья
- Ссылки
- English

Введение
В настоящее время акне рассматривается как хроническое воспалительное заболевание сальных желез, характеризующееся преимущественным проявлением в подростковом возрасте и развитием полиморфной сыпи: комедоны, папулы, пустулы, узлы, кисты, флегмоны и рубцы [1]. Формирование акне ожидаемо у пациентов в возрасте от 14 лет до 21 года, но его выраженность может быть обусловлена действием большого количества экзогенных и эндогенных факторов, которые включают наследственную предрасположенность, гормональные и метаболические отклонения, сопутствующие заболевания и прием медикаментов (стероиды, цитостатики, витамины, биологические добавки, психотропные и противосудорожные лекарственные средства, а также генно-инженерные биологические препараты). Важную роль в развитии воспалительных проявлений при акне определяет нерациональное применение косметических средств и процедур, скарификация элементов сыпи пациентами, применение маскирующей косметики и фотопротекторов, употребление в пищу продуктов с большим гликемическим индексом, стресс и даже физические нагрузки [2–4].
Преимущественное расположение патологического процесса на открытых участках кожного покрова при акне, особенно в подростковом возрасте, способствует развитию психосоциальных отклонений, которые часто сопровождаются диссомнией [5] с последующим развитием разной степени выраженности тревожно-депрессивных расстройств, требующих участия врачей-психиатров [6]. Существенное влияние на физическое и психологическое благополучие пациентов с акне оказывает развитие симптомокомплекса постакне – рубцы регистрируются у 26% пациентов [7]. Данные косметические дефекты могут иметь длительный характер течения и в некоторых случаях сохраняться на всю оставшуюся жизнь, а их коррекция с использованием современных аппаратных или косметических методик оборачивается для пациентов серьезными финансовыми расходами. Наличие выраженных явлений постакне может оказать влияние на выбор профессии пациентов, способствовать возникновению трудностей в межличностных отношениях среди сверстников, а также в общественной деятельности и создании семьи [8].
На сегодняшний день существуют два основных направления в устранении явлений постакне: профилактика и коррекция [9]. Но, несмотря на то что разработано множество методов, способных сократить выраженность рубцов после разрешения акне (пилинги, лазерная шлифовка, фракционная радиочастота, микродермабразия, лазерная коагуляция сосудов, введение филлеров и другие), многие из них могут быть труднодоступны для пациентов [10]. Таким образом, в современных условиях основной целью в терапии акне должно быть не только устранение клинических признаков дерматоза, но и достижение косметически комфортного качества кожи для каждого пациента с использованием современных методов профилактики формирования рубцов.
Патофизиология развития рубцов при акне
С целью совершенствования терапии акне продолжается изучение патогенеза данного дерматоза, а также уделяется внимание патофизиологическим процессам, обуславливающим формирование поствоспалительных рубцов.
Основной причиной развития акне является андрогензависимая пролиферация себоцитов и нарушение дренажа сальной железы. По мере прогрессирования данного процесса происходит трансформация нормального фолликулярного канала в микрокомедоны и снижение разнообразия филотипов анаэроба Cutibacterium acnes с развитием воспалительных процессов внутри сальной железы и вокруг волосяного фолликула. Однако формирование воспалительной реакции не всегда происходит линейно, а современные исследования позволили установить, что воспаление присутствует при всех формах акне [11].
В доклиническом периоде при формировании комедонов в сальных железах, нижних отделах волосяных фолликулов и в окружающей видимой здоровой коже уже обнаруживаются большое количество CD4+ Т-хелперов и экспрессия интерлейкина (ИЛ) 1, а с увеличением ферментативной активности C. acnes происходит индукция активной пролиферации Т-клеток, что приводит к формированию перифолликулярного полиморфного инфильтрата. Скопление «провоспалительных» липидов и активизация C. acnes через TLR-2 и TLR-4 увеличивает продукцию интерферона γ, фактора некроза опухоли α (ФНО- α), ИЛ-6, ИЛ-8, и ИЛ-17A, что активизирует миграцию макрофагов и других эффекторных клеток в зону повреждения и проявляется формированием клинического воспаления (папулы, пустулы и узлы) [12, 13].
Очевидно, что интенсивность развития рубцов коррелирует с выраженностью воспаления, а значит и со степенью тяжести течения акне. В классическом взгляде на проблему механизма развития поствоспалительных рубцов их формирование обусловлено разрывом абсцесса внутри фолликула, однако современные знания о патофизиологии акне объясняют возможность развития постакне при легких формах данного заболевания [14].
При длительном существовании воспалительных элементов акне или при наличии раневой поверхности в результате скарификации или самопроизвольного вскрытия пустул активизируются процессы формирования грануляционной ткани, которые инициируются с образования новых капилляров и замены нейтрофилов макрофагами. Активная продукция различных факторов роста (тромбоцитарного фактора роста (PDGF), фактора роста фибробластов (FGFs) и трансформирующих факторов роста α и β (TGF-α и TGF-β)) макрофагами способствует миграции и пролиферации фибробластов в зону повреждения с последующим развитием коллагенообразования [15]. Выработка коллагена фибробластами начинается примерно через 3–5 дней после формирования раневой поверхности кожи, а скорость его накопления регулируется уровнем матриксных металлопротеиназ (ММP). На ранней стадии формирования рубца преобладает коллаген III типа с небольшим процентом (20%) коллагена I типа. Далее баланс типов коллагена в зрелых рубцах смещается в сторону коллагена I типа (80%) [16]. Как правило, при гиперэкспрессии TGF-β во время первой фазы заживления раны формируются гипертрофические рубцы, при медленном заживлении с низким уровнем факторов роста – атрофические рубцы [17].
Формирование рубцов при акне, а также их форма и выраженность определяются совокупностью различных факторов.
- Генетически детерминированная реакция кожи на повреждение. Считается, что нейронально экспрессируемый ген 4 (NEDD4) влияет на уровень активности формирования патологических рубцов, усиливая пролиферацию и инвазивность фибробластов, активируя TGF-β и сигнальный путь катенина [18]. Ген WNT10A обуславливает формирование тяжелых форм акне и гипертрофических рубцов путем регуляции теломеразы [19]. CC-генотип матриксной металлопротеиназы (ММP-2) является специфическим иммунологическим фактором, который также связан с развитием акне и формированием рубцовых изменений кожи [20].
- Длительность течения акне. По мере продолжительности воспалительной фазы акне наблюдается повышение экспрессии провоспалительных цитокинов и снижение противовоспалительного ИЛ-10. Исследования также показали, что ФНО-α, ИЛ-4 и ИЛ-13 приводят к выработке TGF-β, фактора роста эндотелия сосудов (VEGF) и PDGF, а ИЛ-6 также влияет на секрецию белков-предшественников MMP-1 и MMP-3, что формирует предпосылки для активного образования рубцов [21].
- Способность C. acnes генерировать коллагеназы, разрушающие коллаген.
- Образование абсцессов внутри фолликулов и их разрыв с быстрой регенерацией поврежденных тканей [7].
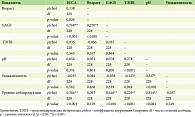
На кафедре дерматовенерологии и косметологии Центральной государственной медицинской академии Управления делами Президента РФ было проведено всестороннее исследование с целью определения современных особенностей течения акне. В рамках клинического обследования 230 пациентов (129 (56,09%) мужчин и 101 (43,91%) женщина) с различными формами акне в возрасте старше 18 лет (медиана возраста всех пациентов 21,0 [19,0; 22,0] года: у мужчин – 20,0 [20,0; 22,0], у женщин – 22 [20,0; 23,0]) была произведена оценка степени выраженности постакне в зависимости от пола и возраста пациентов, степени выраженности отклонений функциональной активности эпидермального барьера и тяжести течения акне. Для определения выраженности явлений постакне использовали количественную шкалу рубцов постакне Échelle D'évaluation Clinique Des Cicatrices D'acné (ECCA), для степени тяжести акне – шкалу Global Acne Grading System (GAGS); фиксация показателей функции эпидермального барьера производилась при помощи аппарата Cutometer Multi Probe Adapter (MPA) 580. Было установлено, что степень выраженности постакне достоверно была более значительной у пациентов мужского пола – средние значения индекса ECCA 57,2 ± 44,3 балла по сравнению с этим показателем у женщин – 32,3 ± 27,9 (t = 4,76; р < 0,001), а также прямо коррелировала со степенью тяжести дерматоза (р < 0,001). Помимо этого, в данном исследовании была констатирована положительная достоверная корреляционная связь выраженности постакне и возраста пациентов (р = 0,024), а также прочная зависимость увеличения тяжести и количества стойких косметических дефектов после разрешения элементов акне при повышении продукции кожного сала (р < 0,001) (таблица).
Таким образом, данное исследование позволило установить еще три важных прогностических фактора развития рубцов постакне – мужской пол, возраст и гиперсеборея.
Профилактика развития поствоспалительных рубцов у пациентов с акне
В международной и отечественной литературе, посвященной коррекции косметических дефектов после разрешения акне, преимущественно описываются методики лечения рубцов с использованием различных инвазивных физических методов, которые рекомендовано применять после завершения основного курса лечения акне либо на этапе лечения после устранения клинических признаков воспаления [7, 16, 17]. С учетом полученных данных в современных исследованиях, а также в собственных клинических наблюдениях становится очевидным, что мероприятия по профилактике развития постакне должны проводиться на ранних этапах лечения дерматоза с использованием препаратов, обладающих способностью быстро купировать проявления воспаления и устранять патологический фолликулярный гиперкератоз как основной субстрат, способствующий развитию дисбиоза в сально-волосяном фолликуле.
С 1982 г. ретиноиды являются важным классом лекарственных препаратов, которые применяются для лечения широкого спектра патологий, сопровождающихся воспалением и нарушением процессов кератинизации, включая акне, псориаз, лимфому кожи, ихтиоз, предраки и фотостарение. В последние десятилетия ретиноиды активно применяются в косметологии на основании результатов клинических исследований, свидетельствующих о том, что ретиноиды могут стимулировать повышение выработки проколлагена в фибробластах кожи и повышать толщину эпидермиса. Интенсивные исследования биологии кожи позволили установить, что клеточные эффекты их метаболита обеспечиваются через взаимодействие с рецептором ретиноевой кислоты (RAR) и ретиноидным Х рецептором (RXR), которые представлены в трех изоформах (α, β, γ), а также значительно расширить область применения ретиноидов и синтезировать новые соединения, обладающие селективностью в отношении определенных рецепторов, что позволяет достигнуть более таргетного действия препаратов данной группы и снизить риск развития нежелательных эффектов [22].
Трифаротен, входящий в состав крема для наружного применения Аклиф, является ароматическим ретиноидом четвертого поколения с избирательным действием только в отношении RARγ (самая распространенная изоформа рецептора в эпидермисе). Доклиническая фармакологическая оценка трифаротена продемонстрировала устойчивую и более выраженную комедонолитическую, противовоспалительную и депигментирующую активность по сравнению с другими ретиноидами предыдущих поколений. Транскриптомный анализ и исследование экспрессии генов показали, что трифаротен уникальным образом воздействует на гены, участвующие в миграции клеток, воспалении и преобразовании внеклеточного матрикса с одновременной понижающей регуляцией профибротических макрофагов [23]. Таким образом, применение данного препарата с целью предупреждения формирования симптомокомплекса постакне теоретически было обосновано.
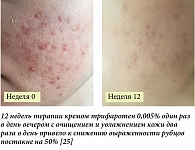
В международном, мультицентровом клиническом исследовании START (Study of Trifarotene cream to Assess on Risk of aTrophic acne scar formation) была проведена оценка клинической эффективности крема, содержащего 0,005% трифаротена, применяемого один раз в сутки вечером, для лечения 121 пациента (мужского и женского пола в возрасте 17–34 лет) с акне средней и тяжелой степени тяжести (IGA = 3 или 4, ≥ 20 воспалительных элементов всего с ≥ 10 на каждой половине лица, ≤ 2 узлов) на разных участках лица (с рандомизацией в группы правой и левой половины лица). Во время каждого визита пациентов в исследовательский центр оценивали количество атрофических рубцов по Глобальной шкале оценки рубцов SGA (Scar Global Assessment с пятибалльной шкалой, где 0 – чистая кожа, а 4 – тяжелая степень) и тяжести течения акне по Глобальной шкале оценки исследователя IGA (Investigator’s Global Assessment с пятибалльной шкалой, где 0 – чистая кожа, а 4 – тяжелая степень). Пациенты в течение 24 недель должны были наносить на одну сторону лица крем с 0,005% трифаротена, на другую – основу крема (плацебо) один раз в сутки вечером. Сторону нанесения определяли при помощи компьютерной слепой рандомизации пациентов.
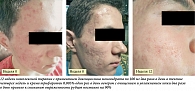
В данном исследовании было показано, что статистически значимое, более выраженное снижение количества атрофических постакне рубцов наблюдалось на стороне лица, на которую наносили крем с трифаротеном. На 24-й неделе среднее абсолютное изменение количества рубцов относительно исходного уровня составляло -6,2 ± 5,6 на сторонах лица, на которые наносили трифаротен, по сравнению с -2,8 ± 3,9 на стороне лица, где применяли плацебо (Δ = -3,2; p < 0,0001). Это было главным образом обусловлено более выраженным снижением количества атрофических постакне рубцов размером 2–4 мм. Как показано, разница между разными сторонами лица была зарегистрирована уже на второй неделе терапии (р = 0,001), она сохранялась на четвертой неделе (р = 0,007) и в период с восьмой по 20-ю недели (р < 0,0001). Общее количество рубцов было схожим в группах на исходном уровне (ИУ): 11,4 – в группе трифаротена и 11,6 – в группе плацебо, а к 24-й неделе их количество составляло 5,4 ± 5,6 – на стороне лица, на которую наносился трифаротен, и 9,1 ± 8,6 – на стороне лица, где применяли основу крема (процентное снижение к 24-й неделе составило 55,2 и 29,9% соответственно) [24] (рис. 1).
Общее количество элементов акне (воспалительных и невоспалительных) составило 37,3 на ИУ по сравнению с 11,0 на 24-й неделе при использовании трифаротена (изменение – 70,0%). Таким образом, результаты данного исследования продемонстрировали, что применение крема, содержащего трифаротен 0,005%, при лечении пациентов с акне средней и тяжелой степени тяжести оказывает выраженное воздействие на атрофические постакне рубцы, в результате чего снижается их количество и риск формирования постакне рубцов с необходимостью проведения дополнительных аппаратных процедур после завершения общего курса терапии акне.
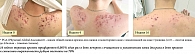
Клинические примеры
На рисунках 2–5 представлены фото пациентов с акне в динамике при применении крема с трифаротеном 0,005%. У всех пациентов отмечена хорошая клиническая динамика и они продолжают назначенную терапию (в плане – до 24 недель).
Заключение
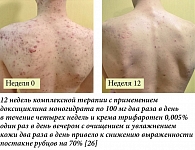
Помимо того, что акне является распространенным хроническим дерматозом, который развивается в самом уязвимом возрасте, когда отмечаются максимальные психологические перегрузки, данное заболевание при длительном или тяжелом течении может привести к развитию стойких рубцовых изменений кожи, что, в свою очередь, может оказать существенное влияние на качество жизни пациентов в целом. Современные знания патофизиологии развития поствоспалительных рубцов при акне дают основания раннего применения средств, воздействующих на основные патогенетические механизмы формирования акне, с целью быстрого подавления воспаления и окклюзии сально-волосяного фолликула. Ароматический ретиноид последнего поколения (трифаротен) в доклинических исследованиях продемонстрировал влияние на гены, определяющие профибротическую активность макрофагов. В клинических наблюдениях за пациентами, использующими в качестве местного лечения крем трифаротен 0,005% (Аклиф), была установлена не только его эффективность при терапии акне средней степени тяжести на коже лица и туловища и при тяжелой степени тяжести акне на коже лица в комбинации с системным антибиотиком (доксициклином), но и выраженная активность данного препарата в отношении развития атрофических рубцовых изменений кожи после акне. Применение трифаротена повышает клиническую эффективность наружного лечения акне и снижает необходимость коррекции явлений постакне с использованием инвазивных аппаратных методик после достижения клинической ремиссии заболевания.
L.S. Kruglova, PhD, Prof., K.B. Olkhovskaya, PhD
Central State Medical Academy of Department of Presidential Affairs, Moscow
Contact person: Kira B. Olkhovskaya, olhovskaya_kira@mail.ru
Acne is an inflammatory disease of the sebaceous glands, characterized by predominant manifestation in adolescence and development of polymorphic rash: comedones, papules, pustules, nodes, cysts, phlegmon and scars. Development of post-inflammatory scars has a significant impact on physical and psychological well-being of patients with acne, and their correction using modern hardware or cosmetology techniques in a course mode often resulting in long-term treatment and serious financial expenses for patients. Currently, active study of the pathogenesis of this dermatosis continues, and attention is paid to the pathophysiological processes that cause the formation of post-inflammatory scars. The discovered relationship between the development of post-acne and the severity and duration of the disease, as well as patient’s age, dysfunction of the epidermal barrier and the severity of seborrhea, dictates the need to use in therapy agents that promote potent relief of inflammation and the elimination of pathological follicular hyperkeratosis, as a substrate for the active development of granulation tissue formation. Trifarotene is a fourth-generation aromatic retinoid with pronounced comedolytic, anti-inflammatory, depigmenting activity, and is also able to reduce the action of genes that cause an increase in the profibrotic action of macrophages. The use of trifarotene in the form of a 0.005% cream helps to reduce the depth and number of post-inflammatory (atrophic) scars in acne, which allows not only to promote the formation of acne remission on the face and body, but also to prevent the development of persistent cosmetic defects.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.


