Патофизиология образования антимитохондриальных антител при первичном билиарном холангите. Имеется ли дисфункция иммунной системы при ПБХ?
- Аннотация
- Статья
- Ссылки
- English
Образование АМА в доклинической стадии заболевания послужило основанием для утверждения, что они запускают процесс повреждения и гибели холангиоцитов, что позволяет считать ПБХ истинным аутоиммунным заболеванием. Однако не существует никаких доказательств повреждающего действия АМА на холангиоциты, выстилающие только мелкие (внутридольковые, междольковые и септальные) желчные протоки. Появившиеся новые научные данные о нарушении выработки бикарбоната холангиоцитами уже в асимптоматической стадии ПБХ позволили авторам этого обзора впервые высказать следующие предположения:
- повреждающим фактором для мелких холангиоцитов являются желчные кислоты, а не АМА;
- желчные кислоты запускают процесс старения и апоптоза в мелких холангиоцитах, что приводит к развитию дуктулопении;
- желчные кислоты создают условия для доступа к внутренней мембране митохондрий мелких холангиоцитов и к E2 ПДГ – комплексу;
- наличие липоевой кислоты в Е2-субъединице ПДГ-комплекса и ее взаимодействие с желчными кислотами приводит к иммуномодификации и приобретению неоантигенных свойств E2 ПДГ в мелких БЭК;
- приобретение неоантигенных свойств E2 ПДГ – комплексом в мелких, подвергающихся апоптозу холангиоцитах приводит к тому, что нормальная (здоровая) иммунная система распознает его как чужеродный антиген, запуская выработку АМА. Поэтому наличие АМА при ПБХ является признаком органоспецифического, а не истинного аутоиммунного заболевания.
Образование АМА в доклинической стадии заболевания послужило основанием для утверждения, что они запускают процесс повреждения и гибели холангиоцитов, что позволяет считать ПБХ истинным аутоиммунным заболеванием. Однако не существует никаких доказательств повреждающего действия АМА на холангиоциты, выстилающие только мелкие (внутридольковые, междольковые и септальные) желчные протоки. Появившиеся новые научные данные о нарушении выработки бикарбоната холангиоцитами уже в асимптоматической стадии ПБХ позволили авторам этого обзора впервые высказать следующие предположения:
- повреждающим фактором для мелких холангиоцитов являются желчные кислоты, а не АМА;
- желчные кислоты запускают процесс старения и апоптоза в мелких холангиоцитах, что приводит к развитию дуктулопении;
- желчные кислоты создают условия для доступа к внутренней мембране митохондрий мелких холангиоцитов и к E2 ПДГ – комплексу;
- наличие липоевой кислоты в Е2-субъединице ПДГ-комплекса и ее взаимодействие с желчными кислотами приводит к иммуномодификации и приобретению неоантигенных свойств E2 ПДГ в мелких БЭК;
- приобретение неоантигенных свойств E2 ПДГ – комплексом в мелких, подвергающихся апоптозу холангиоцитах приводит к тому, что нормальная (здоровая) иммунная система распознает его как чужеродный антиген, запуская выработку АМА. Поэтому наличие АМА при ПБХ является признаком органоспецифического, а не истинного аутоиммунного заболевания.
Введение
Первичный билиарный холангит (ПБХ) – это хроническое холестатическое прогрессирующее заболевание печени, протекающее с деструкцией, апоптозом и некрозом эпителия преимущественно мелких внутридольковых и септальных желчных протоков, с развитием дуктулопении и холестаза, в терминальной стадии которого развивается цирроз печени [1, 2].
Краеугольным камнем в диагностике ПБХ является обнаружение АМА и/или специфических для ПБХ антинуклеарных антител (АНА) при обследовании пациентов с холестатическими заболеваниями печени [3, 4]. Специфичность наличия в плазме крови антимитохондриальных аутоантител (АМА) достигает более 95% [5], и это служит одним из определяющих признаков развивающегося в мелких холангиоцитах патологического процесса [5]. Метаанализ 2014 г., включавший 24 исследования, показал, что суммарная чувствительность и специфичность АМА в диагностике ПБХ составляет 84,5 и 97,8% соответственно [6]. АМА обнаруживаются у пациентов уже в бессимптомной стадии ПБХ, что указывает на их участие в механизме развития заболевания. Наличие АМА и АНА послужило поводом считать ПБХ прототипом аутоиммунного заболевания и описывать его как «парадигматическую модель аутоиммунного заболевания» [3, 7–9]. Это связано с тем, что основу современной диагностики большинства аутоиммунных заболеваний составляет обнаружение антител, направленных против собственных тканевых антигенов организма [10]. Аутоантитела часто называют «свидетелями аутоиммунного процесса». Считается, что наличие высоких титров АМА у большинства (95%) пациентов с ПБХ и АНА примерно у 50% больных указывает на потерю толерантности В-клеток к собственным антигенам [11]. Поэтому примерно с середины 1960-х гг. ПБХ описывается как аутоиммунное заболевание печени [12]. Более того, ПБХ описывают как хроническое холестатическое заболевание печени, характеризующееся иммуноопосредованным (с помощью АМА) разрушением БЭК мелких и средних внутрипеченочных желчных протоков [1, 11]. ПБХ относят к аутоиммунному заболеванию еще и потому, что оно имеет общие черты с другими аутоиммунными заболеваниями. Это заболевание преимущественно поражает женщин, а аутореактивные Т-клетки играют определенную роль в патологическом процессе [14–18].
Антигеном для продукции АМА при ПБХ является дигидролипоилтрансацетилаза (E2) пируватдегидрогеназного (ПДГ) комплекса (E2 ПДГ – комплекс), который локализуется на внутренней мембране митохондрий. Несмотря на то что четко определен антиген, к которому развиваются АМА [7, 8, 11, 19], до настоящего времени остается открытым вопрос, касающийся факторов, запускающих механизм образования АМА, и их значение в развитии патологического процесса при ПБХ. Неясно, каким образом антиген E2 ПДГ, расположенный на внутренней митохондриальной мембране, становится мишенью для иммунокомпетентных клеток. Фермент ПДГ состоит из трех субъединиц: E1 (пируватдегидрогеназа), E2 и E3 (дигидролипоилдегидрогеназа), но неизвестно, почему при ПБХ вырабатываются аутоантитела только против одной субъединицы Е2. При иммунизации экспериментальных животных антигеном Е2 в качестве комбинированного полипептида происходит образование АМА. Однако повреждения холангиоцитов не наблюдается, поэтому возникает вопрос, являются ли АМА фактором, запускающим разрушение БЭК. Также нет ответа на вопрос, почему в этот процесс вовлечен E2-антиген ПДГ только мелких БЭК. Ответы на эти вопросы имеют принципиальное значение для понимания вовлеченности иммунной системы в патогенез ПБХ.
Характеристика аутоиммунных заболеваний
Аутоиммунные заболевания представляют собой обширный класс разнородных по клиническим проявлениям заболеваний, развивающихся вследствие нарушений в иммунной системе, сопровождающихся потерей толерантности к определенным тканям и белкам с последующей патологической выработкой аутоиммунных антител. Считается, что все аутоиммунные заболевания имеют сходные механизмы развития [10]. Возникающие при этом комплексы антиген-антитело способны вызывать развитие воспаления и опосредованного этими комплексами повреждения тканей мишеней. Показано, что повреждение тканей мишеней макроорганизма является общей основой для запуска новых иммунных реакций [10]. При этом в качестве адъювантных субстанций (усиливающих иммунный ответ) выступают продукты разрушения собственных клеток и тканей. Все это приводит к развитию системных (полиорганных) нарушений функций внутренних органов. Постоянство дисфункции иммунной системы и деструкция тканей с последующим распознаванием тканевых антигенов антигенпрезентирующими клетками поддерживают хронизацию этого процесса. При этом течение аутоиммунных заболеваний может сопровождаться самопроизвольной ремиссией патологического состояния, которая чередуется с обострением. Тяжесть течения и нарушение функции внутренних органов при аутоиммунном заболевании, как правило, коррелируют с титром (уровнем) аутоантител.
Особенности ПБХ как аутоиммунного заболевания
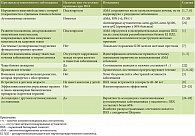
Несмотря на появление АМА уже в асимптоматической стадии заболевания, аутоиммунная теория ПБХ не вполне убедительна, поскольку многие признаки, характерные для аутоиммунной патологии, у этих пациентов отсутствуют или не имеют четкого подтверждения (табл. 1).
Признаки ПБХ, которые не укладываются в критерии аутоиммунной теории заболевания:
- практически все исследователи отмечают, что заболевание не носит системный характер, а ограничено локальным повреждением мелких внутрипеченочных желчных протоков [1, 7];
- ПБХ не вписывается в схему воспаления, опосредованного иммунными комплексами [1];
- митохондриальный аутоантиген Е2 ПДГ, к которому образуются АМА, расположен на внутренней мембране митохондрий, не является тканеспецифичным и обладает высокой толерантностью к иммунной системе [7];
- Е2 ПДГ в изобилии содержится в митохондриях всех ядросодержащих клеток, однако только мелкие БЭК являются мишенью аутоиммунной атаки при ПБХ [1];
- ни титр, ни характер АМА не коррелируют с клинической картиной, тяжестью и прогрессированием заболевания [8];
- титры АМА или их изменения в динамике не являются прогностическими маркерами прогрессирования ПБХ [29–31];
- ПБХ, будучи хроническим заболеванием печени, в целом характеризуется медленным прогрессированием без вспышек и ремиссий активности, характерных для аутоиммунных заболеваний;
- ПБХ, в отличие от других аутоиммунных заболеваний, не имеет аналогов у детей [8];
- неспособность иммуносупрессивной терапии и генно-инженерных (таргетных) биологических препаратов остановить прогрессирование ПБХ [23–25].
В связи с этим в настоящее время высказываются сомнения в том, является ли ПБХ истинным аутоиммунным заболеванием [1]. Для получения ответа на этот вопрос важно иметь четкое представление о механизме образования АМА. Именно поэтому усилия многих исследователей направлены на выявление факторов, запускающих этот процесс, и на выяснение патофизиологических механизмов, лежащих в основе образования антимитохондриальных аутоантител [1, 11]. Попытки доказать или опровергнуть аутоиммунную теорию образования АМА лежат в основе этих исследований.
Для того чтобы ответить на эти вопросы, важно понять, что лежит в основе образования АМА:
- дисфункция иммунной системы, приводящая к потере ее толерантности к неизмененному Е2 ПДГ белку-антигену?
или
- нарушения в структуре и/или конформации антигена Е2 ПДГ, которые приводят к изменению его иммунных свойств, что воспринимается неизмененной (здоровой) иммунной системой как чужеродный антиген?
Имеется ли дисфункция иммунной системы при ПБХ?
Если образование АМА является результатом дисфункции иммунной системы, приводящей к потере толерантности к неизмененному (немодифицированному) антигену, то это, скорее всего, следует рассматривать как признак аутоиммунного заболевания. Но если образование АМА является следствием приобретения новых иммунных свойств антигеном Е2 ПДГ, которые естественным образом распознаются «здоровой» иммунной системой как чужеродный антиген (неоантиген), то, вероятнее всего, ПБХ сложно рассматривать как истинное аутоиммунное заболевание.
Как уже отмечалось ранее, у пациентов с классическим течением ПБХ образуются АМА к антигенному компоненту, относящемуся к Е2 ПДГ, который локализуется на внутренней мембране митохондрий [7, 8, 11, 19]. Большинство проведенных исследований априори постулируют, что при ПБХ имеет место дисфункция иммунной системы, которая приводит к изменению ее толерантности к Е2 ПДГ [1, 11, 32]. Исследователи направляют свои усилия на то, чтобы понять механизм развития и нарушения этой толерантности [1, 11, 32]. Считается, что потеря иммунной толерантности к Е2 ПДГ при ПБХ является начальным событием в механизме образования АМА и играет важную роль в качестве запускающего фактора повреждения холангиоцитов [1, 11, 32]. Мнение об иммуноопосредованном разрушении мелких и средних внутрипеченочных желчных протоков обсуждается многими исследователями [1, 13, 33]. При этом четких доказательств повреждающего действия иммунного комплекса Е2 ПДГ-антиген-АМА на холангиоциты нет, и механизм этого повреждающего действия остается неизвестным.
Но изменение толерантности иммунной системы к высококонсервативному и «вездесущему» белку Е2 ПДГ должно приводить к развитию нарушений, которые будут носить системный характер. А при ПБХ изменения ограничены локальным повреждением мелких и средних внутрипеченочных желчных протоков. И это больше указывает на то, что при ПБХ, вероятнее всего, происходят изменения с самим антигеном Е2 ПДГ, которые меняют его иммунологические свойства до такой степени, что неизмененная иммунная система начинает воспринимать его как чужеродный неоантиген. И происходит это с антигеном Е2 ПДГ, расположенным в митохондриях БЭК, выстилающих только мелкие и средние желчные протоки. И именно эти изменения с антигеном Е2 ПДГ, расположенным на внутренней мембране митохондрий мелких холангиоцитов, должны послужить запускающим моментом для образования АМА. Последние будут реагировать с неоантигеном Е2 ПДГ только в холангиоцитах мелких и средних желчных протоков, но не будут реагировать с нормальными, неизмененными Е2 ПДГ в митохондриях других клеток.
Анализ имеющихся научных данных показывает, что, вероятнее всего, локальный характер повреждений, происходящий в холангиоцитах, выстилающих мелкие и средние желчные протоки при ПБХ, обусловлен изменением иммунологических свойств антигена Е2 ПДГ митохондрий мелких БЭК. Если это так, то крайне важно представлять механизм образования такого иммуноизмененного антигена и важно знать, какой фактор может запустить процесс превращения Е2 ПДГ в неоантиген. С учетом того, что Е2 ПДГ – это лишь часть ПДГ-комплекса, то необходимо понять и объяснить, почему именно эта часть (субъединица) ПДГ-комплекса приобретает свойства неоантигена.
Кроме того, для образования АМА недостаточно превращения Е2 ПДГ в иммуноизмененный неоантиген. Важно также понимать, как этот неоантиген покидает внутреннюю мембрану митохондрий, холангиоцитов и как происходит его встреча с иммунокомпетентными клетками, отвечающими за выработку аутоантител. Также крайне важно понять, почему в этот процесс вовлечен антиген Е2 ПДГ клеток билиарного эпителия, расположенного в желчных протоках мелкого и среднего размеров [8]. Триггеры и механизмы, которые могут запустить такие процессы в холангиоцитах мелких и средних желчных протоков, неизвестны.
В последние десятилетия появились новые научные данные, позволяющие прояснить патогенез повреждения холангиоцитов [34, 35]. Эти данные свидетельствуют о том, что повреждение мелких холангиоцитов связано не с иммуноопосредованными реакциями, а с дефектом билиарного бикарбонатного «зонтика». Именно он защищает БЭК от детергентного действия токсичных желчных кислот в физиологических условиях [34–37]. Показано, что при ПБХ уменьшается выработка бикарбоната (HCO3-), что приводит к поступлению и накоплению желчных кислот в холангиоцитах (теория «дырявого» бикарбонатного «зонтика») [34–37]. Эти данные позволили нам высказать предположение, что происходящее при этом постепенное накопление желчных кислот в БЭК, уже в асимптоматической стадии ПБХ, может служить пусковым механизмом для повреждения мелких холангиоцитов, развития дуктулопении и образования АМА [2]. Для этого важно представлять механизмы защиты мелких и крупных БЭК от токсического (детергентного) действия желчных кислот.
Механизмы защиты холангиоцитов от токсического действия желчных кислот
Выделяют мелкие и крупные холангиоциты в зависимости от их размеров и расположения в мелких и крупных желчных протоках [38]. Они по-разному участвуют в процессах секреции и абсорбции [39]. Но желчные кислоты оказывают токсическое действие как на мелкие, так и на крупные БЭК. При этом оба типа БЭК имеют различные защитные механизмы для противодействия повреждающему (токсическому) действию желчных кислот. К известным факторам защиты холангиоцитов относят выработку и секрецию муцина и бикарбоната БЭК [40, 41]. В физиологических условиях основной функцией холангиоцитов является билиарная секреция HCO3- [41]. Научные данные свидетельствуют о том, что HCO3- играет критически важную роль в защите БЭК (защитный билиарный бикарбонатный «зонтик») от токсического воздействия желчных кислот [36, 37]. На долю HCO3- приходится от 25 до 40% общего объема выделяемой желчи [36, 42, 43]. У человека секреция HCO3- с желчью поддерживает физиологически нейтральный или слабощелочной уровень pH в просвете желчных протоков [36, 40, 42]. Хорошо известно, что HCO3- вырабатывается как мелкими, так и крупными холангиоцитами, то есть на всем протяжении билиарного дерева. Однако механизмы выработки и секреции HCO3- мелкими и крупными БЭК осуществляются по-разному, что подробно рассмотрено в статье [39] и обзоре [2].
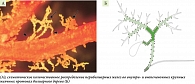
Выработка муциновых гликопротеидов осуществляется перибилиарными железами (ПБЖ) [44]. Последние располагаются в стенках крупных внутри- и внепеченочных желчных протоков и непосредственно связаны с их просветом (рис. 1 А). Экспериментальные данные указывают на то, что гликокаликс, покрывающий апикальную поверхность мембран крупных холангиоцитов, с гликозилированными муцинами и другими гликансодержащими мембранными гликопротеинами стабилизирует билиарный бикарбонатный «зонтик», помогая таким образом защитить крупные холангиоциты человека от токсического (детергентного) действия желчных кислот [37]. Следовательно, вырабатываемый ПБЖ муцин защищает холангиоциты только крупных желчных протоков [40]. Исходя из этого холангиоциты крупных внутри- и внепеченочных желчных протоков имеют двойную защиту: муцин, вырабатываемый ПБЖ, и бикарбонат.
Мелкие желчные протоки перибилиарных желез не содержат (рис. 1 Б), что сопровождается отсутствием в них муцина [40, 44]. В результате на уровне внутридольковых, междольковых и септальных желчных протоков фактором защиты БЭК служит только бикарбонат. Механизмы выработки и секреции бикарбоната мелкими и крупными холангиоцитами отличаются, что рассматривается в обзоре [2]. Именно различия в механизмах защиты мелких и крупных холангиоцитов от токсического действия желчных кислот играют важную роль в механизме развития повреждений мелких (но не крупных) БЭК при ПБХ.
Теория «дырявого» билиарного бикарбонатного «зонтика» при ПБХ
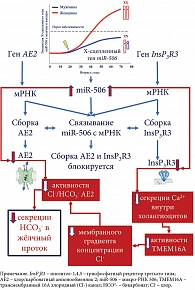
Теория «дырявого» билиарного бикарбонатного «зонтика» основана на ряде клинических и экспериментальных работ, показывающих недостаточное поступление HCO3- в желчные протоки при ПБХ, что приводит к смещению рН внутрипротоковой (печеночной) желчи в слабокислую область и увеличение рН внутри холангиоцита в слабощелочную область [45, 46]. Обсуждается вовлеченность в этот процесс InsP3R3 и AE2 [45–47]. Показано, что в биоптатах печени и мононуклеарных клетках крови пациентов с ПБХ снижена экспрессия генов InsP3R3 и AE2, что свидетельствует об их дисфункции и вовлечении в патогенез ПБХ [45, 46]. Снижение активности InsP3R3 и AE2, а также нарушение их секреторной функции связывают с микро-РНК 506 (miR-506) [47].
В холангиоцитах пациентов с ПБХ отмечается повышение количества и активности miR-506 [48]. Показано, что повышение активности Х-сцепленной miR-506 в холангиоцитах пациентов с ПБХ приводит к снижению экспрессии и активности InsP3R3 и АЕ2, а также потенциально объясняет преобладание этого заболевания у женщин [2, 48, 49] (рис. 2). Холангиоциты человека, выделенные из биоптатов пациентов с ПБХ, показывают снижение активности InsP3R3 и АЕ2 [50]. Вследствие этого гомеостаз внутриклеточного рН (pHi) в холангиоцитах и рН в желчных протоках у пациентов с ПБХ может подвергаться изменению [49]. Изменения внутри- и внеклеточного рН при ПБХ, связанные с потерей InsP3R3 и снижением активности АЕ2, способствуют протонированию желчных кислот. Это позволяет желчным кислотам преодолевать билиарный бикарбонатный «зонтик» и проникать в холангиоциты, что, в конечном итоге, приводит к их повреждению [1, 2, 51, 52]. Механизмы протонирования-депротонирования желчных кислот и проникновения их в холангиоциты подробно описаны в обзорах [2, 53]. Необходимо подчеркнуть, что описанный механизм проникновения желчных кислот в холангиоциты у пациентов с ПБХ происходит именно на уровне мелких БЭК. Этот феномен связан с недостаточной продукцией HCO3- данными клетками и отсутствием муцинового компонента, который служит в качестве защитного барьера только для крупных БЭК [2, 53].
Механизм повреждения мелких холангиоцитов при «дырявом» билиарном бикарбонатном «зонтике»
Теория дестабилизации билиарного бикарбонатного «зонтика» лежит в основе неконтролируемого поступления желчных кислот внутрь мелких холангиоцитов [1, 51, 52]. Это, в свою очередь, запускает механизм повреждения билиарных эпителиальных клеток. Попадая в БЭК со слабощелочным рН, желчные кислоты подвергаются депротонированию, что способствует их накоплению в мелких холангиоцитах [2, 53]. Желчные кислоты, обладающие сильными детергентными свойствами, способны растворять фосфолипиды и холестерин из мембранных структур мелких БЭК. Этот процесс приводит к повреждению и разрушению цитоплазматической мембраны и мембран клеточных органелл. Нарушение целостности ядерной и митохондриальной мембран мелких холангиоцитов при ПБХ приводит к высвобождению факторов, индуцирующих апоптоз. Было показано, что хроническое повреждающее действие желчных кислот на мембранные структуры приводит к ускоренному старению, апоптозу и/или некрозу мелких БЭК, выстилающих интралобулярные, интерлобулярные и септальные желчные протоки [1, 54]. Избыточный апоптоз провоцирует некротический путь гибели клеток (так называемый вторичный некроз) и способствует формированию воспаления [10]. Индукция ускоренного клеточного апоптоза и вторичного некроза приводит к активации воспалительных и профиброгенных путей, которые, в свою очередь, запускают развитие и прогрессирование фиброза [1, 54, 56]. Нарушается барьерная функция эпителия, выстилающего мелкие интралобулярные, интерлобулярные и септальные желчные протоки. Цитокины, хемокины и провоспалительные медиаторы, выделяемые холангиоцитами, в свою очередь, стимулируют апоптотические и пролиферативные реакции и активируют фиброгенез [57]. В обзорах литературы [54, 55] представлены описания концептуальных механизмов, лежащих в основе этих процессов. В конечном итоге развивается дуктулопения, которая сопровождается формированием постепенно прогрессирующего внутрипеченочного холестаза [49, 55].
Гистологически у пациентов с ПБХ наблюдается прогрессирующее повреждение билиарного эпителия с инфильтрацией мононуклеарными клетками вокруг БЭК желчных протоков малого или среднего размеров. Как правило, воспалительные клетки прилегают к холангиоцитам поврежденных желчных протоков [58]. Инициацию апоптоза желчными кислотами можно считать триггером, запускающим развитие дуктулопении мелких желчных протоков при ПБХ уже в асимптоматической стадии заболевания [59, 60]. Представленный механизм отражает прямое повреждающее действие желчных кислот на мелкие холангиоциты с развитием старения, апоптоза, вторичного некроза и гибели мелких БЭК.
Наличие на апикальной поверхности крупных холангиоцитов муцинсодержащего гликокаликсного слоя защищает их от проникновения и повреждающего действия протонированных конъюгированных и неконъюгированных желчных кислот.
Избыточное накопление желчных кислот внутри малых БЭК сопровождается развитием повышенной проницаемости (пермеабилизации) внешней мембраны митохондрий [61–64]. Пермеабилизация митохондрий может создавать благоприятные условия для образования АМА [60, 65].
Механизм пермеабилизации митохондрий и образование АМА
Поступающие и накапливающиеся в мелких холангиоцитах желчные кислоты солюбилизируют фосфолипиды и холестерин с внешней мембраны митохондрий, что сопровождается нарушением их проницаемости – пермеабилизацией [60]. Повышенная проницаемость внешней мембраны митохондрий для ионов и растворов приводит к потере мембранного потенциала и утечке в цитозоль содержимого межмембранного пространства [64, 66]. Происходит набухание митохондрий с образованием псевдоподий, нарушение целостности их внешней мембраны и выход апоптогенных факторов [64], включающихся в процессы апоптоза мелких БЭК. Открывается внутренняя митохондриальная мембрана – основная мишень для образования AMA. Солюбилизация желчными кислотами фосфолипидов и холестерина с внутренней мембраны сопровождается дальнейшей деструкцией митохондрий с высвобождением и деградацией пируватдегидрогеназного комплекса. ПДГ комплекс включает в себя три фермента [пируватдегидрогеназа (Е1 ПДГ), дигидролипоилтрансацетилаза (Е2 ПДГ), дигидролипоилдегидрогеназа (Е3 ПДГ)] и два вспомогательных белка [59]. Для его функционирования необходимы пять кофакторов: коэнзим А, NAD+, тиаминпирофосфат (витамин В1), FAD и липоевая кислота. Важно отметить, что Е1 ПДГ и Е3 ПДГ являются белковыми комплексами, которые не содержат липидных компонентов. Показано, что сыворотки пациентов ПБХ не проявляют серологически определяемой реактивности против Е1 и E3 компонентов ПДГ [67].
А вот Е2 ПДГ является липопротеидом и имеет два сайта связывания липоевой кислоты [19]. Е2 ПДГ содержат незаменимый остаток лизина в липоамидном домене, к которому ковалентно присоединена липоевая кислота [19]. Липоево-лизиновая связь в положении 173 высоко консервативна у разных видов и необходима для распознавания антигена [68]. Все иммунодоминантные эпитопы Е2 ПДГ включают липоевую кислоту, которая необходима для Т-клеточного распознавания антигена [69]. Ряд исследований, выполненных в конце прошлого столетия, показал, что основная иммуногенная область на E2 ПДГ, распознаваемая при выполнении иммунологических реакций с сыворотками от пациентов с ПБХ, локализована в липидсодержащем домене [70–73]. AMA нацелены на иммунодоминантные эпитопы Е2 ПДГ, содержащие липоевую кислоту.
Патофизиология образования АМА
Представленные выше данные дают основания для выдвижения предположения (гипотезы) о том, что образование АМА против Е2 ПДГ при ПБХ, скорее всего, является следствием воздействия желчных кислот на липидный компонент ПДГ и его иммуномодификации. Желчные кислоты с выраженными детергентными свойствами способны взаимодействовать с липоевой кислотой Е2 ПДГ, что может приводить к конформационным и/или структурным изменениям иммунодоминантного липидного эпитопа и менять иммунологические свойства Е2 ПДГ антигена. Конформационные и, возможно, отчасти структурные изменения липидного домена Е2 ПДГ из-за химической модификации желчными кислотами могут способствовать приобретению новых неоантигенных свойств, рассматриваемых иммунной системой в качестве чужеродного белка.
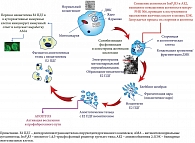
Апоптоз клеток билиарного эпителия был предложен в качестве потенциального источника Е2 ПДГ неоантигенов, ответственных за активацию аутореактивных лимфоцитов [74]. Уже в асимптоматической стадии ПБХ аутореактивные В-лимфоциты способны распознавать иммуномодифицированный неоантиген Е2 ПДГ, полученный из апоптотических мелких БЭК в качестве чужеродного белка [60]. Презентация лимфоцитам иммуномодифицированного Е2 ПДГ неоантигена может привести к стимулированию субпопуляции Т-клеток и специфической продукции АМА [20, 75–77]. На ранних стадиях ПБХ аутореактивные В-клетки могут функционировать как критические антиген-презентирующие клетки, поглощая и представляя неоантигены Е2 ПДГ Т-клеткам [11, 60, 78]. Поврежденные желчными кислотами БЭК (стареющие и подвергающиеся ускоренному апоптозу) могут транслоцировать иммунологически модифицированный неоантиген Е2 ПДГ с апоптотическими тельцами и передавать его аутореактивным иммунным клеткам [11]. A. Lleo и соавт. впервые сообщили о присутствии Е2 ПДГ в апоптотических тельцах клеток внутрипеченочных желчных протоков человека, подвергшихся апоптозу [79]. Было показано, что аутоантигены Е2 ПДГ, обнаруженные в апоптотических тельцах (апотопы), впоследствии были поглощены макрофагами [79]. Апоптотические тельца совместно с макрофагами могут индуцировать не только синтез местнодействующих провоспалительных цитокинов, но и передавать неоантиген Е2 ПДГ аутореактивным иммунным клеткам, инициируя таким образом иммунный ответ и запуская выработку АМА при ПБХ [80] (рис. 3). При этом желчные кислоты не могут влиять на чисто белковые Е1 и Е3 субъединицы ПДГ, так как они не имеют в своем составе липидных компонентов.
Постоянная дестабилизация билиарного бикарбонатного «зонтика» при ПБХ способствует непрерывному накоплению и детергентному действию желчных кислот на мелкие БЭК. Этот процесс характеризуется медленно прогрессирующим непрерывным разрушением мелких холангиоцитов, которые выстилают интралобулярные, интерлобулярные и септальные желчные протоки. В результате разрушения мелких БЭК происходит постоянная выработка АМА. Поскольку АМА нацелены на иммуномодифицированный неоантиген E2 ПДГ, они взаимодействуют исключительно с БЭК, которые повреждены желчными кислотами (то есть стареющими и/или апоптотическими) и содержат неоантиген E2 ПДГ. Это способствует поддержанию воспаления и фиброза. В то же время АМА не оказывают иммуноповреждающего действия на здоровые (нормальные) клетки, содержащие неизмененный антиген E2 ПДГ [8, 60]. Антиген E2 ПДГ других здоровых (нормальных) клеток остается неизмененным и располагается на внутренней митохондриальной мембране, что также делает его недоступным для АМА.
Представленные данные, безусловно, требуют дальнейших всесторонних комплексных исследований для подтверждения высказанных предположений. Однако и имеющиеся научные данные, на наш взгляд, частично подтверждают изложенные гипотетические утверждения о механизме приобретения E2 ПДГ неоантигенных свойств под влиянием желчных кислот. В результате проведения в лаборатории M.E. Gershwin [81–87] экспериментальной иммунизации животных были получены следующие данные:
- Антитела с реактивностью, идентичной реактивности образцов сыворотки пациентов с ПБХ, не могут быть получены путем экспериментальной иммунизации [81]. Вероятно, это несоответствие можно объяснить использованием в иммунизации животных нативного E2 ПДГ, а не E2 ПДГ-неоантигена, полученного после взаимодействия с желчными кислотами, как это наблюдается при ПБХ.
- Экспериментальные данные по иммунизации лабораторных животных E2 ПДГ в виде рекомбинантного полипептида свидетельствуют о том, что он приводит к образованию АМА, но не к повреждению холангиоцитов [82]. Это может свидетельствовать о том, что АМА не являются фактором, запускающим деструкцию БЭК.
- Производные октановой (жирной) кислоты были способны вызывать образование АМА и ПБХ-подобное поражение печени у морских свинок и мышей [83–87]. Эти данные подчеркивают ключевую роль остатка жирной кислоты и ее модификации в антигене E2 ПДГ для индукции выработки АМА и повреждения холангиоцитов.
- Иммунизация кроликов липидным ксенобиотиком, конъюгированным с бычьим сывороточным альбумином, вызывает образование AMA, без пептидной основы антигена E2 ПДГ [87]. Это также косвенным образом свидетельствует о том, что для выработки АМА важную роль играет модификация жирнокислотной, а не белковой части антигена Е2 ПДГ. После прекращения действия стимула эти аутоантитела исчезали [87]. При ПБХ повреждающее действие желчных кислот на митохондрии мелких холангиоцитов обеспечивает постоянство высвобождения и иммуномодификации Е2 ПДГ, что, в свою очередь, приводит к непрерывной продукции АМА.
Вероятно, процессы образования АМА и деструкции мелких БЭК являются независимыми, объединяет их зависимость от повреждающего действия желчных кислот, которые из-за нарушения выработки HCO3- поступают в мелкие холангиоциты и накапливаются в них. Это приводит как к повреждению самих холангиоцитов, так и к конформационным и/или структурным изменениям в липофильном домене E2 ПДГ, что сопровождается выработкой АМА [2, 53, 60].
Некоторые пациенты с ПБХ являются АМА-отрицательными. Тем не менее пациенты, у которых отсутствуют АМА, демонстрируют такие же клинические характеристики в отношении течения и прогрессирования заболевания, как и те, кто являются АМА-позитивными. По-видимому, у 5% АМА-негативных пациентов в силу каких-то индивидуальных особенностей накопление желчных кислот в мелких БЭК не сопровождается иммунной модификацией антигена E2 ПДГ. Но при этом повреждение мелких БЭК, связанное с накоплением в них желчных кислот, развивается, вероятнее всего, по тому же механизму, что и у АМА-положительных пациентов. Это объясняет сходную клиническую картину, течение и прогрессирование заболевания у АМА-негативных и АМА-положительных пациентов.
Заметным ограничением существующих научных литературных данных является отсутствие исследований, направленных на выявление новых неоантигенных свойств E2 ПДГ. Исследования были направлены на выявление механизмов, лежащих в основе потери толерантности иммунной системы к неизмененному (нормальному) антигену E2 ПДГ [73, 75, 76].
В связи с вышеизложенным наличие АМА при ПБХ скорее указывает на аутоиммуноподобное состояние, чем на то, что ПБХ является истинным классическим аутоиммунным заболеванием.
Заключение
Открытие АМА и их успешное применение в диагностике ПБХ способствовало выявлению бессимптомных и ранних стадий заболевания, улучшив таким образом прогноз для пациентов [3]. В настоящее время диагностическая ценность АМА при ПБХ общепризнана. Тем не менее необходимы дальнейшие исследования, чтобы понять механизмы образования АМА и определить их значение в патогенезе ПБХ. Имеющиеся научные данные позволили сформулировать гипотезу о потенциальной роли желчных кислот как факторов, способствующих запуску механизма образования АМА в мелких БЭК при ПБХ [53]. Представленная в обзоре гипотеза позволяет ответить на ряд нерешенных вопросов, касающихся факторов, инициирующих повреждение малых БЭК, механизма образования АМА, их значимости в развитии ПБХ и степени вовлеченности иммунной системы в этот процесс [60]. Представленные в обзоре данные раскрывают ряд вопросов, которые до сих пор оставались неясными.
Становится понятным образование АМА именно к антигену E2 ПДГ, но не к субъединицам E1 и E3 комплекса ПДГ.
Продемонстрирована потенциальная возможность химической модификации липидного домена E2 ПДГ антигена желчными кислотами в мелких БЭК с последующей трансформацией в неоантиген. В данном случае исключается дисфункция иммунной системы.
Представлен потенциальный механизм участия желчных кислот в формировании доступа иммунокомпетентных клеток к E2 ПДГ антигену, расположенному на внутренней мембране митохондрий мелких БЭК, что впоследствии приводит к образованию AMA.
Стойкое и продолжительное повреждающее действие желчных кислот на мелкие холангиоциты является определяющим фактором в персистенции образования E2 ПДГ неоантигена, что, в свою очередь, поддерживает устойчивый титр АМА в крови пациентов с ПБХ.
Образование АМА в ответ на E2 ПДГ неоантиген исключает его цитотоксическое действие на все другие клетки, содержащие митохондрии и неизмененный E2 ПДГ.
Образование АМА в ответ на E2 ПДГ неоантиген только в мелких БЭК определяет их диагностическую, но не прогностическую ценность.
Участие желчных кислот в качестве первопричины повреждения мелких БЭК определяет течение ПБХ как негнойного деструктивного холангита, который не соответствует типичной картине иммуноопосредованного воспаления.
Представляется обоснованным предположение, что участие желчных кислот в качестве первопричины повреждения мелких БЭК может объяснить недостаточную эффективность иммуносупрессивных препаратов.
Раскрытие новых этиологических факторов и детальных патофизиологических механизмов развития ПБХ может послужить важной основой для разработки новых лекарственных препаратов и методов лечения этих пациентов в будущем.
V.I. Reshetnyak, PhD, Prof., I.V. Maev, PhD, Prof., Academician of the RAS
Russian University of Medicine, Moscow
Contact person: Vasily I. Reshetnyak, vasiliy.reshetnyak@yandex.ru
Primary biliary cholangitis (PBC) is a chronic cholestatic progressive liver disease that falls within the category of cholangiopathies. The identification of antimitochondrial antibodies (AMAs) is a crucial aspect of the diagnosis of classic PBC. It has been demonstrated that AMAs are formed in response to the dihydrolipoyl transacetylase of the pyruvate dehydrogenase complex (E2 PDH), which is situated on the inner mitochondrial membrane. Loss of immune tolerance to E2 PDH in PBC is considered to be the factor that triggers the mechanism of AMA formation and the subsequent immune-mediated destruction of biliary epithelial cells (BECs, cholangiocytes) lining the small and medium-sized intrahepatic bile ducts. It is well established that the E2 PDH complex is present not only in BECs, but also in the mitochondria of all nucleus-containing cells. This raises the question of why only the E2 PDH of small cholangiocytes becomes a target for autoimmune attack.
The formation of AMAs in the asymptomatic stage of the disease has provided the basis for the claim that they trigger the process of cholangiocyte damage and death, thereby allowing PBC to be considered a true autoimmune disease. However, there is no evidence of damaging effects of AMAs on cholangiocytes lining small (intra-lobular, inter-lobular and septal) bile ducts. Emerging new scientific evidence of impaired bicarbonate production by cholangiocytes already in the asymptomatic stage of PBC allowed the authors of this review to suggest for the first time that:
- The damaging factor for small cholangiocytes is bile acids and not AMA;
- Bile acids trigger senescence and apoptosis in small cholangiocytes, which ultimately leads to the development of ductulopenia;
- Bile acids create conditions for access to the inner mitochondrial membrane of small cholangiocytes and to the E2 PDH complex;
- The presence of lipoic acid in the E2 subunit of the PDH complex and its interaction with bile acids, leads to immunomodification and acquisition of neoantigenic properties of E2 PDH in small BECs;
- The acquisition of neoantigenic properties of the E2 PDG complex in small cholangiocytes undergoing apoptosis results in the recognition of this complex by the normal ('healthy') immune system as a foreign antigen, thereby triggering the production of AMA. It can therefore be concluded that the presence of AMAs in PBC is indicative of an organ-specific rather than a true autoimmune disease.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.