Патология желудочно-кишечного тракта при сахарном диабете
- Аннотация
- Статья
- Ссылки
![Рис. 2. Основные формы НАЖБП. Адаптировано по [21]](/upload/resize_cache/iblock/6b1/195_350_1/tiogamma2.jpg)

![Рис. 3. Схема «двойного удара» в развитии жировой болезни печени. Адаптировано по [21]](/upload/resize_cache/iblock/eb5/195_350_1/tiogamma4.jpg)

Большинство исследователей чаще всего связывают желудочно-кишечную симптоматику СД с диабетической автономной нейропатией (ДАН) [3]. Наиболее частыми проявлениями гастроэнтерологической формы ДАН являются заболевания пищевода, желудка, тонкой и толстой кишки [3, 20]. В последнее время к гастроэнтерологическим осложнениям СД стали относить и изменение липидного обмена, которое приводит к возникновению таких заболеваний, как неалкогольная жировая болезнь печени (НАЖБП), цирроз, гепатоцеллюлярная карцинома, острая печеночная недостаточность (ОПН) [4, 20].
Заболевания пищевода
Проявляются в виде моторной дисфункции пищевода, гастроэзофагеального рефлюкса, изжоги. У больных СД заболевания пищевода встречаются чаще по сравнению с контрольными группами. Это обусловлено ДАН, которая приводит к следующим нарушениям:
- снижению давления желудочного сфинктера (гипергликемия увеличивает время «переходных расслаблений» сфинктера пищевода);
- уменьшению амплитуды и частоты перистальтических волн и возрастанию асинхронных и неэффективных волн пищеводных сокращений;
- запаздыванию желудочной секреции.
Признаки и симптомы:
- изжога – ощущение жжения в загрудинной области, чаще всего возникающее после приема пищи;
- регургитация – появление желудочного содержимого во рту или носоглотке, также возникающее после приема пищи;
- другие симптомы – боль за грудиной, дисфагия, тошнота, хронический кашель.
Проводимые исследования:
- эзофагогастродуоденоскопия с биопсией, если симптомы являются тяжелыми или постоянными, даже при проведении терапии;
- анализ биопсийного материала для исключения метаплазии (дисплазии) при пищеводе Барретта;
- 24-часовая рН-метрия для подтверждения диагноза у больных с симптомами пищеводных нарушений;
- измерение времени поддержания рН на уровне < 4,0;
- манометрия пищевода для исследования нарушения подвижности и исключения склеродермии или ахалазии до проведения хирургического вмешательства;
- двойное рентгеноконтрастное исследование с использованием бария для определения язв или эрозий в пищеводе.
Лечение
Изменение образа жизни:
- сон в положении с приподнятой верхней частью тела;
- принятие вертикального положения после приема пищи;
- исключение из рациона питания жирных продуктов, шоколада, чрезмерного потребления алкоголя, кислых напитков;
- исключение тесной одежды и тугого затягивания ремня на талии;
- снижение массы тела для грузных или страдающих ожирением пациентов;
- прекращение курения.
Медикаментозная терапия – ингибиторы протонной помпы (пантопразол, эзомепразол и др.); блокаторы H2-рецепторов гистамина (фамотидин).
Хирургический метод лечения – фундопластика: часть желудка фиксируется вокруг нижней части пищевода для дополнительной поддержки нижнего сфинктера пищевода.
Заболевания желудка
Диабетический гастропарез – состояние, при котором секреция желудка при приеме пищи осуществляется с задержкой, что приводит к застою пищи в желудке. Возникает из-за сниженной иннервации желудочной функции при наличии гипергликемии. Гипергликемия приводит к расслаблению мышечных тканей желудка, уменьшению частоты, распространения и амплитуды сокращения антральных волн, возникающих после приема пищи, и стимулирует фазу пилорических волн. Все это замедляет желудочную секрецию и двигательную функцию желудка.
Признаки и симптомы:
- изжога или рефлюкс;
- тошнота и рвота непереваренной пищей;
- неконтролируемый уровень сахара в крови;
- раннее насыщение;
- вздутие живота;
- плохой аппетит и потеря массы тела.
Диагноз диабетического гастропареза основывается на следующих критериях:
- клинические проявления (раннее насыщение, тошнота, рвота, вздутие живота);
- отсутствие коррекции гликемического профиля, несмотря на проводимую терапию;
- снижение секреторной функции желудка;
- отсутствие обструкции в желудке или тонкой кишке, подтвержденной эндоскопией или радиографией с использованием бария.
Лечение
Терапия направлена на устранение симптомов и включает:
- диетическое питание – обезжиренная пища, частые дробные приемы пищи, гомогенизированная жидкая пища, насыщенная витаминами, энтеральное питание, парентеральное питание при нарушении моторики;
- контроль гликемического профиля;
- медикаментозную терапию – стимуляторы моторно-эвакуаторной функции верхних отделов желудочно-кишечного тракта (прокинетики): итоприд, домперидон и метоклопрамид;
- хирургические методы – желудочная электростимуляция; имплантируемое устройство для желудочной стимуляции (выбор для пациентов с тяжелым гастропарезом, не поддающимся лечению другими методами).
Заболевания тонкой кишки
Могут быть обнаружены более чем у 80% пациентов с длительным анамнезом СД. Наиболее частым (23% пациентов в большинстве исследований) и общим нарушением является замедление кишечного транзита.
Длительная гипергликемия тонкой кишки при автономной невропатии (вагусной и симпатической) приводит к нарушению подвижности тонкой кишки, снижению секреции или уменьшению всасывания. Нарушенная подвижность тонкого кишечника ведет к слабому перемещению пищи, вызывает усиленное размножение бактерий, полную мальабсорбцию, способствует слабому ионному обмену, что заканчивается увеличением внутриполостной осмолярности, пассивным передвижением жидкости в полости кишечника и поносом.
Симптомы:
- водянистый, безболезненный ночной понос;
- боль в животе;
- нейропатия тонкой кишки;
- вздутие живота.
Лабораторные и инструментальные исследования – копрология, анализ кала на дисбактериоз, колоноскопия, гастроинтестинальная эндоскопия с биопсией (гистология и бактериология).
Диагноз обычно основывается на исключении других причин диареи, таких как лекарственные (метформин, антибиотики широкого спектра действия) или глютеновая болезнь.
Лечение
Неотложная помощь – повторная гидратация и коррекция электролитных нарушений, кишечные антисептики, антидиарейные средства (Лоперамид, Смекта).
Длительное лечение: постоянный контроль за гликемическим профилем и диабетической энцефалопатией.
Заболевания толстой кишки
Связаны с:
- наличием ДАН;
- снижением желудочно-ободочного рефлекса;
- уменьшением основного давления внутреннего анального сфинктера (автономная иннервация);
- дисфункцией внешнего анального сфинктера и лонно-ректальных мышц, приводящей к снижению расслабляющей способности;
- нарушением гликемического профиля;
- уровнем субстанции P, которая стимулирует панкреатическую секрецию, секрецию электролита и кишечную подвижность.
Клинические проявления:
- запоры;
- усиление потребности в слабительных средствах;
- недержание кала.
Лабораторные и инструментальные исследования:
- копрология;
- ректороманоскопия;
- исключение других причин запора (например, гипотиреоидной или лекарственной этиологии);
- аноректальная манометрия.
Лечение
Терапия запора включает в себя: гидратацию;
- регулярную физическую активность;
- увеличение количества пищи с содержанием грубой клетчатки;
- прием лактулозы;
- применение осмотических слабительных средств в более тяжелых случаях.
Неалкогольная жировая болезнь печени
Термин «неалкогольная жировая болезнь печени» (НАЖБП) используется для описания состояния печени у пациентов с патологией, характерной для алкогольного поражения печени, но не имеющих в анамнезе значительного употребления алкоголя. Этиология неизвестна, но заболевание часто связывают с СД 2 типа и ожирением. В некоторых случаях НАЖБП проявляется в виде неалкогольного стеатогепатита (НАСГ) с различной степенью воспаления. В очень редких случаях это может привести к циррозу печени. Данные о распространенности НАЖБП у пациентов с СД противоречивы и имеют существенный диапазон колебаний – от 34 до 78%, а при сочетании с ожирением – до 100%. При этом морфологически стеатогепатиты составляют 50%, а циррозы – 19% [6].
Поскольку НАЖБП часто сочетается с нарушениями углеводного и липидного обмена, ее все чаще стали считать компонентом метаболического синдрома (МС). Распространенность МС у больных НАЖБП составляет более 40%. МС является предиктором НАЖБП.
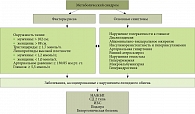
В последние годы к проблеме МС привлечено особое внимание клиницистов. МС представляет собой комплекс многих взаимосвязанных между собой нарушений (инсулинорезистентность (ИР) с относительной гиперинсулинемией, нарушение углеводного обмена, абдоминальное висцеральное ожирение, артериальная гипертензия, атерогенная дислипидемия, микропротеинурия, гиперкоагуляция, гиперурикемия или подагра, НАЖБП) (рис. 1).
Современное понятие НАЖБП охватывает широкий спектр поражений печени и включает две ее основные формы: жировую дистрофию печени и НАСГ. Взаимосвязь патогенеза НЖБП с ИР позволяет считать это заболевание одним из независимых компонентов МС, клиническая значимость которого заключается в значительном прогрессировании атеросклеротического поражения сосудов (рис. 2).
В некоторых случаях возможна трансформация НАСГ в цирроз, что требует проведения трансплантации печени. Жировая инфильтрация печеночных клеток лежит в основе жировой дистрофии печени. Морфологическим критерием жировой дистрофии является содержание триглицеридов в печени более 5–10%. При прогрессировании НАСГ в печени выявляются воспалительно-некротические изменения, которые больше напоминают гепатит, вследствие чего при обнаружении подобного поражения печени устанавливается диагноз «НАСГ».
В связи с этим большинство исследователей сходятся во мнении, что НАЖБП является печеночной составляющей МС. Снижение чувствительности к инсулину проявляется в жировой, печеночной, мышечной тканях, в надпочечниках. В жировой ткани ИР характеризуется нарушением чувствительности клеток к антилиполитическому действию инсулина, что приводит к накоплению свободных жирных кислот и глицерина, которые выделяются в портальный кровоток, поступают в печень и становятся источником формирования атерогенных ЛПНП. Кроме этого, ИР гепатоцитов снижает синтез гликогена и активирует гликогенолиз и глюконеогенез.
На рисунке 3 представлена схема «двойного удара» в развитии жировой болезни печени. На ранних стадиях повреждения печени усиливается воздействие TNF-α на гепатоциты, одновременно он инициирует различные клеточные сигналы, повышающие проницаемость митохондриальной мембраны, что приводит к высвобождению реактивных форм кислорода и способствует апоптозу гепатоцитов – «первый удар». Однако большинство здоровых гепатоцитов использует потенциально «летальные» сигналы для активации множественных адаптивных разнонаправленных ответов, что позволяет клеткам выжить. «Второй удар» подавляет эту адаптационную способность и также приводит к апоптозу. Даже в том случае, когда адаптация к «первому удару» успешна и гепатоцитам удается выжить, они становятся очень уязвимыми к отрицательным воздействиям. Это приводит к частичной деполяризации внутренней митохондриальной мембраны, и в случае нарушения трансмембранных ионных градиентов происходит некроз клетки.
Лечение
У большинства пациентов НАЖБП характеризуется длительным, стабильным бессимптомным течением. Поэтому, по современным представлениям, специальная фармакотерапия показана только больным с прогрессирующим течением этого заболевания или высоким риском его прогрессии. Ожирение, СД 2 типа, гиперлипидемия – основные состояния, ассоциируемые с развитием НАЖБП. Фармакотерапия НАЖБП представлена в таблице 1.
Необходимыми условиями для устранения ИР – главного патогенетического фактора НАЖБП – также являются мероприятия, направленные на снижение массы тела: изменение образа жизни, уменьшение калорийности питания, увеличение двигательной активности. Для лиц с избыточной массой тела и ожирением реально достижимая цель – ее снижение примерно на 7–10% за 6–12 месяцев. Снижение массы тела должно сочетаться с физической активностью умеренной интенсивности (минимум 30 минут в день). Регулярная мышечная активность приводит к метаболическим изменениям, снижающим ИР.
Многочисленные данные о влиянии снижения массы тела на состояние печени весьма противоречивы. Показано, что быстрая потеря массы тела закономерно приводит к нарастанию активности воспаления и прогрессии фиброза. В то же время ее снижение на 11–20 кг/год положительно влияет на выраженность стеатоза и воспаления, степень фиброза печени. Безопасной считается потеря массы до 1600 г в неделю для взрослых и до 500 г – для детей. Это достигается при суточном калораже пищи 25 ккал/кг и активных физических упражнениях или применении ингибитора кишечной липазы орлистата. На фоне нормализации биохимических показателей печени отмечается достоверное уменьшение стеатоза, воспаления, повреждения и фиброза печени.
Ранняя диагностика НАЖБП и определение факторов риска неблагоприятного течения заболевания являются важными в выборе адекватного метода лечения, способного предотвратить дальнейшее прогрессирование НАЖБП. В связи с этим все пациенты с МС и высокой вероятностью НАЖБП, и особенно НАСГ, должны быть обследованы с целью оценки состояния печени. Наиболее информативным методом оценки состояния печени является биопсия.
Основным в лечении НАЖБП является снижение массы тела за счет изменения образа жизни, а также лечение ИР и других компонентов МС. Предложенные фармакологические препараты для лечения НАЖБП могут быть использованы врачами в своей практике.
Цирроз печени
Цирроз – это конечная стадия хронических заболеваний печени различной этиологии, его главные отличительные черты – узловая перестройка паренхимы и распространенный фиброз. Различают две формы цирроза печени:
- макроузловой – большинство узелков больше 3 мм в диаметре;
- микроузловой – большинство узелков меньше 3 мм в диаметре.
На ранней стадии цирроз проявляется потерей аппетита, тошнотой, снижением массы тела, усталостью, слабостью, истощением; на стадии декомпенсации – отеком ног и асцитом, гематомами, кожным зудом, желтухой, печеночной энцефалопатией.
Лабораторные и инструментальные исследования – компьютерная томография (КТ), ультразвуковое исследование (УЗИ), биопсия печени («золотой стандарт»).
Лечение
Терапия цирроза печени основывается на приеме гепатопротекторов, легких слабительных средств, бета-адреноблокаторов (для коррекции портальной артериальной гипертензии), мочегонных средств, уменьшении содержания белка в пище.
Гепатоцеллюлярная карцинома
Является наиболее частой первичной опухолью печени. Ее распространенность в западных странах составляет 4 случая на 100 000 населения. Большинство больных этим заболеванием умирают в течение 1 года после установления диагноза.
Частота встречаемости гепатоцеллюлярной карциномы у пациентов с СД в 4 раза превышает частоту в общей популяции. Вероятная последовательность событий, приводящих к возникновению гепатоцеллюлярной карциномы у пациентов с СД, включает гиперинсулинемию, ускоренный липолиз, аккумуляцию липидов в гепатоцитах, оксидативный стресс с формированием избытка свободных радикалов. Результатом оксидативного стресса является повреждение ДНК и некроз гепатоцитов.
Восстановление структуры ткани происходит с пролиферацией клеток и фиброзом. Однако в ходе этого процесса велика вероятность возникновения хромосомной нестабильности и появления генетических дефектов, что и предрасполагает к злокачественной трансформации. Важным фактором, участвующим в канцерогенезе, является инсулиноподобный фактор роста 1, который способствует пролиферации клеток, активируя субстрат 1 инсулинового рецептора. В свою очередь, высокая концентрация субстрата 1 инсулинового рецептора оказывает туморостимулирующий эффект за счет усиления пролиферации клеток, в ходе которой происходит потеря части информации ДНК, включая гены, подавляющие опухолевый рост.
Больным с высоким риском развития рака печени целесообразно проведение скрининговых исследований и определение маркера опухоли – альфа-фетопротеина (АФП). Цель подобного наблюдения – выявление карциномы на стадии, когда она может быть удалена. Частота проведения исследований должна определяться гистологическим типом опухоли. Скрининговые исследования АФП и УЗИ печени через каждые 6 месяцев необходимо начинать в возрасте 35 лет.
Острая печеночная недостаточность
Острая печеночная недостаточность (ОПН) – это развитие печеночно-клеточной недостаточности с энцефалопатией в течение 8 недель после появления первых признаков при отсутствии поражений печени в анамнезе. ОПН возникает при резком нарушении функции печени, вызванном поражением ткани органа вследствие разнообразных причин. ОПН характеризуется высокой смертностью, обусловленной в основном отеком мозга и инфекционными осложнениями.
Частота развития ОПН у пациентов с СД почти в два раза выше, чем в контрольной группе (2,31 против 1,44 на 10 000 человек в год соответственно). При этом риск ОПН остается значительным даже после исключения из анализируемой группы пациентов с заболеваниями печени и подвергавшихся лечению троглитазоном (пероральным гипогликемическим препаратом с доказанной гепатотоксичностью).
В то время как механизмы взаимосвязи СД и ОПН остаются неясными, гепатотоксический эффект пероральных сахароснижающих препаратов не вызывает сомнений. При анализе медицинской документации 171 264 пациентов с СД удалось установить, что в 35 случаях (1 на 10 000 человек в год) ОПН не имела других причин, кроме применения инсулина, производных сульфонилмочевины, метформина и троглитазона.
Вторичная гипогликемия, возникающая из-за снижения глюконеогенеза вследствие дефицита гликогена и увеличения циркулирующего уровня инсулина, – характерное для ОПН состояние, требующее интенсивного лечения. Исследование глюкозы крови должно проводиться достаточно часто (например, каждые 4 часа), возникшая гипогликемия эффективно купируется 10% или большей концентрации раствором декстрозы.
Наиболее частыми нарушениями электролитного баланса являются гипомагнезиемия и гипофосфатемия.
ОПН – это катаболическое состояние, в связи с чем необходимо проводить зондовое питание для предотвращения истощения. Пациентам с быстротекущей ОПН требуется назначение коллоидов и вазопрессоров (например, норэпинефрина). Невосприимчивая к терапии гипотензия обычно вызвана претерминальной печеночной недостаточностью, сепсисом или панкреатитом, который может осложнить течение ОПН, особенно при передозировке ацетаминофена. Схемы ведения пациентов с ОПН в зависимости от осложнений представлены в таблице 2.
Коррекция гастроэнтерологических осложнений при СД включает использование препаратов из группы антиоксидантов, к которым относится альфа-липоевая (тиоктовая) кислота (Тиогамма).
Тиоктовая (альфа-липоевая) кислота, открытая и изученная в 1948–1952 гг., является неотъемлемой частью клеток организма, высвобождающих энергию аэробным путем. Физиологическое действие альфа-липоевой кислоты многообразно, что в первую очередь связано с ее центральной ролью в дегидрогеназных комплексах, прямо или косвенно влияющих на многие стороны обмена веществ [1].
Препарат Тиогамма:
- обладает гепатопротективным эффектом, который заключается в стимулировании глюконеогенеза в печени;
- препятствует процессу накопления липидов в печени;
- оптимизирует белковый и углеводный обмен;
- участвует в окислении жирных кислот и ацетата, предупреждает развитие жирового стеатоза печени;
- подавляет синтез оксида азота гепатоцитами (профилактика и купирование реологических расстройств и сосудистых нарушений).
Тиогамма – лекарственный препарат меглюминовой соли тиоктовой кислоты – выпускается немецкой фармацевтической компанией «Вёрваг Фарма». Тиогамма – единственное лекарственное средство, которое выпускается в форме готового раствора для инфузий. Флакон препарата содержит 600 мг меглюминовой соли тиоктовой кислоты.
Проведение инфузии непосредственно из флакона более удобно и безопасно, что также сокращает время введения, так как не требует предварительного разведения. К каждому флакону прилагается светонепроницаемый пластиковый пакет, который надежно защищает препарат от воздействия солнечного света во время процедуры инфузии. Следует отметить, что только Тиогамма производится в данной форме.
При лечении НАЖБП (стеатоз печени) препарат Тиогамма назначают внутривенно в дозе 600 мг (1 флакон Тиогаммы в сутки) в течение 2–3 недель. При выраженных клинико-лабораторных проявлениях НАЖБП (стеатогепатит и цирроз) внутривенные инфузии проводят до 3–4 недель. После окончания инъекционного курса рекомендован прием таблетированной формы препарата Тиогамма по 1 таблетке в день (600 мг) в течение 2–3 месяцев.
Тиогамма играет важную роль в утилизации углеводов, белков, липидов, окислении жирных кислот, влияет на основной обмен и потребление кислорода клетками головного мозга, снижает уровень глюкозы и содержание холестерина в крови. Имеются данные о ее способности повышать секреторные возможности β-клеток поджелудочной железы. Кроме того, Тиогамма играет роль антиоксиданта, что очень важно для клинической практики [2].
Основные механизмы действия Тиогаммы
1. Влияние на энергетический метаболизм, обмен глюкозы и липидов:
- участие в окислительном декарбоксилировании α-кетокислот с активацией цикла Кребса;
- усиление захвата и утилизации глюкозы клеткой, потребления кислорода;
- повышение основного обмена;
- нормализация глюконеогенеза и кетогенеза;
- торможение образования холестерина.
2. Цитопротективное действие:
- повышение антиоксидантной активности (прямое и опосредованное через системы витаминов С/Е, цистин/цистеин и глютатионовую систему);
- стабилизация митохондриальных мембран.
3. Влияние на реактивность организма:
- стимуляция ретикуло-эндотелиальной системы;
- иммунотропное действие (снижение уровня интерлейкина-1 и TNF-α);
- противовоспалительная и обезболивающая активность, связанная с антиоксидантным действием.
4. Нейротропные эффекты:
- стимуляция роста аксонов;
- положительное влияние на аксональный транспорт;
- уменьшение вредного влияния свободных радикалов на нервные клетки;
- нормализация аномального поступления глюкозы к нерву;
- предупреждение и уменьшение повреждения нервов при экспериментальном диабете.
5. Дезинтоксикационное действие (при отравлении фосфорорганическими соединениями, свинцом, мышьяком, ртутью, сулемой, цианидами, фенотиазидами и др.).
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.