Периметр виртуальной реальности как инструмент ранней диагностики глаукомы
- Аннотация
- Статья
- Ссылки
- English
Материал и методы. В исследование было включено 15 пациентов с ранее установленным и верифицированным диагнозом глаукомы, подтвержденным клиническими и диагностическими данными. После сбора анамнеза и оценки остроты зрения пациенты проходили тесты на стандартном автоматическом периметре (ПЕРИКОМ) и периметре виртуальной реальности (iVA). В устройстве iVA использовались сверхпороговый алгоритм и стимулы в аналогичных 54 позициях, соответствующих тесту HFA 24–2 SITA. По завершении тестирования проводился опрос пациентов об уровне комфорта и субъективной удовлетворенности каждой из методик.
Результаты. Результаты обоих тестов продемонстрировали сопоставимость в определении аномальных точек у пациентов с глаукомой. iVA и ПЕРИКОМ показали высокую степень сходства при выявлении дефектов полей зрения, характерных для глаукомы (корреляция – 72%). При этом количество ложноотрицательных ответов при использовании iVA было выше, чем при использовании ПЕРИКОМа (p < 0,05). Согласно опросу, 76% пациентов предпочли iVA за простоту и удобство.
Материал и методы. В исследование было включено 15 пациентов с ранее установленным и верифицированным диагнозом глаукомы, подтвержденным клиническими и диагностическими данными. После сбора анамнеза и оценки остроты зрения пациенты проходили тесты на стандартном автоматическом периметре (ПЕРИКОМ) и периметре виртуальной реальности (iVA). В устройстве iVA использовались сверхпороговый алгоритм и стимулы в аналогичных 54 позициях, соответствующих тесту HFA 24–2 SITA. По завершении тестирования проводился опрос пациентов об уровне комфорта и субъективной удовлетворенности каждой из методик.
Результаты. Результаты обоих тестов продемонстрировали сопоставимость в определении аномальных точек у пациентов с глаукомой. iVA и ПЕРИКОМ показали высокую степень сходства при выявлении дефектов полей зрения, характерных для глаукомы (корреляция – 72%). При этом количество ложноотрицательных ответов при использовании iVA было выше, чем при использовании ПЕРИКОМа (p < 0,05). Согласно опросу, 76% пациентов предпочли iVA за простоту и удобство.





Актуальность
Глаукома – одно из наиболее распространенных глазных заболеваний, которое может привести к серьезным необратимым изменениям и значительной потере зрения вплоть до полной слепоты.
По данным Всемирной организации здравоохранения, количество пациентов с глаукомой в мире колеблется от 60,5 до 105 млн, причем в ближайшие десять лет этот показатель увеличится на 10 млн. Ежегодно глаукомой вновь заболевает в среднем один человек из 1000 в возрасте старше 40 лет. По итогам статистической обработки данных за 2017–2018 гг., Россия занимает седьмое место в мире по количеству жителей (146 880 432 человека; доля городского населения – 74,4%, сельского – 25,6%; мужское население – 46%, женское – 54%), что позволяет представить реальный масштаб заболевания и связанные с ним последствия [1].
Медико-социальное значение глаукомы определяется ее ведущей ролью в формировании неизлечимой слепоты. Несмотря на постоянное совершенствование методов диагностики и лечения, наблюдается неуклонный рост больных глаукомой. Это может быть связано с отсутствием регулярных профилактических осмотров и их качеством [1].
Ранняя диагностика глаукомы затруднена, поскольку заболевание долгое время протекает бессимптомно, а переход от нормы или пограничного состояния к выраженной патологии может занимать неопределенно длительный период. На данном этапе основное внимание уделяется выявлению минимальных признаков атрофических изменений диска зрительного нерва (ДЗН), слоя нервных волокон сетчатки, а также характерных дефектов в поле зрения [1].
Локализация наиболее чувствительных участков (фокальных дефектов) при глаукоме обусловлена поражением отдельных пучков нервных волокон на глазном дне. Аксоны ганглиозных клеток сетчатки в зрительном нерве группируются в пучки, каждый из которых выходит из глаза через отдельный канал решетчатой пластинки склеры. При глаукоме наиболее уязвимы дуговые волокна, идущие от парацентральных отделов сетчатки к зрительному нерву. Они начинаются от горизонтального шва сетчатки в ее височной половине, огибают макулярную зону и формируют группу пучков нервных волокон в верхне- и нижневисочных отделах ДЗН. Поражение одного или нескольких таких пучков проводит к образованию скотом в поле зрения [2].
Постановка диагноза основана на комплексной оценке клинических, морфофункциональных показателей и факторов риска с учетом асимметрии проявлений между парными глазами. В этой связи особую значимость приобретают развитие и внедрение новых методов функциональной диагностики, в том числе современных технологий периметрии, позволяющих выявлять ранние изменения зрительных функций [1].
Золотым стандартом объективной оценки полей зрения и выявления дефектов остается автоматическая статическая периметрия (АСП) [3]. Однако ее применение у пациентов сопряжено с существенными ограничениями.
Когнитивные и двигательные трудности. Неврологический дефицит (снижение внимания, утомляемость) затрудняет длительное сохранение фиксации и позы, необходимых для точного АСП-тестирования [3].
Организационные барьеры. Необходимость посещения специализированного кабинета, оснащенного громоздким и дорогостоящим оборудованием (например, периметр Humphrey, ПЕРИКОМ), делает частый мониторинг малодоступным, особенно для пациентов с ограниченной мобильностью [3].
Временные затраты. Продолжительное тестирование повышает риск утомления пациента, что негативно сказывается на достоверности результатов и увеличивает долю ложноотрицательных и ложноположительных ответов [3].
Указанные ограничения делают актуальным поиск альтернативных, более доступных и удобных для пациентов методов оценки полей зрения. Периметры на основе технологий виртуальной реальности (VR), такие как iVA (Intelligent Vision Analyse), обладают значительным потенциалом в данном аспекте благодаря портативности, меньшим требованиям к позе пациента и возможности использования вне специализированных офтальмологических кабинетов, потенциально даже в домашних условиях [3–6].
Сравнительная оценка диагностической эффективности и практической применимости VR-периметрии, в частности системы iVA, и стандартной АСП у пациентов с глаукомой является актуальной задачей для использования этих тестов в качестве ранней диагностики глаукомы.
Цель – сравнить результаты периметрии, выполненной с помощью устройства iVA на базе технологии виртуальной реальности, с результатами стандартной автоматизированной периметрии (ПЕРИКОМ).
Материал и методы
В исследование было включено 15 пациентов. Среди них были пациенты, консультированные в КДО МОНИКИ, с диагнозом глаукомы, подтвержденным клиническими и диагностическими данными. После предварительного сбора анамнеза и оценки остроты зрения от каждого испытуемого было получено письменное информированное согласие на участие в исследовании и прохождение теста на стандартном автоматизированном анализаторе поля зрения (ПЕРИКОМ) и периметре виртуальной реальности. Выполнен анализ степени совпадения выявленных дефектов, времени тестирования и субъективной переносимости процедуры.
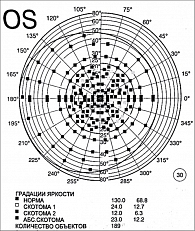
Тестирование на стандартном автоматизированном анализаторе поля зрения (ПЕРИКОМ) проводилось с использованием фиксированной сетки точек и классической подачи стимулов. На первом этапе устанавливали индивидуальный надфлуктуационный уровень светочувствительности глаза для дальнейшего определения уровня отсчета светочувствительности по шкале в дБ при исследовании поля зрения. На втором этапе подавались тест-объекты в виде стимулов формата Goldmann ΙΙΙ в определенной последовательности в Ι–ΙV квадрантах поля зрения с различной яркостью. Количество предъявленных стимулов – 189 точек, в том числе в пределах центрального поля зрения – 152, в области периферического поля зрения – 74. Это позволило увеличить плотность сетки и получить более детальную карту функциональных нарушений.
На этапе подготовки к исследованию пациентам продемонстрировали обучающий видеоролик, затем проводили дополнительный инструктаж о цели исследования, последовательности выполнения заданий и правилах работы на периметре. В процессе исследования глаз пациента располагался на одном уровне с центральной фиксационной точкой в виде красной точки. Реагировать на появления внешних стимулов следовало с помощью портативного кликера. Параметры каждого глаза измеряли поочередно, при этом другой глаз закрывали окклюдером. Тесты на стандартном автоматизированном анализаторе поля зрения (ПЕРИКОМ) считались ненадежными, если частота ложноположительных (FP) или ложноотрицательных результатов (FN) превышала 20%. Испытуемым с ненадежным показателем предоставляли десятиминутный перерыв, затем снова проводили тест. Если результат по-прежнему был ненадежным, испытуемого исключали из исследования [4].
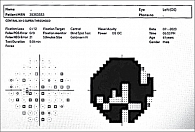
Стандартный тест на iVA представлял стимулы по алгоритму SITA 24–2, 30–2. Система состоит из трех подсистем – гарнитуры виртуальной реальности, планшета и портативного кликера. Все три подсистемы соединены через Bluetooth. Пользователь устанавливает на голове периметр, а оператор управляет тестом через приложение iVA на планшете. Используя приложение, оператор может выбирать параметры, такие как поле зрения, стратегия тестирования и глаз, подлежащий проверке, предварительно внеся данные пациента. Тест можно запустить, приостановить, возобновить и прервать в любое время.
На основании введенных оператором параметров в гарнитуре виртуальной реальности запускается тест. Одновременно отображается стимул только для выбранного глаза. Поскольку экран дисплея для каждого глаза является независимым, накладывание повязки на глаза не требуется. Накладка на устройстве обеспечивает затемнение внутри гарнитуры виртуальной реальности, поэтому для проведения теста не нужна темная комната. Для коррекции аномалий рефракции предусмотрен набор линз, однако доступны только сферические линзы, а для цилиндрических линз используется сферический эквивалент. Экран гарнитуры виртуальной реальности откалиброван на полупрозрачный фон (оттенок белого), что обеспечивает яркость 10 кд/м2 . Белый стимул может быть представлен пользователю с различной интенсивностью. Тем не менее мы использовали фиксированную сверхпороговую яркость стимулов, установленную на уровне 60 кд/м2, что приблизительно соответствует 18 дБ. Проведен тест на превышение порогового значения 30–2. В начале теста пользователь может видеть точку фиксации в центре. Пользователю предлагается продолжать смотреть в центр и нажать кнопку ответа, увидев мигающую точку (стимул). Стимул подается в течение 200 мс, и пользователю предоставляется временной интервал 1300 мс для ответа, после чего подается следующий стимул. В этом случае тест продолжается. Перед началом теста устройство показывает десять точек рядом с потенциальным местоположением слепой зоны, и, исходя из ответа, эта слепая зона отображается на карте. Во время теста на слепую зону проецируется до 3% стимулов. Если пользователь все же нажимает на нее, это засчитывается как потеря фиксации. В дополнение к этому еще 3% стимулов во время тестирования отображаются с задержкой 1200 мс. Если пользователь продолжает нажимать, когда на экране не отображается ни один стимул, это засчитывается как ложноположительный ответ. Каждое положение стимула было представлено дважды во время теста. Если для какой-либо заданной точки пользователь нажал один раз и не нажал в другой раз, результат считался ложноотрицательным [3, 7].
Оператор может отслеживать ход тестирования с помощью планшета с графическим представлением областей, в которых отображается стимул, а параметры надежности, такие как потери фиксации, ложноотрицательные и ложноположительные результаты, обновляются в режиме реального времени. На основании этой информации оператор может ограничить доступ пользователя или прервать и перезапустить тестирование, если параметры надежности выходят за пределы допустимого. Результаты тестирования доступны и сохраняются в программном обеспечении смартфона, которое при необходимости можно экспортировать [3].
Пациентам был показан обучающий видеоролик по использованию iVA и проведен краткий демонстрационный тест. В исследование включались оба глаза в зависимости от соответствия критериям. Между тестированием второго глаза устанавливали обязательный пятиминутный перерыв. Лицам с ненадежными показателями полей зрения предоставляли короткий десятиминутный перерыв, после чего тестирование проводилось повторно.
После тестирования на стандартном автоматизированном анализаторе поля зрения (ПЕРИКОМ) и iVA пациентам предлагали пройти опрос удовлетворенности: их просили оценить простоту и комфортность использования iVA и ПЕРИКОМа и высказать мнение о применении iVA в перспективе.
Результаты
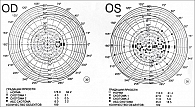
Результаты отчета iVA сопоставили с отчетами ПЕРИКОМа для всех 15 участников исследования. В большинстве случаев количество аномальных точек в обоих тестах совпало. При тестировании на iVA выявлены характерные изменения поля зрения (рис. 1–8).
Анализ надежности показал высокую степень сходства при выявлении дефектов полей зрения, характерных для глаукомы (корреляция – 72%), при тестировании на iVA и ПЕРИКОМе. Характеристики ошибок различались: iVA демонстрировал статистически значимо больше ложноотрицательных ошибок (p < 0,05). Примечательно, что подавляющее большинство пациентов (76%) отдали предпочтение iVA, оценив его как более простой и удобный метод (p < 0,001), а 60% выразили готовность использовать его для домашнего мониторинга, если такая возможность появится.
Обсуждение
В нашем исследовании оценивалась роль устройства iVA, использующего сверхпороговый стимул в тестировании полей зрения у пациентов с глаукомой. Мы обнаружили оптимальную корреляцию между iVA и стандартными автоматизированными анализаторами поля зрения. В последнее время наблюдается значительный интерес к разработке периметра на основе виртуальной реальности, который имеет существенные преимущества. Само устройство достаточно компактно, чтобы его можно было носить с собой в центры визуализации или использовать в домашних условиях. Постоянное электропитание или доступ к Интернету не требуются.
Ранее нами уже было продемонстрировано клиническое применение устройства iVA у пациентов с нейроофтальмологической патологией, в частности при аденоме гипофиза и рассеянном склерозе. В исследованиях выявлена высокая степень корреляции между результатами iVA и стандартной автоматической периметрии, а также преимущества iVA за счет удобства, мобильности и простоты использования. Кроме того, установлено, что iVA характеризуется большей долей надежных тестов. Эти данные подтверждают клиническую реализацию метода и его потенциал как инструмента для скрининга и мониторинга нейроофтальмологических состояний.
Потери фиксации и ложноотрицательные результаты чаще наблюдались при использовании iVA, а ложноположительные – при использовании стандартных автоматизированных анализаторов полей зрения. Это обусловлено сочетанием факторов: снижением остроты зрения и контрастной чувствительности, неустойчивой фиксацией взгляда, а также утомлением и психологическим напряжением пациентов при длительном тестировании. Вероятность потери фиксации в iVA также может быть связана с недостаточной ориентацией населения в новых устройствах виртуальной реальности, пространственной дезориентацией, поскольку вся внешняя среда заблокирована и участники начинают невольно искать свет.
Пациентам с глаукомой часто бывает трудно выполнить автоматизированную периметрию по различным причинам: неспособность долго удерживать осанку, снижение когнитивных функций, необходимость обращения в специализированное медицинское учреждение для проведения теста, длительность тестирования. Портативный периметр iVA нивелирует эти недостатки при достаточно высокой корреляции и может быть полезным инструментом для ранней диагностики глаукомы и последующего мониторинга заболевания.
Текущая версия устройства может быть использована для экспресс-диагностики в качестве массового скрининга населения, однако при выявлении дефектов полей зрения следует в дальнейшем провести расширенную диагностику с использованием статических периметров, так как в сравнении с ними iVA имеет ряд существенных ограничений.
Для исследования iVA был протестирован только порог 18 дБ, стимул был равномерным по всему полю зрения. Для более точной диагностики необходимо оценить полезность других уровней дБ для сверхпорогового скрининга в зависимости от конкретного местоположения. В более совершенных устройствах интенсивность стимула должна регулироваться из-за неоднородности чувствительности сетчатки по всему полю зрения и ее изменений с возрастом. Указанные изменения могут быть учтены при разработке полного порогового алгоритма и формировании нормативной базы данных при усовершенствовании iVA. В этом случае виртуальная периметрия как единственный вариант обследования пожилых, инвалидов или неподвижных пациентов упростит скрининг исследования полей зрения в виде дистанционного тестирования во внестационарных условиях.
Заключение
Периметр виртуальной реальности iVA продемонстрировал значительный потенциал в оценке полей зрения у пациентов с глаукомой. Особенно перспективным представляется использование iVA в целях ранней диагностики и динамического мониторинга. iVA представляет собой удобный для пациентов инструмент, способный повысить доступность и частоту контроля зрительных функций при глаукоме, особенно в амбулаторных и домашних условиях.
Авторы выражают благодарность разработчику и руководителю проекта VR-диагностики В.Я. Высочанскому.
I.A. Loskutov, PhD, I.Yu. Mezhevova, PhD, M.P. Agadzhanyan
Moscow Regional Research and Clinical Institute
Contact person: Marta P. Agadzhanyan, marta.agadzhanyan@mail.ru
The aim is to compare the results of perimetry using the iVA VR device with the data of standard automatic perimetry in patients with glaucoma and to evaluate the possibilities of using virtual reality technology as an express diagnostic tool for detecting visual field defects characteristic of glaucoma in the early stages of the disease.
Material and methods. The study included 15 patients with a previously established and verified diagnosis of glaucoma, confirmed by clinical and diagnostic data. After collecting anamnesis and assessing visual acuity, patients underwent tests on the standard automatic perimeter (PERICOM) and virtual reality perimeter (iVA). The iVA device used an ultra-threshold algorithm and stimuli in similar 54 positions corresponding to the HFA 24–2 SITA test. At the end of the testing, patients were interviewed about the level of comfort and subjective satisfaction with each of the methods.
Results. The results of both tests demonstrated comparability in determining abnormal points in patients with glaucoma. iVA and PERICOM showed a high degree of similarity in the detection of visual field defects characteristic of glaucoma (correlation – 72%). At the same time, the number of false negative responses when using iVA was higher than when using PERICOM (p < 0.05). According to the survey, 76% of patients preferred iVA for its simplicity and convenience.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.