Первичный билиарный холангит: исторические аспекты
- Аннотация
- Статья
- Ссылки
- English
Обзор охватывает историческую эволюцию первоначальных названий заболевания, трансформацию и адаптацию его номенклатуры по мере появления, развития и внедрения в клиническую практику новых методов новых научных исследований. В обзоре также рассматриваются проблемы и возможности в лечении ПБХ с учетом появления новых научных данных. Кроме того, рассматривается значение новых молекулярных данных о нарушении выработки бикарбоната холангиоцитами в патогенезе ПБХ.
Обзор охватывает историческую эволюцию первоначальных названий заболевания, трансформацию и адаптацию его номенклатуры по мере появления, развития и внедрения в клиническую практику новых методов новых научных исследований. В обзоре также рассматриваются проблемы и возможности в лечении ПБХ с учетом появления новых научных данных. Кроме того, рассматривается значение новых молекулярных данных о нарушении выработки бикарбоната холангиоцитами в патогенезе ПБХ.
![Морфологическая классификация стадий первичного билиарного холангита (адаптировано из [25])](/upload/resize_cache/iblock/92f/7gvess528l8c9wyyiftr2g4eq3p1gers/195_350_1/Maev1.jpg)
Введение
Первичный билиарный холангит (ПБХ) – это хроническое холестатическое прогрессирующее заболевание печени, протекающее с апоптозом, некрозом и деструкцией билиарного эпителия преимущественно мелких внутридольковых, междольковых и септальных желчных протоков, с образованием антимитохондриальных аутоантител (АМА) (аутоиммунный компонент) и развитием в терминальной стадии цирроза печени.
Открытие этого заболевания, первые описания его клинических, патологоанатомических, морфологических, лабораторных признаков, а также определение диагностических методов тесно связаны с появлением новых научных методов исследования. С этих позиций предлагается рассмотреть исторические аспекты открытия, описания и появления диагностических критериев этого заболевания.
Ранние описания ПБХ
Роль клинических и патологоанатомических методов в открытии заболевания
Раннее описание одного из кожных признаков заболевания, известного сегодня как первичный билиарный холангит, относится к середине XIX века. В 1851 г. в статье «О некоторых поражениях кожи – витилигоидеи – альфа-плана, бета-тубероза» (”On a certain affectation
of the skin – vitiligoidea – alpha plana, beta tuberosa“), опубликованной Томасом Аддисоном (T. Addison, 1793–1860) и Вильямом Галлом (W. Gull, 1816–1890) в журнале Guys Hospital Report, было сделано первое описание кожных клинических признаков, которые, по наблюдению авторов, были связаны с патологией печени [1, 2]. Авторы обратили внимание на несколько необычные, редкие повреждения кожи, которые отличались от известных в то время витилиго и келоида. Для их описания авторы ввели термин vitiligoidea, представив две формы этих изменений: alpha plana – образования в виде плоских бляшек вокруг глаз (которые мы теперь называем ксантелазмами) и beta tuberosa – плоские туберозные бугорки, возникающие в местах травм и других частях тела: на ушах, локтях, коленях и в складках кожи (которые мы теперь называем ксантомами) [1].
Ксантелазмы описывали и раньше. Так, в 1826 г. Райер опубликовал атлас кожных заболеваний, где впервые описал ксантелазмы вокруг глаз как «бляшки цвета замшевой кожи, слегка приподнятые над кожей, не теплые и не красные, иногда расположенные несколько симметрично» [3]. Однако до T. Addison и W. Gull никто не связывал их появление с заболеванием печени.
В статье T. Addison и W. Gull описали морфологию ксантелазм и проиллюстрировали их художественными репродукциями. Было зарегистрировано и описано пять наблюдений, три из которых по описанию напоминают заболевание, известное сегодня как первичный билиарный холангит. Возраст наблюдаемых пациентов составлял от 24 до 43 лет. Последующий анализ описания этих наблюдений показал, что выявленные кожные изменения у одной женщины соответствовали признакам туберозного склероза (tuberous sclerosis), у другой – эруптивной ксантомы при сахарном диабете [2]. И только у трех женщин имеющиеся на коже ксантелазмы и плоские ксантомы сопровождались длительной желтухой, кожным зудом, неприятными ощущениями в правом подреберье [2]. Несмотря на то что в то время гистологическое исследование для идентификации вовлеченности печени в патологический процесс было недоступно, T. Addison и W. Gull справедливо заподозрили взаимосвязь появления alpha plana и beta tuberosa с поражением печени у данных пациентов [1, 4]. Нарушение функции печени при выявленных изменениях кожи T. Addison и W. Gull назвали необструктивным билиарным циррозом. Учитывая значимость выявленной взаимосвязи кожных проявлений в диагностике повреждения печени, заболевание стали называть синдромом Аддисона – Галла. В последующие годы в английской, французской и немецкой научной литературе появился ряд клинических и экспериментальных работ, подтверждающих взаимосвязь появления ксантом и ксантелазм с заболеваниями печени, а также взаимосвязь с развивающимся циррозом печени и длительной обструктивной желтухой [3, 5, 6]. В некоторых из этих работ высказывались даже предположения о первичной роли ксантоматоза в возникновении билиарной непроходимости и развитии билиарного цирроза [5, 7, 8]. По результатам проведенных позже исследований аутопсийного материала, не обнаружили ксантоматозных изменений в эпителиальной выстилке желчных протоков, о чем писали Moxon, Fagge, Pye-Smith [5, 7, 8].
V. Hanot и внедрение термина «гипертрофический цирроз печени с хронической желтухой» (La cirrhose hypertrophique avec ictère chronique)
Считается, что первое описание клинической картины заболевания, которое мы сегодня знаем как ПБХ, было сделано Виктором Чарльзом Ано (Victor Charles Hanot, 1844–1896), французским врачом, известным своими работами в области гепатологии. В 1875 г. в Парижском университете Hanot представил свою докторскую диссертацию на тему «Гипертрофический цирроз печени с хронической желтухой» (La cirrhose hypertrophique avec ictère chronique) [3, 9], в которой особо отметил, что для заболевания характерно значительное увеличение печени и длительная желтуха. Hanot обратил внимание на то, что увеличение печени не является первичным, как при портальном циррозе. Но оно носит постоянный характер и сохраняется на протяжении всего течения болезни, не подвергаясь регрессу впоследствии. На основании патологоанатомических данных было показано, что увеличение печени сопровождается обширным фиброзом [6]. Последний, как было отмечено позже, является характерным признаком заболевания. Hanot отмечал, что несмотря на отсутствие какой-либо видимой грубой обструкции печеночных протоков, основной причиной развивающегося хронического процесса в печени является препятствие оттоку желчи на уровне мелких внутрипеченочных желчных протоков, что подтверждалось анатомическим и морфологическим соответствием при проведении вскрытия после смерти больных [3]. Hanot предположил, что возникновение препятствия для оттока желчи, скорее всего, связано с катаральным воспалением мельчайших разветвлений желчевыводящей системы, вызывающим внутрипеченочную, а не внепеченочную непроходимость [3]. Из наблюдений Hanot и других авторов, а также из описанных экспериментальных работ становится ясно, что по мере развития заболевания вокруг желчных протоков возникает и распространяется клеточная инфильтрация, фибробластическая пролиферация и обструкция малых желчных ходов [3]. Также было замечено, что имеется отсроченное начало развития асцита и других осложнений, являющихся следствием портальной гипертензии. Заслуга Hanot состоит в том, что он в 1892 г. написал монографию «Гипертрофический цирроз печени с хронической желтухой», в которой четко описал клиническую картину заболевания, отличную от вторичного билиарного цирроза [9]. При этом, правда, он ошибочно указал на возможную роль сифилиса в его происхождении [9]. Это заболевание одно время называли гипертрофический цирроз Гано, или болезнь Гано (в другой транслитерации – болезнь Ано) [4, 10].
Важность разработки химических и лабораторных методов для изучения заболевания
Определение состава ксантом, ксантелазм, изменения липидного состава крови и появление термина «ксантоматозный билиарный цирроз»
Первые сообщения о химическом составе ксантом и ксантелазм были сделаны Квинкваудом (M. Quinquaud) в Париже в 1878 г. на заседании клинического общества [11]. В опубликованном докладе M. Quinquaud говорится, что ксантомы и ксантелазмы возникают «в случаях избытка жиров в крови».
По данным автора, содержание «жиров» в крови таких пациентов может превышать физиологическую норму в шесть и более раз [11]. На основании полученных данных автор делает заключение, что «изменение состава крови играет важную роль в развитии этого любопытного состояния».
В последующие годы ученые все чаще описывают клинические наблюдения с поражением печени, протекающие с длительной желтухой и сопровождающиеся кожными проявлениями в виде ксантом и ксантелазм [5, 12, 13]. В конце XIX века в основе описания заболевания лежали клинические признаки и результаты патологоанатомических вскрытий больных после их смерти [3].
В первой половине XX столетия разрабатываются и внедряются в клиническую практику новые лабораторные методы, что сыграло важную роль в выявлении и распознавании лабораторных признаков заболевания у пациентов с диагнозом «синдром Аддисона – Галла»/«болезнь Гано». Появляется возможность оценить метаболизм липидов и установить липидный профиль, понять и расширить представления о механизмах образования ксантом и ксантелазм. S.J. Thannhauser и соавт. в конце 1930 – начале 1940 гг. на основании клинических признаков и с учетом биохимических данных выявили четкую взаимосвязь появления ксантом и ксантелазм с повышенным уровнем холестерина и лецитина (в четыре – восемь раз выше нормы) в сыворотке крови этих пациентов [14, 15]. S.J. Thannhauser и соавт. предположили, что причиной описанного состояния является дисбаланс образования и выведения холестерина. Несмотря на значительное повышение холестерина и лецитина, сыворотка крови остается прозрачной и не бывает «кремовой» [14, 16]. Появляются важные лабораторные признаки «синдрома Аддисона - Галла»/«болезни Гано»: повышение уровня холестерина и лецитина в плазме крови этих больных.
Кроме описания новых лабораторных признаков, авторы внесли существенные дополнения к известным (наличие ксантом и ксантелазм на коже, увеличение печени и селезенки, желтуха многолетней продолжительности) клиническим признакам [15]. S.J. Thannhauser и соавт. обратили внимание на то, что «все случаи, о которых сообщалось до сих пор», были представлены пациентами женского пола в возрасте от 30 до 50 лет [14, 17, 18], также они описали у этих пациентов в качестве одного из важнейших симптомов заболевания кожный зуд и отметили, что несмотря на высказанное V. Hanot предположение о том, что при заболевании имеется воспаление мелких желчных протоков, у пациентов отсутствуют характерные для воспаления лихорадка и/или озноб.
С учетом наличия у больных циррозом ксантом и ксантелазм H.E. MacMahon и S.J. Thannhauser в 1949 г. предложили назвать это заболевание ксантоматозный билиарный цирроз, выделив его в качестве самостоятельной патологии [14]. При этом авторы отметили, что ксантоматозный билиарный цирроз нельзя относить в группу гиперхолестеринемического семейного ксантоматоза, поскольку «за прошедшее время в описанных случаях не было выявлено семейной заболеваемости» [14].
Тема генерализованного накопления липидов и развития ксантоматоза была успешно развита S.J. Thannhauser с коллегами [15] и впоследствии привлекла внимание известного липидолога XX столетия Эдварда Аренса-младшего (E.H. Jr. Ahrens) [19].
E.H. Jr. Ahrens и предложенный им термин «первичный билиарный цирроз»
Доктор Аренс (E.H. Jr. Ahrens, 1915–2000) внес огромный вклад в понимание метаболизма холестерина и в описание нарушения липидного обмена при заболевании печени, которое протекало с наличием ксантом и гиперлипидемией [16, 19, 20], что привело к улучшению диагностики ксантоматозного билиарного цирроза на более ранних стадиях. Его клиническое исследование по ПБХ – одно из наиболее часто цитируемых [16]. На основании наблюдения за 18 пациентками с ксантоматозным билиарным циррозом, Ahrens показал, что многие больные, несмотря на повышение уровня липидов в сыворотке крови, не имеют ксантом и ксантелазм, доказав таким образом существование предксантоматозной стадии у этих больных на стадии развитого холестаза. Предксантоматозная стадия, по данным Ahrens, характеризуется меньшей степенью обструкции желчевыводящих путей и менее выраженным повышением уровня липидов в сыворотке крови [16].
В своих исследованиях Ahrens показал, что большинство пациентов находится на «доксантоматозной» стадии, а «ксантоматозная» фаза, по его выражению, представляет собой лишь наиболее «тяжелую, драматичную» терминальную стадию развития
болезни [16]. По мнению Ahrens, ксантоматоз при этом заболевании является вторичным, а заболевание протекает в три стадии: предксантоматозная, ксантоматозная и терминальная [16].
Ahrens также продемонстрировал возможность обратного развития ксантом и ксантелазм. Переход в выраженную ксантоматозную стадию и обратно зависит от степени повышения уровня холестерина и лецитина в сыворотке крови. Было показано, что, если липиды сыворотки остаются достаточно повышенными в течение длительного времени, можно прогнозировать появление ксантом кожи, а если по какой-либо причине обструкция будет устранена, можно ожидать, что липиды сыворотки упадут до нормального уровня и ксантомы рассосутся [16].
При этом, по данным Ahrens, изменения липидного профиля, приводящие к ксантоматозу кожи, разительно отличаются от тех, которые определяют наличие атероматоза артерий, в связи с чем у этих пациентов не было выявлено клинических, электрокардиографических или рентгенографических признаков атеросклероза или коронарной болезни [16].
Полемизируя с Thannhauser и его коллегами об определении «ксантоматозный билиарный цирроз», Ahrens подчеркивал неточность предложенного ими термина с учетом того, что ксантомы и ксантелазмы встречаются лишь в 5–10% случаев [14, 16]. При этом в значительной части ранних сообщений описаны пациенты с ксантоматозным билиарным циррозом на стадии желтухи и декомпенсированного цирроза. Практически все эти пациенты умирали от цирроза и печеночной недостаточности в течение примерно 10 лет после постановки диагноза [19, 21, 22].
В результате Ahrens и соавт. с учетом морфологического описания заключительной цирротической стадии болезни в 1950 г. обосновали и ввели термин «первичный билиарный цирроз» [19]. С этого времени термины «синдром Аддисона – Галла», «болезнь Гано» и «гипертрофический цирроз Гано» имеют исторический характер.
Ahrens обратил внимание на парадокс в липидном анализе крови при первичном и вторичном билиарном циррозах, который он предложил использовать для дифференциальной диагностики этих состояний [19]. Так, при первичном билиарном циррозе крупные желчные протоки всегда проходимы и по ним желчь может поступать в кишечник, но при этом отмечаются чрезвычайно высокие значения общего холестерина (в 4–8 раз выше нормы), а также лецитина (в 4–10 раз выше нормы) в сыворотке крови. При этом нейтральные липиды находятся на низких значениях [14, 16]. А вот при вторичном билиарном циррозе, связанном с полной обструкцией крупных желчных протоков и нарушением оттока желчи, такого значительного повышения уровня холестерина и лецитина, не наблюдается [14, 16].
По данным Ahrens, анализ липидов сыворотки крови, дополнительно к клиническим и патологоанатомическим данным, является решающим результатом для диагностики «первичного (ксантоматозного) билиарного цирроза». В 50-е годы прошлого столетия это привело к определенным успехам в улучшении диагностики этого заболевания на более ранних стадиях. Выявленные нарушения липидного статуса при ПБХ позже были подтверждены данными исследования желчи и гепатобиоптатов этих пациентов с помощью 31P-ЯМР-спектроскопии [23].
Со времени появления работ Ahrens и соавт. клинические, лабораторные и патологоанатомические аспекты «первичного билиарного цирроза» были установлены [3]. Было дано клиническое определение «первичного (ксантоматозного) билиарного цирроза», выяснены нарушения липидного обмена, вызванные этим заболеванием, и созданы предпосылки для более точных исследований гистопатологической эволюции заболевания [24, 25].
Наряду с предложенным анализом липидов сыворотки крови происходит разработка и совершенствование морфологических методов, а также внедрение в клиническую практику метода чрескожной пункционной биопсии печени. Это позволило проводить прижизненные гистохимические и морфологические исследования биоптатов печени, что, в свою очередь, способствовало улучшению диагностики заболевания на самых ранних его стадиях.
Морфологические и электронно-микроскопические методы в изучении ПБХ
Морфологические классификации ПБХ
В 60-е гг. прошлого столетия E. Rubin и соавт. [26] впервые описали спектр гистологических изменений печени, выявленных при ПБХ в биоптатах печени. Авторы отмечали, что первичное повреждение происходит в мельчайших желчных протоках, что сопровождается клеточной, гранулематозной реакцией в портальном тракте и в соединительной ткани, где есть лимфатические сосуды [26]. В интралобулярных желчных протоках, то есть в холангиолах и каналикулах, выявляются желчные тромбы. Поверхности паренхиматозных клеток печени, гепатоцитов, прилегающих к поврежденным каналикулам, подвергаются дегенеративным и даже некротическим изменениям [26]. В течение большей части болезни пациент остается внешне кажущимся здоровым, поскольку сами клетки печени повреждаются незначительно, а последствия портальной гипертензии и недостаточности печеночной функции проявляются только на поздних стадиях заболевания, когда через много лет болезнь подходит к своему фатальному завершению [3].
Прижизненные морфологические и гистохимические исследования биоптатов печени способствовали появлению морфологических классификаций, описывающих стадии развития ПБХ. В 1967 г. Scheuer [24] представил подробное описание четырех гистологических стадий этого заболевания (таблица). Чуть позже H. Popper [27] и F. Schaffner [28] представили подробные морфологические изменения на различных стадиях заболевания и их взаимосвязь с клиническими признаками холестаза. Важную роль в развитии морфологических изменений авторы уделяют их взаимосвязи с нарушениями обмена желчных кислот [28]. В 1978 г. J. Ludwig и соавт. [25], проанализировав 219 индивидуальных биоптатов от 101 пациента с установленным морфологическим диагнозом «хронический негнойный деструктивный холангит» (первичный билиарный цирроз), предложили свою классификацию стадий заболевания
(таблица).
Известный советский патоморфолог Леонид Иосифович Аруин отмечал, что морфологические изменения в биоптатах печени характеризуются своеобразной «мозаичностью» повреждений [29]. В гистологических препаратах всегда можно видеть признаки по меньшей мере двух стадий. Это связано с тем, что последовательное прогрессирование от одной стадии к другой может быть по-разному выражено в различных участках органа [29, 30].
Различные терминологические отклонения в названиях отдельных морфологических стадий ПБХ лишь подчеркивают, отражают и уточняют суть происходящих патологических процессов, но не противоречат друг другу. Так как описание стадий в этих классификациях основываются на единых гистологических критериях, применимых ко всем образцам, и легко воспроизводимы, то эти классификации продолжают использоваться
и в настоящее время, спустя многие десятилетия. Во всех классификациях заявлено, что на ранних стадиях имеются характерные изменения прежде всего в мелких желчных протоках. И лишь по мере прогрессирования холестаза происходит повреждение гепатоцитов и развивается фиброз (стадия III).
Как видно из таблицы, выделение четырех стадий заболевания принято всеми морфологами, но при этом лишь стадия IV заболевания всеми единодушно представлена как цирроз и соответствует общепринятым критериям этого состояния [29].
Электронно-микроскопические и адгезиометрические данные
При проведении электронно-микроскопических и электронно-гистохимических исследований биопсийного материала печени больных ПБХ в 1980 гг.
были выявлены стереотипные изменения ультраструктуры, характерные для развернутой стадии заболевания: локальные расхождения гепатоцитов с увеличением межклеточных пространств; частичная гипертрофия и вакуолизация гладкого и шероховатого эндоплазматического ретикулума гепатоцитов; накопление в печеночных клетках липидных капель и образование миелиноподобных структур; изменение формы и структуры митохондрий, характеризующееся уменьшением числа крист внутренней мембраны [30].
Осмиофильные миелиноподобные и холестерин-дигитониновые структуры, вероятнее всего, представляют собой внутриклеточно расположенные комплексы холестерина, фосфолипидов и желчных кислот, образующихся в ответ на холестаз [30]. Прямых доказательств повышенного содержания желчных кислот в гепатоцитах не существует. Однако накопление в печеночных клетках осмиофильных миелиноподобных и холестерин-дигитониновых структур косвенно указывает на то, что повреждение гепатоцитов при хроническом холестазе обусловлено накоплением в них желчных кислот. Нейтрализация последних происходит вследствие связывания с холестерином и фосфолипидами. Вероятнее всего, осмиофильные миелиноподобные и холестерин-дигитониновые структуры и представляют собой такие комплексы.
Данные электронно-микроскопических исследований, показывающие нарушение межклеточных контактов при синдроме холестаза, согласуются с результатами оценки клеточной адгезии. Количественный адгезиометрический метод показал увеличение показателя разобщенности печеночных клеток при первичном билиарном холангите, свидетельствующее об ослаблении межгепатоцитарных взаимодействий (контактов) вследствие повышения давления в желчных капиллярах, возникающего в результате внутрипеченочного холестаза в мелких желчных протоках [31].
Существенным дополнением к выявленным электронно-микроскопическим и электронно-гистохимическим данным о нарушениях липидного и фосфорного обменов послужили исследования желчи и гепатобиоптатов пациентов с ПБХ с использованием 31Р-ЯМР-спектроскопии [23].
S. Sherlock: анализ и критика термина «первичный билиарный цирроз»
С учетом того что цирроз у пациентов с ПБХ развивается лишь на поздних стадиях болезни, всемирно известный ученый, врач-гепатолог Шейла Шерлок (Sheila Sherlock, 1918–2001) уже в 1959 г. выразила свое несогласие с термином «первичный билиарный цирроз», предложенным Ahrens [22].
S. Sherlock удалось пронаблюдать серию пациентов с длительным доцирротическим течением [22]. Она описала 42 клинических наблюдения за пациентами с диагнозом ПБХ, которых она лично курировала в течение 15 лет [22]. При описании клинических признаков S. Sherlock подробно описывает сроки появления кожного зуда, желтухи, места появления ксантом и ксантелазм в зависимости от уровня повышения холестерина в плазме крови, а также лабораторные отклонения активности показателей щелочной фосфатазы, гаммаглутамилтранспептидазы и гистологические изменения, полученные в результате исследования биопсийного и/или аутопсийного материала печени. По ее описаниям, у значительной части (20 (48%)) пациентов кожный зуд возникал задолго (от нескольких месяцев до 11 лет) до появления желтушности кожных покровов, однако у 14 (33%) пациентов зуд появился уже на фоне выраженной желтухи. Ксантомы на разгибательных поверхностях локтей, запястий, на поверхностях ягодиц, коленей и лодыжек наблюдались у 20 (48%) пациентов, которые имели высокие показатели холестерина в сыворотке крови. При этом S. Sherlock отмечала, что ксантоматозные отложения никогда не присутствовали в сухожильных оболочках. В шести случаях у пациентов были плоские ксантелазмы на веках. Повышение холестерина отмечалось не у всех пациентов, особенно на ранних стадиях патологического процесса. В нескольких случаях гепатомегалия была диагностирована при отсутствии каких-либо специфических жалоб (возможно, это было первое описание бессимптомного течения заболевания). Ни в одном случае не наблюдалось лихорадки или абдоминального болевого синдрома. Диагноз обычно верифицировался после хирургического вмешательства у 37 (88%) пациентов или по результатам биопсии печени. Последняя была выполнена у немногих пациентов, так как в начале 1950 гг. это была еще очень редкая процедура, которой успешно овладела S. Sherlock. В своих описаниях гистологической картины биоптатов печени она отмечала, что на ранних стадиях заболевания в морфологических препаратах наблюдались «полосы, которые состояли из молодой фиброзной ткани с мононуклеарными клетками и которые содержали скудные, малозаметные желчные протоки с уплощенным эпителием и без просвета» [22]. Фиброз можно проследить в виде тонких полос, которые проникают внутрь печеночной дольки. Клетки печени при этом чрезвычайно хорошо сохранены и иногда кажутся гипертрофированными. И лишь на поздних стадиях отмечалось «развитие фиброзных перегородок, пересекающих печень, что приводило к искажению зональной архитектоники и «смешанной» картине портального и билиарного цирроза». S. Sherlock подчеркивала, что на ранних стадиях «первичного билиарного цирроза» узелковая регенерация незаметна, а нарушение основной архитектоники печени является очень поздним признаком, в связи с чем она предложила свой термин для обозначения этого заболевания: «хроническая внутрипеченочная обструктивная желтуха» [22], считая его более удачным и подходящим, хотя и более громоздким. Однако предложенное название не получило широкой поддержки и признания, а термин «первичный билиарный цирроз» просуществовал до 2015 г.
В середине 1960 гг. бурное развитие клинической иммунологии и иммунологических методов неожиданно послужило важным моментом для диагностики самых ранних стадий заболевания.
Иммунологические методы в изучении ПБХ
Развитие иммунологии и ее значение для изучения и диагностики ПБХ
Открытие классов и подтипов иммуноглобулинов в середине прошлого столетия привело к бурному развитию и активному внедрению в клиническую практику иммунологических методов. К середине 1960 гг., когда было установлено большинство клинических, лабораторных и гистопатологических признаков «первичного билиарного цирроза», на фоне развития иммунологии и иммунологических методов были высказаны предположения, что заболевание может иметь иммунологическую основу или что иммунная система является каким-то вспомогательным звеном в патогенезе.
F. Paronetto и соавт. [32] с помощью иммунологических методов обнаружили и описали антитела, направленные против белковых компонентов желчных протоков. Эти антитела также встречались в случаях вирусного гепатита (67%), вторичного билиарного цирроза (43%), внепеченочной билиарной обструкции (32%) и алкогольного цирроза печени (22%) [33].
В это же время Дебора Дониах (Deborah Doniach,1912–2004), известный в те годы в Британии иммунолог, обратилась к не менее известной Sheila Sherlock с предложением провести иммунологическое тестирование пациентов с «первичным билиарным циррозом», поскольку у некоторых пациентов при этом заболевании встречался тиреоидит Хашимото, при котором обнаруживались циркулирующие антитела к тиреоглобулину. А у кроликов с экспериментально вызванным тиреоидитом иногда наблюдалась лимфоцитарная инфильтрация подобно той, которая встречалась в биоптатах печени при «первичном билиарном циррозе» [34]. Sherlock согласилась и поручила проведение иммунологических исследований при «первичном билиарном циррозе» Geoffrey Walker, одному из своих стажеров, увлекающемуся иммунологией. Результаты исследования с помощью иммунофлуоресцентного теста, в которое было включено 32 пациента с «первичным билиарным циррозом», показали, что добавление сыворотки крови больных к нефиксированным срезам щитовидной железы, желудка, почек и лимфоцитам периферической крови во всех случаях дает цитоплазматическую флуоресценцию [33]. Проведение иммунофлюоресцентного теста с сывороткой крови 33 пациентов контрольной группы с билиарной обструкцией или с другими видами холестаза продемонстрировало отсутствие цитоплазматической флуоресценции [33]. Антитела, выявленные в сыворотке крови пациентов с «первичным билиарным циррозом» и дающие флуоресценцию, не обладали ни видовой, ни органной специфичностью. Представленные данные свидетельствовали о том, что большинство аутоантител, обнаруженных в сыворотке крови пациентов с «первичным билиарным циррозом» печени, направлены против субклеточных органелл или растворимых белков, которые присутствуют не только в печени, но и во многих других органах [35]. Дальнейшие иммунологические исследования показали, что антиген, реагирующий с сыворотками «больных первичным билиарным циррозом», расположен преимущественно в митохондриальной фракции гомогенатов тканей, полученных методом дифференциального центрифугирования [36]. Более того, исследования P.A. Berg и соавт. [36] показали, что антиген расположен на внутренней мембране митохондрий. Полученные J.G. Walker, D. Doniach и S. Sherlock данные можно считать эпохальным открытием, которое позволило сделать два очень важных вывода [33, 36, 37]:
- Положительный иммунофлюоресцентный тест является диагностическим для ПБХ, что впервые позволило отличить это заболевание от других заболеваний, протекающих с внутри- и внепеченочным холестазом;
- Антиген, участвующий в иммунофлуоресцентном тестировании сывороток от пациентов с ПБХ, локализован на внутренней мембране митохондрий.
Исследования, проведенные в последующую четверть века, были направлены на определение и выявление антигена, к которому образуются митохондриальные антитела. Изучение ферментов, характерных для митохондрий, лизосом и микросом, подтвердило связь антигена с митохондриями. Высказывалось предположение, что этот антиген связан с митохондриальной АТФазой. Однако впоследствии выяснилось, что чистые фракции АТФазы, приготовленные другими методами, вообще не реагировали с сыворотками крови больных «первичным билиарным циррозом» [38].
Благодаря использованию различных иммунологических методов удалось выявить девять типов антител к различным антигенным структурам митохондрий (М1–М9) [39]. Специфическими для сывороток крови пациентов с ПБХ оказались М2-антигенные компоненты. Было показано, что наряду с М2 существуют и другие митохондриальные антигены и антитела к ним, представляющие интерес для диагностики и прогнозирования ПБХ [40]. Так, обнаружение анти-М9 связывают с ранними стадиями заболевания [41]. Митохондриальные анти-М4 и анти-М8 выявляются только у М2-положительных обследованных [40]. Их появление в сыворотке крови пациентов с ПБХ связывают с выраженным прогрессированием заболевания.
Развитие и использование молекулярно-генетических методов позволило путем клонирования сДНК митохондриального аутоантигена массой
74 кДа идентифицировать М2-антиген как компонент E2-субъединицы пируватдегидрогеназного (ПДГ) комплекса [41]. Антиген, реагировавший с сывороткой больных ПБХ, был охарактеризован как липопротеин [42], локализованный на внутренней митохондриальной мембране, что позже было подтверждено электронно-микроскопическими исследованиями F.B. Bianchi и соавт. [43]. Специфичность этого антигена для диагностики ПБХ
поразительна [38].
Значение открытия митохондриальных антител для диагностики ПБХ
Помимо большого научного интереса, открытие митохондриальных антител дало возможность клиницистам дифференцировать две формы цирроза, что ранее вызывало определенные трудности. Тест на митохондриальные антитела оказался удивительно точным методом подтверждения диагноза ПБХ. AMA были обнаружены с помощью метода непрямой иммунофлюоресценции более чем у 99% пациентов с ПБХ [44]. J.G. Walker и соавт. удалось показать, что ценность других тестов в дифференциальной диагностике ПБХ и билиарной обструкции весьма ограниченна [33, 37]. В связи с этим тесты на митохондриальные антитела были рекомендованы в качестве альтернативы хирургическому исследованию для подтверждения диагноза ПБХ. Титры митохондриальных антител не коррелировали с продолжительностью симптомов, глубиной желтухи, уровнем γ-глобулина или активностью щелочной фосфатазы в сыворотке крови пациентов с ПБХ [37].
Иммунологические реакции и выявление АМА позволили с достаточной уверенностью ставить диагноз ПБХ даже в ранних случаях, когда клинические признаки отсутствуют или малоспецифичны. Было показано, что обнаружение значительного титра АМА (более 1 : 40) убедительно свидетельствует о наличии ПБХ, даже при отсутствии симптомов и при нормальном уровне щелочной фосфатазы в сыворотке крови [45]. Типичные, ранние гистологические признаки ПБХ могут быть обнаружены при исследовании биоптатов печени людей, у которых единственным признаком заболевания является положительный анализ сыворотки крови на АМА [45]. Наличие положительных митохондриальных антител в сыворотке крови у пациента с отклонениями или без отклонений в функциональных пробах печени убедительно свидетельствует о диагнозе ПБХ [44]. L.E. Munoz и соавт. [44] на примере 22 клинических наблюдений показали, что рутинный скрининг сыворотки на щелочную фосфатазу и холестерин автоматизированными методами и тестирование на АМА у пациентов с признаками холестаза привели к распознаванию «первичного билиарного цирроза» на ранней стадии его развития [44]. Именно с определением митохондриальных антител и более широким распространением рутинного скрининга биохимических тестов печени стало известно об истинной распространенности бессимптомного и субклинического течения заболевания.
Наряду с АМА у части пациентов с «первичным билиарным циррозом» были выявлены антинуклеарные антитела (АНА) [46]. По мнению G.Walker, поскольку стойкие и высокие титры антител характерны для небольшого числа признанных клинических печеночных синдромов, представляется вероятным, что в этих случаях антитела могут быть маркерами предрасположенности к аутоиммунитету [35]. Со временем это представление переросло в утверждение, а наличие АМА и АНА послужило поводом считать «первичный билиарный цирроз» прототипом аутоиммунного заболевания и описывать его как парадигматическую модель аутоиммунного заболевания, что в настоящее время ставится под сомнение некоторыми авторами [47–49]. Образование АМА в доклинической стадии заболевания послужило основанием для утверждения, что они запускают процесс повреждения и гибели холангиоцитов. Считается, что наличие высоких титров АМА у большинства (95%) пациентов с первичным билиарным циррозом и АНА примерно у 50% больных указывает на потерю толерантности В-клеток к собственным антигенам.
Открытие АМА однозначно стало краеугольным камнем в диагностике ПБХ при обследовании пациентов с холестатическими симптомами [50].
Выявляемые особенности появления начальных признаков и течения заболевания послужили основой для появления клинических классификаций стадий и вариантов течения ПБХ.
Некоторые классификации клинических стадий и вариантов течения ПБХ
В 1984 г. Н.В. Прока, ученик академика А.С. Логинова, исходя из начальных проявлений ПБХ, в своей кандидатской диссертации выделил следующие варианты начальных проявлений заболевания [51]:
- протекающие с признаками холестаза, но без желтухи (заболевание начинается с зуда кожи и является наиболее распространенным вариантом начала «первичного билиарного цирроза»);
- протекающие преимущественно с неспецифическими проявлениями (холецистоподобные и диспепсические, гематологические, суставно-мышечные и другие проявления);
- протекающие с картиной развернутого холестаза (заболевание начинается с сочетания кожного зуда и желтухи).
Классификация, предложенная H. Sasaki и соавт. [52] в 1985 г., наиболее полно, кратко и точно отразила стадии клинического течения заболевания у большинства пациентов с ПБХ:
- бессимптомная стадия;
- стадия зуда;
- стадия желтухи;
- терминальная стадия.
Более подробное описание стадий течения ПБХ было представлено в классификации R. Poupon [53], опубликованной в 1991 г.:
- доклиническая, асимптоматическая стадия (характеризуется появлением в крови АМА, умеренным повышением активности гаммаглютамилтрансферазы (ГГТП), щелочной фосфатазы и 5’-нуклеотидазы);
- клиническая стадия развития заболевания (обычно длится от 5 до 19 лет и характеризуется проявлением всех клинических признаков «первичного билиарного цирроза»);
- терминальная стадия заболевания с развитием фиброза, цирроза и его осложнений (портальная гипертензия, асцит, пищеводно-желудочные кровотечения).
Лечение
Улучшение диагностики ПБХ и предполагаемая аутоиммунная природа заболевания послужили основанием для применения кортикостероидов [54] и иммунодепрессантов [55]. По мнению ряда авторов, применение кортикостероидов приводит к уменьшению слабости, интенсивности кожного зуда, незначительному снижению активности щелочной фосфатазы в плазме крови [54] и даже к некоторому улучшению гистологической картины печени [54, 55]. Но по мере накопления опыта лечения пациентов с ПБХ кортикостероидами однозначного положительного терапевтического эффекта, как при других аутоиммунных заболеваниях, не наблюдалось. По мнению W.N. Mann, с тех пор как он впервые в 1960 г. начал использовать кортикостероиды для лечения пациентов с «первичным билиарным циррозом», у него сложилось впечатление, что их применение может оказывать благоприятное влияние на течение болезни, но все же он склонен считать, что они имеют ограниченную или незначительную терапевтическую ценность [3].
Первые обнадеживающие результаты применения иммунодепрессантов [55] типа азатиоприна [56], циклоспорина [57], а также других препаратов, таких как колхицин [58], метотрексат [59], хлорамбуцил [60], не получили подтверждения в рандомизированных контролируемых исследованиях. Отсутствие терапевтического эффекта и тяжелые побочные эффекты послужили причиной отказаться от дальнейшего использования этих препаратов для лечения ПБХ.
Нарушение обмена меди и связанная с этим гиперпигментация кожных покровов при ПБХ послужили поводом для применения D-пенициламина у этих пациентов [61]. Однако использование
D-пенициламина в рандомизированных контролируемых исследованиях не подтвердило положительных результатов при его применении. Связано это с тем, что медь при ПБХ накапливается в органах и тканях организма в нетоксической, связанной с церуплазмином форме, а применение препарата сопряжено с рядом побочных эффектов [62].
Кожный зуд является одним из ранних клинических признаков ПБХ с необходимостью начала лечения, которое не всегда может оказаться эффективным. Причины кожного зуда могут быть многообразны: отложение желчных кислот в эпидермисе, сопровождающееся их детергентным действием на миелиновую оболочку нервных волокон и раздражающим действием на нервные окончания; вовлечение опиоидных рецепторов и другие. Применение антагонистов опиоидных рецепторов (налоксон, налтрексон и др.) [63], ионообменных смол (холестирамин, холестипол и др.), фенобарбитала, рифампицина [64] способствует уменьшению интенсивности кожного зуда, наблюдаемому при ПБХ. Имеющиеся в литературе данные по использованию этих препаратов позволяют заключить, что все они оказывают кратковременное облегчение зуда, а механизм противозудного эффекта остается неизвестным. В последнее время считается, что эндогенные опиоиды могут модулировать сигнальные пути, участвующие в печеночном зуде, но вряд ли являются основными зудообразующими факторами при заболеваниях печени. Рифампицин рекомендовано использовать в качестве альтернативного препарата второй линии для лечения кожного зуда, связанного с хроническим холестазом. Но с учетом его гепатотоксичности этот препарат не должен применяться длительное время и у больных с третьей и четвертой стадиями ПБХ.
Урсодезоксихолевая кислота (УДХК) как препарат первой линии в лечении ПБХ
В 1987 г. немецкие гепатологи U. Leuschner и W. Kurtz [65] сообщили о положительном эффекте УДХК у пациентов с «первичным билиарным циррозом». Препарат изучали во многих рандомизированных, плацебо-контролируемых исследованиях у пациентов со стадиями I–IV ПБХ, как с положительными, так и с неоднозначными результатами [66–68]. Клинические исследования показали, что пероральный прием УДХК в дозе 13–15 мг/кг/сут хорошо переносится больными и оказывает положительный терапевтический эффект при холестатических заболеваниях печени [69]. Авторы научных публикаций отмечают, что УДХК у большинства пациентов улучшает биохимические маркеры холестаза (щелочная фосфатаза, гаммаглютамилтранспептидаза), замедляет прогрессирование заболевания, откладывает трансплантацию печени и смерть у большинства пациентов, улучшая их выживаемость [70, 71]. Эффективность применения УДХК зависит от стадии заболевания: чем раньше (I–II стадия) начато лечение, тем оно эффективнее. Применение урсодезоксихолевой кислоты при ПБХ задерживает гистологическую прогрессию заболевания и продлевает выживаемость пациентов без трансплантации печени, в связи с чем этот препарат рекомендуется в качестве терапии первой линии для всех пациентов с ПБХ [69, 72, 73]. Механизм положительного эффекта УДХК до конца не изучен, но уже понятно, что он основан на ее физико-химических свойствах, метаболизме и энтерогепатической циркуляции [74, 75]. На протяжении 35 лет УДХК является уникальным препаратом выбора для лечения пациентов с ПБХ. В последние годы расширился список гидрофильных желчных кислот, которые используются для лечения холестатических заболеваний печени, включая ПБХ [74, 75]. Помимо УДХК, рассматривается возможность использования в качестве лекарственных средств тауроурсодезоксихолевой кислоты, норурсодезоксихолевой кислоты и обетихолевой кислоты.
Достижения в развитии методов трансплантации печени сыграли важную роль в продлении жизни пациентов с терминальной стадией ПБХ [76]. Трансплантация печени остается наиболее эффективным и единственным радикальным методом лечения пациентов с прогрессирующим заболеванием, несмотря на медикаментозную терапию, в т.ч. пациентов с терминальной стадией ПБХ [76].
Номенклатурный переход от цирроза к холангиту
Наличие доклинической, асимптоматической стадии и длительное отсутствие каких-либо физикальных признаков заболевания подтвердили высказывания S. Sherlock [77] о неправомочности термина «первичный билиарный цирроз» . На состоявшейся 23–24 мая 2014 г. в Милане второй монотематической конференции Европейской ассоциации по изучению печени (European Association for the Study of the Liver – EASL), посвященной «первичному билиарному циррозу», было предложено изменить название «первичный билиарный цирроз» на «первичный билиарный холангит» и выдвинуто два важных аргумента в поддержку этого предложения:
- Термин «первичный билиарный холангит» более точно отражает процессы, происходящие при развитии заболевания: повреждение билиарных эпителиальных клеток мелких внутрипеченочных желчных протоков с развитием дуктулопении, внутрипеченочного холестаза и медленно прогрессирующего фиброза. Заболевание чаще диагностируется при сочетании повышенного уровня активности щелочной фосфатазы, положительного теста на наличие АМА и наличия соответствующей гистологической картины в биоптате печени. В доклинической и клинической стадиях, согласно морфологическим и клиническим классификациям, пациенты не имеют цирроза печени. Развитие цирроза является поздней терминальной стадией заболевания. Поскольку цирроз является конечной стадией процесса, термин «первичный билиарный холангит» является более корректным;
- Термин «первичный билиарный холангит» является более приемлемым и для пациентов. Слово «цирроз» большинством пациентов воспринимается как фатальный, смертельный приговор. Психологически для пациентов диагноз «первичный билиарный цирроз» вселяет ужас плохого прогноза, что усугубляет его течение, особенно на ранних стадиях заболевания. И хотя в настоящее время течение заболевания обычно приводит к постепенному ухудшению качества жизни пациентов, а лечение предусматривает пожизненный прием препаратов, с учетом научного прогресса в распознавании новых механизмов развития заболевания и усилий ученых по разработке новых лекарственных препаратов у пациентов появляется надежда, что они могут жить, несмотря на наличие этого заболевания.
С учетом всех перечисленных аргументов участники конференции большинством голосов приняли решение одобрить предложение правления Европейской ассоциации по изучению печени об изменении названия «первичный билиарный цирроз» на «первичный билиарный холангит». В течение 2014 и 2015 гг. это решение было поддержано и одобрено Американской ассоциацией по изучению заболеваний печени (American Association for the Study of Liver Disease – AASLD), Американской гастроэнтерологической ассоциацией (American Gastroenterological Association – AGA), объединенным Европейским советом по гастроэнтерологии (United European Gastroenterology (UEG) Governing Board) и Азиатско-Тихоокеанской ассоциацией по изучению печени (Asian Pacific Association for the Study of the Liver – APASL). Решение всех общественных организаций было внесено на рассмотрение Всемирной организации здравоохранения, которая в свою очередь поддержала принятую ими резолюцию об изменении термина «первичный билиарный цирроз» на «первичный билиарный холангит» и рекомендовала внести коррективы в соответствующий код международной классификации болезней 10-го (K.74.3) и 11-го (DB37.2) пересмотров. С 2015 г. заболевание во всем мире упоминается как первичный билиарный холангит.
Появление новых данных и представлений по ПБХ
Несмотря на то что этиология ПБХ не выявлена, на настоящий момент накоплены результаты научных исследований, позволяющие сформировать представление о механизмах, запускающих процессы повреждения мелких билиарных эпителиальных клеток (БЭК, холангиоциты), образования АМА и развития клинических признаков заболевания. Немаловажную роль в изучении этих моментов сыграли быстро развивающиеся молекулярные и генетические методы, использование которых позволило раскрыть и понять многие механизмы, способствующие развитию клинических, морфологических и лабораторных признаков заболевания.
В качестве внутренних факторов развития ПБХ отмечают генетическую предрасположенность к заболеванию. В 2021 г. опубликовано первое генетическое исследование, сфокусированное на хромосоме X при ПБХ [78]. Главным открытием этого исследования является идентификация нового общегеномного значимо-ассоциированного локуса, отмеченного полиморфизмом rs7059064 [78]. Этот локус характеризуется наличием контрольного элемента (superenhancer), который может регулировать несколько аутоиммунно-релевантных генов ПБХ. Выявлен ряд генов, которые, по мнению R. Asselta и соавт., могут вносить свой «скромный вклад» в развитие этого заболевания [78].
Развитие молекулярно-генетических методов позволило выявить и показать, что у женщин с ПБХ по неизвестным причинам индуцируются X-сцепленные эпигенетические изменения, приводящие к повышенной экспрессии микро-РНК 506 (miR-506) в холангиоцитах [79]. Последняя регулирует функционирование трансмембранных белков, ответственных за поступление бикарбоната из холангиоцита в просвет желчного протока. Происходит подавление экспрессии генов рецептора третьего типа к инозитолтрифосфату (InsP3R3) и хлор/бикарбонатного анионообменника 2 (AE2), что было отмечено при исследовании биоптатов печени и мононуклеарных клеткок крови пациентов с ПБХ. Возникающее подавление активности InsP3R3 и AE2 приводит к недостаточному поступлению бикарбоната (HCO3-) в просвет желчного протока [79, 80]. В результате недостаточного поступления HCO3- в желчные протоки при ПБХ происходит смещение рН внутрипротоковой (печеночной) желчи в слабокислую область и увеличение рН внутри холангиоцитов в слабощелочную область.
Открытие этих данных позволило разработать концепцию развития первых, начальных признаков заболевания [48, 62, 81]. Представленная концепция позволяет объяснить механизм развития первых признаков ПБХ, появляющихся в асимптоматической стадии заболевания и ответить на следующие вопросы [48, 82, 83]:
Почему при ПБХ повреждаются только мелкие холангиоциты, выстилающие желчные протоки мелкого и среднего размера?
Каким образом антиген Е2 ПДГ, находясь на внутренней мембране митохондрий, становится доступным для иммунных клеток?
Почему антитела образуются только к Е2-субъединице и не образуются к Е1- и Е3-субъединицам ПДГ?
Каков механизм образования АМА?
Исходя из этой концепции становится понятным, что при ПБХ первичным повреждающим фактором для мелких холангиоцитов являются желчные кислоты, а не АМА. Накопление желчных кислот в мелких БЭК и неполный их апоптоз, перенаправленный в некроз, может приводить к повреждению внутриклеточных органелл, включая митохондрии, с последующей генерацией AMA [48, 84]. По мере нарастания холестаза в патологический процесс вовлекаются гепатоциты.
Лечение ПБХ остается сложной задачей, поскольку причина этого хронического, медленно прогрессирующего холестатического заболевания печени до сих пор не установлена. Появление новых научных данных может стать основой для разработки новых лекарственных препаратов, направленных на локальное подавление активности miR-506 или активацию анионообменника AE2 в холангиоцитах. Это, вероятно, станет одним из новых терапевтических направлений в лечении ПБХ в дополнение или вместо существующих препаратов желчных кислот.
Заключение
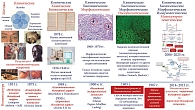
Первичный билиарный холангит – это хроническое холестатическое заболевание печени, относящееся к холангиопатиям. Почти 175 лет тому назад только на основании клинических методов обследования (опросы, осмотры) и результатов патологоанатомических вскрытий были сделаны первые описания отдельных признаков этого заболевания (рисунок). По мере развития новых научных методов исследования расширялись представления о тех изменениях, которые происходят в организме по мере прогрессирования заболевания, повышались возможности улучшения его диагностики.
Историческая этапность раскрытия и описания различных признаков, механизмов их развития, изложенная в этом обзоре, демонстрирует значение и вклад лабораторных (химических, биохимических, морфологических, иммунологических, молекулярно-генетических и др.) и инструментальных (чрескожная пункционная биопсия печени) методов в изучение ПБХ. Особую роль в улучшении диагностики этого заболевания сыграло развитие иммунологии и иммунологических методов исследования. Выявление АМА наряду с повышением активности щелочной фосфатазы и гаммаглутамилтрансферазы позволяет диагностировать ПБХ в асимптоматической стадии заболевания. Несмотря на то что до настоящего времени этиология ПБХ неизвестна, раскрытие патогенетических механизмов, участвующих в прогрессировании этого заболевания, способствовало разработке современных способов его лечения, включая использование препаратов желчных кислот (урсодезоксихолевая кислота, тауроурсодезоксихолевая кислота, обетихолевая кислота, норурсодезоксихолевая кислота). С появлением новых молекулярно-генетических методов исследований и благодаря усилиям ученых, направленным на раскрытие этиологии и патогенеза заболевания, в ближайшем будущем станет возможным появление новых лекарственных препаратов, способных приостановить прогрессирование и предупредить возникновение ПБХ.
I.V. Maev, PhD, Prof., Academician of the RAS, E.V. Vinnitskaya, PhD, V.I. Reshetnyak, PhD, Prof.
Russian University of Medicine, Moscow
A.S. Loginov Moscow Clinical Scientific Center
Contact person: Vasily I. Reshetnyak, vasiliy.reshetnyak@yandex.ru
Primary biliary cholangitis (PBC) is a chronic cholestatic progressive liver disease. It is marked by the occurrence of apoptosis, necrosis, and the destruction of cholangiocytes, resulting in the loss of the epithelial lining in the small intra-lobular, inter-lobular, and septal intrahepatic bile ducts. This process is accompanied by the formation of antimitochondrial autoantibodies, the development of ductulopenia, and the onset of cholestasis. The progressive nature of this condition leads to a subsequent development of cirrhosis and liver failure in late stages of the disease. The disease is classified as a cholangiopathy. The review encompasses the historical evolution of the disease's initial references, the transformation and adaptation of its nomenclature as methods of new scientific research emerged, progressed, and were integrated into clinical practice. In the review also addresses the challenges and opportunities in the treatment of PBC, taking into account the emergence of novel scientific evidence. Additionally, consider the significance of new molecular data on impaired bicarbonate production by cholangiocytes in the pathogenesis of primary biliary cholangitis.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.