Вариантный синдром первичного билиарного холангита с признаками аутоиммунного гепатита: клиническое наблюдение как повод для дискуссии о единстве и двойственности аутоиммунной патологии печени
- Аннотация
- Статья
- Ссылки
- English


Ведение
Аутоиммунные заболевания печени (АИЗП) представляют собой группу иммуноопосредованных нарушений структуры и функции гепатоцитов и желчных протоков. В основе их классификации лежит преимущественная мишень аутоагрессии: выделяют нозологии с преобладанием гепатоцеллюлярного поражения (аутоиммунный гепатит) и с преобладанием холангиоцеллюлярного поражения (первичный билиарный холангит, ПБХ, и первичный склерозирующий холангит, ПСХ). В отдельную категорию можно вынести вариантные синдромы, при которых у пациента одновременно или последовательно выявлены черты двух и более АИЗП [1].
Аутоиммунный гепатит (АИГ) – это хроническое прогрессирующее воспалительное заболевание печени неизвестной этиологии, характеризующееся гетерогенностью клинико-лабораторных и морфологических проявлений, в основе которого лежат механизмы аутоагрессии; без лечения приводит к формированию выраженного фиброза и цирроза печени [2].
Первичный билиарный холангит – хроническое иммуноопосредованное заболевание печени, протекающее с деструкцией мелких желчных протоков, характерной чертой является синдром холестаза [3–5].
Сочетание признаков АИГ и ПБХ у одного пациента относят к особым формам АИЗП; их вклад в клиническую картину может быть равнозначным, либо может доминировать один из компонентов, что создает значительную вариабельность в течении болезни. Вопрос о последовательности манифестации компонентов особых форм АИЗП остается дискуссионным [3], терминология и номенклатура окончательно не стандартизированы: в русскоязычной медицинской литературе часто традиционно используется понятие «аутоиммунный перекрест», в этом случае в диагнозе перечисляются два (или три) имеющихся у пациента АИЗП, например, «синдром аутоиммунного перекреста: АИГ/ПБХ». Однако эта формулировка не дает представления о том, какое заболевание преобладает в конкретном случае; поэтому еще в 2015 г. Европейской ассоциацией по изучению болезней печени (EASL) было рекомендовано обозначать вариантные формы по основному заболеванию, доминирующему в клинической картине, с дополнением, указывающим на признаки второго АИЗП. Это более точно отражает суть происходящего патологического процесса, например, в случае сочетания выраженного холестатического синдрома с низкой или умеренной активностью гепатита рекомендовано формулировать диагноз как «ПБХ с признаками АИГ» [6].
Всем пациентам с подозрением на вариантную форму ПБХ рекомендуется выполнение пункционной биопсии печени (при отсутствии противопоказаний) [3–5]. В дальнейшем диагностика вариантного синдрома проводится с применением так называемых Парижских критериев, которые одобрены Европейской ассоциацией по изучению болезней печени и российскими экспертами [3]; тем не менее ввиду сложности патогенеза и отсутствия стандартизированного подхода чувствительность и специфичность критериев требует пересмотра [7]. При выявлении признаков АИГ в дополнение к стандартному лечению ПБХ препаратами урсодезоксихолевой кислоты (УДХК) требуется назначение иммуносупрессивной терапии (ИСТ) [3, 6].
Клинический случай
В качестве иллюстрации сложности ведения пациентов с аутоиммунным вариантным синдромом может служить клиническое наблюдение пациентки Л. с дебютом заболевания в возрасте 45 лет, которая предъявляла жалобы на зуд кожи, горечь во рту, периодическую тошноту.
Пациентка была проинформирована о целях исследования и дала согласие на публикацию данных истории болезни в обезличенном виде; осмотр, обследование и лечение проведены согласно клиническим рекомендациям Министерства здравоохранения РФ.
Анамнез жизни
Пациент – женщина 47 лет, преподаватель, профессиональные вредные факторы отсутствуют, вредные привычки отрицает. Семейный анамнез не отягощен, лекарственные препараты не принимает.
Анамнез заболевания
Считает себя больной с 45-летнего возраста, когда на фоне полного здоровья впервые отметила появление периодического кожного зуда в области ладоней, голеней и стоп: предпринимались попытки терапии блокаторами гистаминовых Н1-рецепторов (лоратадин) и эмолентами с незначительным эффектом. Спустя год стала отмечать горечь во рту по утрам, периодически тошноту без четкой связи с приемом пищи.
В 2019 г. пациентка впервые амбулаторно обратилась за медицинской помощью к гастроэнтерологу для обследования, по результатам которого получены следующие результаты: в клиническом анализе крови отклонений не отмечалось; в биохимическом анализе крови аланиновая аминотрансфераза (АЛТ) превышала верхнюю границу нормы (ВГН) в 5 раз, аспарагиновая аминотрансфераза (АСТ) – в 4,5 раза; отмечался лабораторный синдром холестаза с повышением гамма-глутамилтранспептидазы (ГГТП) до 7 ВГН, щелочной фосфатазы (ЩФ) до 3 ВГН, гиперхолестеринемия. Основные результаты лабораторных исследований представлены в табл. 1.
Пациентка наблюдалась у гастроэнтеролога амбулаторно: состояние расценивалось как хронический гепатит неуточненной этиологии; неоднократно проводились курсы гепатопротективной терапии препаратами адеметионина и эссенциальных фосфолипидов с незначительным клиническим эффектом в виде уменьшения тошноты и периодического снижения интенсивности кожного зуда; лабораторные изменения сохранялись (табл. 1).
В ноябре 2020 г. пациентке впервые выполнен анализ крови на антимитохондриальные аутоантитела (АМА-М2), которые были выявлены в повышенном титре, на основании чего (в сочетании с синдромом холестаза) был впервые установлен диагноз ПБХ. К терапии была добавлена УДХК в дозе 1000 мг в сутки: в течение трех недель был достигнут клинический ответ в виде улучшения общего состояния и значительного снижения интенсивности кожного зуда. Тем не менее спустя шесть месяцев терапии лабораторно положительная динамика оставалась минимальной: трансаминазы снизились с 5–6 до 5,6 ВГН, ГГТП – с 7 до 6 ВГН, ЩФ – с 3,5 до 2,5 ВГН (табл. 1).
Первая госпитализация
20 сентября 2021 г. пациентка впервые поступила в отделение заболеваний печени Московского клинического научно-практического центра им. А.С. Логинова. На момент поступления предъявляла жалобы на общую слабость и выраженный кожный зуд.
При осмотре, проведенном согласно правилам пропедевтики внутренних болезней, в объективном статусе клинически значимых особенностей выявлено не было: состояние средней степени тяжести, сознание ясное; нормостенический тип телосложения, вес 65 кг, индекс массы тела 23,4; кожа и склеры обычной окраски; при аускультации определялось везикулярное дыхание без хрипов с частотой 16 дыхательных движений в минуту; тоны сердца ритмичные с частотой 68 в минуту, шумы не определялись. Артериальное давление – 110 и 70 мм рт. ст.; живот при пальпации мягкий, безболезненный, не увеличен в объеме; печень и селезенка не выступали из-под края реберной дуги; стул и диурез в норме.
По данным эзофагогастродуоденоскопии (ЭГДС) от 22.09.2021 г. патологии выявлено не было; по данным ультразвукового исследования органов брюшной полости (УЗИ) от 21.09.2021 г. отмечено наличие диффузных изменений печени и поджелудочной железы.
С целью дифференциальной диагностики с учетом холестатического синдрома проведена магнитно-резонансная холангиопанкреатография (МРХПГ) – структурной патологии не выявлено, что позволило исключить ПСХ крупных желчных протоков.
Для уточнения стадии фиброза и степени стеатоза выполнена фиброэластометрия: эластичность печени составила 11,7 кПа, что соответствует стадии фиброза F3 по шкале METAVIR, стеатоз отсутствовал (S0).
В клиническом анализе крови все показатели находились в пределах референсных значений; в биохимическом анализе сохранялся умеренный цитолитический синдром с повышением АЛТ и АСТ до 4 ВГН; синдром холестаза с повышением ЩФ до 4 ВГН, ГГТП до 6 ВГН; обращало на себя внимание повышение уровня общего билирубина до 40 мкмоль/л (преимущественно за счет непрямой фракции); белково-синтетическая функция печени была сохранена (альбумин – 41 г/л). В ходе обследования исключены вирусные гепатиты серологически и методом ПЦР (табл. 1).
При иммунологическом обследовании выявлены антимитохондриальные аутоантитела (АМА-М2) в диагностическом титре, которые при наличии холестаза рассматриваются как патогномоничные для ПБХ, что позволило подтвердить поставленный ранее диагноз [4].
Кроме этого, повышение иммуноглобулина (Ig) G до 18,2 г/л, выявление антинуклеарного фактора (АНФ или ANA) методом непрямой реакции иммунофлюоресценции (НРИФ) в высоком титре 1/640, наличие антигладкомышечных аутоантител (aSMA) в диагностически значимом титре 1/80 в комплексе с отсутствием достаточного лабораторного ответа на терапию УДХК позволили заподозрить наличие у больной АИГ. Согласно российским и зарубежным рекомендациям для верификации диагноза необходимо проведение морфологического исследования печени [2, 3]. Противопоказаний к данной процедуре не было, пациентка дала информированное согласие; проведена тонкоигольная пункционная биопсия печени, получен столбик ткани длиной 20 мм.
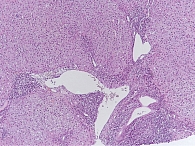
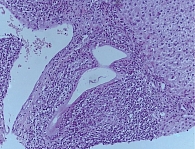
По результатам гистологического исследования биоптата печени были выявлены как характерные черты ПБХ (деструкция мелких желчных протоков), так и признаки АИГ (ступенчатые некрозы, эмпериополез и лимфоцитарные розетки); заключение морфолога: «Аутоиммунный гепатит умеренной степени активности. Первичный билиарный холангит». Стадия фиброза соответствовала F2 по шкале METAVIR. Индекс гистологической активности (ИГА) по Knodell – 9. Морфологическая картина ткани печени представлена на рис. 1 и 2.
Таким образом, в соответствии с Парижскими критериями диагноза вариантного синдрома (табл. 2): у пациентки определяются три критерия ПБХ (ЩФ повышена до 510, что составляет более 2 ВГН, выявлены АМА-М2, морфологические признаки негнойного деструктивного холангита) и два критерия АИГ (выявлены aSMA в титре 1/80, ступенчатые некрозы и лимфоцитарные розетки в биоптате печени).
Установлен диагноз «первичный билиарный холангит, АМА-позитивный, с признаками АИГ, умеренной гистологической активности».
С 1 октября 2021 г. начата ИСТ – метилпреднизолон в дозе 0,7 мг/кг массы тела (48 мг) с постепенным снижением до 4 мг в неделю; прием УДХК продолжен в дозе 15 мг/кг массы тела (1000 мг). Через две недели был достигнут клинический ответ в виде купирования кожного зуда; лабораторно также отмечалась положительная динамика в виде уменьшения показателей цитолиза и холестаза: АЛТ снизилась с 4 до 3 ВГН, АСТ – с 4 до 2 ВГН, ГГТП – с 6 до 5 ВГН, ЩФ – с 4 до 2 ВГН; отмечена нормализация уровня IgG. После контрольной оценки лабораторных проб согласно рекомендациям к терапии был добавлен азатиоприн 100 мг в сутки с последующим постепенным снижением дозы метилпреднизолона до минимальной. На фоне поддерживающей терапии (метилпреднизолон 8 мг + азатиоприн 100 мг) кожный зуд отсутствовал, достигнута стойкая биохимическая ремиссия, которая сохранялась в течение трех лет (табл. 1).
Вторая госпитализация
10 октября 2024 г. (через три года после первой госпитализации) пациентка была повторно госпитализирована в отделение заболеваний печени для определения дальнейшей тактики; ключевым моментом в решении вопроса о пролонгации или отмене ИСТ является оценка гистологической активности, для чего была проведена повторная биопсия печени. На момент госпитализации пациентка получала поддерживающую терапию: метилпреднизолон – 4 мг, азатиоприн – 50 мг, УДХК – 1000 мг в сутки.
В объективном статусе при поступлении клинически значимых особенностей выявлено не было; ЭГДС – без патологии; по данным УЗИ органов брюшной полости отмечалось наличие диффузных изменений печени и поджелудочной железы без динамики по сравнению с предыдущими исследованиями.
По данным фиброэластометрии печени эластичность печени составляла 6,9 кПа, что соответствует стадии фиброза F1. С учетом длительной ИСТ пациентке была выполнена денситометрия, по результатам которой выявлена остеопения шейки бедренной кости и остеопороз поясничного отдела позвоночника; эндокринологом назначено лечение препаратами алендроновой кислоты и витамином D с положительным эффектом.
В коагулограмме, клиническом и биохимическом анализах крови – без отклонений; сохранялся нормальный уровень IgG (табл. 1).
Для решения вопроса об отмене ИСТ требовалось проведение контрольной биопсии печени, так как отсутствие активности лабораторно не позволяет достоверно судить о наличии гистологической ремиссии. Противопоказаний к процедуре не было, пациентка дала информированное согласие; проведена тонкоигольная пункционная биопсия печени, получен столбик ткани длиной 18 мм. По результатам исследования биоптата печени было получено заключение морфолога: «Аутоиммунный гепатит низкой степени активности. Первичный билиарный холангит. При сравнении с препаратами от 2021 г. наблюдается положительная динамика, которая заключается в снижении активности портального воспаления, отсутствии ступенчатых некрозов. ИГА по Knodell – 4».
Полная отмена ИСТ при АИГ показана при снижении ИГА до 3 баллов и менее. В данном клиническом случае с учетом достаточного периода терапии пограничных показателей ИГА и развития нежелательных явлений в виде остеопороза была избрана тактика ступенчатой отмены иммуносупрессии: метилпреднизолон был постепенно отменен, в то время как прием азатиоприна был продолжен на срок шесть месяцев с последующей полной его отменой.
Биохимическая ремиссия сохраняется на всех этапах наблюдения: через три месяца после отмены метилпреднизолона и через восемь месяцев после отмены азатиоприна.
Обсуждение
Настоящее клиническое наблюдение позволяет выделить несколько ключевых аспектов ведения пациентов с АИЗП:
- важность расширенного диагностического поиска при первичном выявлении цитолиза и/или холестаза для своевременного выявления этиологии заболевания;
- роль морфологического исследования печени;
- диагностическая точность фиброэластометрии при АИЗП;
- критерии отмены ИСТ.
В представленном клиническом наблюдении был диагностирован вариантный синдром «ПБХ, АМА-позитивный, с признаками АИГ», назначена адекватная терапия, достигнута стойкая ремиссия заболевания. Однако от момента первичного выявления изменений в биохимических показателях крови до установления окончательного клинического диагноза у данной пациентки прошло более двух лет.
Этот пример наглядно демонстрирует характерную для данной патологии проблему поздней диагностики, что подтверждается нашим собственным опытом ведения пациентов с АИЗП и согласуется с данными литературы.
Иллюстрацией может служить исследование, опубликованное в журнале JHEP Reports в 2024 г., в котором проанализированы данные 1331 пациента с АИЗП, из них у 83 человек установлен вариантный синдром ПБХ с признаками АИГ. Синхронная диагностика ПБХ и АИГ была зафиксирована лишь у 56 (67%) больных. У остальных 27 (33%) пациентов диагноз устанавливался поэтапно: из них у 22 изначально был верифицирован ПБХ, а у 5 – АИГ. Обращает на себя внимание длительный медианный интервал между первым проявлением болезни и постановкой окончательного диагноза, составивший четыре года (диапазон от семи месяцев до 16 лет) [8]. Это подчеркивает как сложность диагностики и часто позднее распознавание данной формы патологии, так и ее возможный последовательный вариант развития, при котором заболевание может дебютировать как с ПБХ, так и с АИГ, с последующим присоединением признаков второй нозологии.
В представленном клиническом наблюдении в течение полутора лет лечение пациентки в амбулаторных условиях осуществлялось с формулировкой «хронический гепатит неуточненной этиологии» без проведения углубленного обследования для установления генеза заболевания.
Описанная ситуация высвечивает и другую ключевую клиническую проблему: при обнаружении необъяснимого цитолиза требуется проведение расширенного диагностического поиска для установления этиологического фактора. В дифференциальный ряд должны быть включены аутоиммунные процессы, болезни накопления, воздействие гепатотоксичных агентов и другие причины, а не только исключение вирусных гепатитов, как это имело место в описанном случае.
Вместе с тем уже при первом обследовании выявлялся синдром холестаза (как лабораторно – повышение уровня ЩФ до 3 ВГН, так и клинически – в виде кожного зуда), в связи с чем требовалось исключение холестатических заболеваний печени, наиболее частыми из которых являются ПБХ и ПСХ. Поэтому всем пациентам с синдромом холестаза рекомендуется оценивать титры аутоантител АМА-М2, sp-100 и gp-210 и выполнять магнитно-резонансную холангиопанкреатографию (МРХПГ) [9].
Другими возможными причинами холестатического синдрома могут быть лекарственные поражения печени, IgG4-ассоциированный холангит, а также вирусный гепатит: важно помнить о возможном инфицировании вирусами гепатитов А и Е, а также о редких случаях поражения печени вирусами, традиционно не относящимися к гепатотропным (например, цитомегаловирус и др.). Отсутствие необходимых диагностических мероприятий приводит к запоздалой диагностике, неэффективному лечению гепатопротекторными препаратами, многие из которых не имеют достаточной доказательной базы, и прогрессированию фиброза печени.
В данном клиническом примере только спустя полтора года наблюдения пациентке впервые был выполнен анализ крови на антимитохондриальные аутоантитела АМА-М2 и поставлен диагноз «первичный билиарный холангит»; назначена терапия препаратами УДХК, которая является стандартом лечения этого заболевания.
Вместе с тем в ходе диагностического процесса осталась недооцененной значительная активность цитолиза, нетипичная для классического течения ПБХ, и не были исследованы иммунологические показатели, вследствие чего пациентке назначали терапию ПБХ в чистом виде, что, вероятно, способствовало дальнейшему прогрессированию заболевания.
Другим важным моментом является применение стандартизированных критериев (Барселонских, Парижских, Торонтских и др.) для оценки ответа на терапию (табл. 3): характер ответа (положительный или его отсутствие) приобретает роль значимого диагностического инструмента, позволяя косвенно судить о корректности первоначальной диагностической гипотезы.
Так, согласно Парижским критериям I, уровень ЩФ спустя 12 месяцев терапии должен составлять менее 3 ВГН; с учетом Парижских критериев II требуется снижение ЩФ ниже 1,5 ВГН. В представленном клиническом наблюдении динамика ЩФ на фоне лечения была минимальной (спустя шесть месяцев терапии отмечалось снижение ЩФ с 412 до 312), в последующем зафиксирована отрицательная динамика в виде нарастания холестаза (повышение ЩФ до 510, то есть до 4 ВГН); снижение маркеров цитолиза также было недостаточным.
Отсутствие адекватного ответа на терапию УДХК в сочетании с персистирующей гиперактивностью цитолитических ферментов указывало на вероятность вариантного синдрома ПБХ с признаками АИГ. Окончательный диагноз был установлен только в сентябре 2021 г. при обращении в наше учреждение – спустя более двух лет с момента первичного выявления биохимических маркеров воспаления и холестаза.
Пациентке было проведено углубленное иммунологическое обследование: выявлены антитела к гладкой мускулатуре (aSMA) в диагностически значимом титре, а также повышение IgG, который является важным маркером АИГ и входит в диагностические критерии вариантного синдрома; для установления диагноза необходимо наличие как минимум двух ключевых критериев для каждого заболевания (табл. 2).
Несмотря на формальное соответствие показателей анализов и исследований пациентки диагностическим критериям АИГ, выявленное с применением неинвазивных методов (повышение трансаминаз до 5 ВГН и наличие aSMA), была проведена гистологическая верификация диагноза. Ключевыми аргументами в пользу биопсии стали пограничные значения аминотрансфераз, которые в дебюте и на фоне терапии УДХК колебались в диапазоне 4–5 ВГН, а также высокая ответственность назначения иммуносупрессивной терапии.
Морфологическое исследование биоптата при подозрении на АИГ и вариантные синдромы ПБХ рекомендовано как зарубежными гайдлайнами, так и отечественными экспертами [2, 3]. С учетом потенциальных рисков длительной иммуносупрессии [10] для инициации ИСТ требуется высокая диагностическая достоверность, что делает недопустимой гипердиагностику. Однако в ряде клинических ситуаций, когда даже при потенциально высокой гистологической активности не достигается диагностический порог по критериям АИГ, немедленное проведение биопсии печени может быть нецелесообразным. В таких случаях предпочтительной является неинвазивная стратегия, предполагающая динамическое наблюдение с возможностью пересмотра вопроса о биопсии при изменении лабораторных показателей и нарастании активности.
Особый научный и клинический интерес представляет роль фиброэластометрии в оценке стадии фиброза печени у пациентов с аутоиммунными заболеваниями, в частности при вариантном синдроме ПБХ. Наш многолетний клинический опыт свидетельствует о тенденции к гипердиагностике фиброза при использовании данного метода: как в дебюте заболевания, так и на начальном этапе иммуносупрессивной терапии нередко регистрируются повышенные показатели жесткости печени, которые демонстрируют значительное снижение в динамике. Современные представления о механизмах фиброгенеза и морфологических особенностях печени при АИЗП позволяют предположить, что повышенные значения жесткости обусловлены не только собственно фиброзом, но и активностью аутоиммунного воспаления, даже при уровне трансаминаз, не превышающем 5 ВГН (формально допустимый порог для проведения исследования). Представленный клинический случай наглядно демонстрирует расхождение между данными неинвазивной и морфологической оценки: при показателе жесткости печени 11,7 кПа (F3 по шкале METAVIR) гистологически была верифицирована стадия F2, что подтверждает ограничения применения эластометрии в условиях активного воспаления.
Следует отметить, что результаты опубликованных исследований по этому вопросу отличаются неоднозначностью. Ряд авторов указывает на необходимость корректировки диагностических порогов в сторону повышения для пациентов с ПБХ. В частности, в исследовании C. Corpechot и соавт. оптимальным пороговым значением жесткости печени для диагностики цирроза у пациентов с ПБХ и ПСХ был предложен уровень 17,3 кПа [11]. В то же время результаты недавно проведенного метаанализа 2023 г., включившего 60 исследований, демонстрируют высокую диагностическую точность фиброэластометрии при вариантных синдромах. Вместе с тем авторы метаанализа справедливо отмечают, что ввиду недостаточности данных вопрос о влиянии уровня АЛТ на различия в диагностической точности между пациентами с АИГ и ПБХ остается открытым [12].
Дальнейшее динамическое наблюдение за пациенткой продемонстрировало регресс фиброза печени на фоне ИСТ (при первичном обследовании гистологически определялась стадия F2, при контрольном обследовании спустя три года была верифицирована стадия F1), что соответствует современным научным данным, так как возможность обратного развития фиброза печени подтверждена многими авторами [13, 14].
Сохраняется некоторая неопределенность в отношении продолжительности лечения и протоколов прекращения иммуносупрессивной терапии при вариантных синдромах; при классическом АИГ отмена ИСТ рекомендуется при достижении индекса гистологической активности (ИГА) менее 4 баллов [2]. В представленном клиническом случае на основании длительного периода лечения, пограничных значений ИГА и развития нежелательного явления (остеопороза) была избрана индивидуальная тактика: проведена постепенная отмена метилпреднизолона с пролонгацией приема азатиоприна на шесть месяцев с последующей его отменой.
Динамическое наблюдение и лабораторный мониторинг подтвердили эффективность выбранного подхода: биохимические показатели оставались в пределах нормы при контрольном обследовании через три месяца после отмены метилпреднизолона, а также через восемь месяцев и до настоящего времени после полной отмены азатиоприна, что свидетельствует о стойкой биохимической ремиссии.
Следует отметить, что критерии отмены ИСТ при вариантном синдроме ПБХ с признаками АИГ не стандартизированы в связи с гетерогенностью клинических проявлений, при которых могут доминировать признаки либо ПБХ, либо АИГ, либо присутствует их равнозначное сочетание [3]. В условиях отсутствия унифицированных рекомендаций по терапии и ее прекращению при вариантных синдромах представляется целесообразным применение принципов, принятых для АИГ, а именно рассмотрение вопроса об отмене ИСТ через два года лечения при условии достижения гистологической ремиссии.
Заключение
В представленном клиническом случае доминирующим заболеванием являлся ПБХ, что подтверждалось наличием клинико-биохимического холестаза; о значительном вкладе АИГ свидетельствовало быстрое прогрессирование фиброза печени.
Следует отметить, что вариантные синдромы характеризуются значительным полиморфизмом клинических, лабораторных и гистологических признаков. В научном сообществе продолжается дискуссия относительно нозологического статуса перекрестных синдромов: рассматривать ли их как самостоятельные нозологические единицы или как переходные формы между отдельными АИЗП.
Актуальность проблемы подчеркивается ростом распространенности аутоиммунных перекрестных синдромов среди лиц молодого и среднего возраста, их агрессивным течением с быстрым развитием фиброза и цирроза печени, а также отсутствием унифицированных подходов к диагностике и терапии. Все вышеизложенное определяет необходимость дальнейшего углубленного изучения данной категории заболеваний.
Авторы заявляют, что данная работа, ее тема, предмет и содержание не затрагивают конкурирующих интересов.
Работа выполнена в рамках НИР ДЗМ.Регистрационный номер НИОКТР: 123040700014-4.
A.V. Anisonyan, PhD, E.A. Sokolova, E.S. Sbikina PhD, E.V. Vinnitskaya, PhD, Prof., T.Yu. Khaimenova, PhD, Yu.G. Sandler, PhD, S.G. Khomeriki, PhD, Prof.
A.S. Loginov Moscow Clinical Scientific Center
Contact person: Anastasia V. Anisonyan, Anastasiya7651@yandex.ru
Autoimmune hepatitis (AIH) and primary biliary cholangitis (PBC) are immune-mediated liver diseases with different target cells – hepatocytes and cholangiocytes respectively. Variant syndromes are characterized by a combination of clinical, laboratory, and morphological features of both diseases, which creates significant diagnostic challenges. We present a case of variant syndrome «primary biliary cholangitis with features of autoimmune hepatitis». The diagnostic process spanned over two years from the initial detection of liver biochemistry abnormalities. During this period, ursodeoxycholic acid monotherapy proved insufficient, with disease progression to fibrosis stage F2 documented. Definitive diagnosis required comprehensive immunological and histological evaluation, which confirmed features of both diseases. This case highlights the critical importance of thorough investigation upon detecting liver enzyme abnormalities to determine their underlying etiology. Precise characterization of the pathological process is essential for selecting appropriate treatment. In this patient, establishing the correct diagnosis enabled timely immunosuppressive therapy, resulting in sustained biochemical and histological remission with regression of fibrosis to stage F1.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.