Поражение сердца при митохондриальных заболеваниях: стратегия лечения
- Аннотация
- Статья
- Ссылки
Диагностика митохондриальных заболеваний основывается на комплексной оценке прежде всего клинических и генеалогических данных. Следует обратить внимание на состояние здоровья ближайших родственников, возможное наличие у них отдельных проявлений болезни, что характерно для точковых мутаций митохондриальной ДНК. При анализе клинического фенотипа в пользу митохондриальной природы болезни свидетельствует полиорганное поражение с преимущественным вовлечением нервной, мышечной, эндокринной, сердечно-сосудистой систем. Важным диагностическим маркером служат биохимические показатели: ацидоз, повышение уровня молочной и пировиноградной кислот, гипераммониемия, гипогликемия, умеренное повышение КФК и трансаминаз, повышенная мочевая экскреция ряда органических кислот: 3-метилглутаконовой, 3-метилглутаровой, метилмалоновой, метаболитов цикла Кребса (фумаровой, кетоглутаровой, янтарной), а также дикарбоновых кислот. Однако необходимо иметь в виду, что изменение этих показателей может быть транзиторным.
Морфологическое исследование биоптата мышечной ткани позволяет выявить такой диагностический критерий патологии, как RRF (рваные, или шероховатые красные мышечные волокна). При этом следует учитывать, что феномен RRF встречается не при всех формах и в то же время его можно обнаружить при заболеваниях с вторичной митохондриальной дисфункцией, например, при болезнях соединительной ткани. Безусловно, важным критерием диагностики и условием успешной дородовой диагностики (при мутациях ядерной ДНК) служит идентификация генного дефекта. На основании клинической картины и лабораторных изменений у конкретного пациента необходимо определить ген (гены), подлежащей первоочередному исследованию в молекулярно-генетической лаборатории.
Лечение, как правило, назначается в соответствии с патогенезом патологии, который связан с генетическим дефицитом ферментных комплексов дыхательной цепи, окислительного фосфорилирования, дефектом структурных митохондриальных белков и другими нарушениями. В результате происходит расстройство функционирования всей системы тканевого дыхания, нарушается окислительно-восстановительное состояние клеток, в митохондриях и цитоплазме накапливаются редуцирующие эквиваленты, что в конечном итоге ведет к лактат-ацидозу.
Опыт многих клиницистов свидетельствует, что к настоящему моменту эффективное лечение митохондриальных болезней не разработано. В то же время для облегчения состояния пациентов, улучшения качества жизни назначается комплексная терапия. Основным компонентом лечения служит группа препаратов, стимулирующих перенос электронов в дыхательной цепи. Дополнительно больным назначают витамины группы В (никотинамид, рибофлавин), витамины Е и С, карнитин и др. Сочетанное назначение энерготропных препаратов получило ироничное наименование – «митохондриальный коктейль». В то же время во многих работах подчеркивается крайне низкая эффективность монотерапии.
Среди лекарственных средств – переносчиков электронов особое значение имеют коэнзим Q10 и Цитохром С. Коэнзим Q10 (убихинон) играет важную роль в клеточном дыхании, обеспечивая транспорт электронов от дыхательных комплексов I и II к комплексу III. Его дополнительное введение в организм повышает активность дыхательной цепи митохондрий. Основанием для назначения коэнзима Q10 являются также данные, свидетельствующие о низком содержании убихинона в сыворотке крови и митохондриях скелетных мышц у больных с митохондриальными болезнями в связи с нарушением его эндогенного синтеза и реактивации дефектными митохондриями.
Цитохром С – один из ключевых компонентов дыхательной цепи митохондрий, принимающий участие в переносе электронов от комплекса III к комплексу IV – цитохром С-оксидазе. Цитохром С представляет собой протеин, который синтезируется в цитоплазме, транспортируется в митохондрии и расположен на внутренней митохондриальной мембране в комплексе с фосфолипидами. Цитохромы в качестве простетической группы содержат гем, в состав которого входит атом железа. Переход атома железа из двухвалентного в трехвалентное состояние (восстановленное или окисленное) и обратно обеспечивает акцепцию и передачу электронов. Окисление цитохрома С сопровождается созданием мембранного протонного потенциала, который используется клеткой для синтеза АТФ (окислительное фосфорилирование).
Препарат цитохром С вырабатывается из ткани сердца крупного рогатого скота. В эксперименте на моделях сердечной недостаточности, ишемии миокарда, метаболического ацидоза, острого отравления окисью углерода и др. доказаны выраженное антигипоксическое действие препарата, активация окислительно-восстановительных процессов в тканях. Показано, что препарат быстро всасывается и проникает в клетку.
Под нашим наблюдением находилась большая группа пациентов с разными формами митохондриальной патологии. Среди них следует выделить больных с синдромами Кернса-Сейра, MELAS и Барта. Синдром Кернса-Сейра был диагностирован у 19 детей, 12 пациентам была проведена молекулярно-генетическая диагностика (Медико-генетический центр РАМН), у 10 идентифицирована типичная крупная делеция митохондриальной ДНК, у 2 пациентов в лейкоцитах периферической крови делеция отсутствовала, что не исключает данный диагноз. У всех детей были выявлены прогрессирующие нарушения проводящей системы сердца. Больные получали комплексное энерготропное лечение, в качестве одного из стимуляторов переноса электронов назначался цитохром С в дозе 4 мл в/м № 10 с повторением курса через 3–4 месяца.
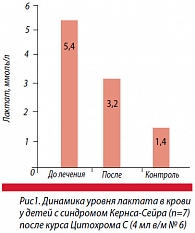
Выше подчеркивалось, что тяжесть митохондриальной патологии вынуждает использовать комплекс энерготропных средств для коррекции нарушенных процессов тканевого дыхания, в связи с чем определить степень эффективности отдельных препаратов сложно. В то же время нам удалось оценить влияние цитохрома С в коротком 6-дневном курсе монотерапии (по 4 мл в/м №6) у 7 детей с синдромом Кернса-Сейра и гиперлактатацидемией. Было продемонстрировано убедительное снижение показателя лактата в крови с 5,4±0,32 до 3,2±0,16 ммоль/л, хотя нормализации уровня достигнуто не было (рис. 1).
Оценка эффективности длительного (в течение 12–14 месяцев) лечения с применением цитохрома С показала заметное улучшение общего состояния и самочувствия больных детей (n=14): уменьшение утомляемости, мышечной слабости, моторной неловкости, стабилизацию состояния сердечно-сосудистой системы, уменьшение содержания лактата в крови c нормализацией уровня более чем в ¼ случаев (у 4 пациентов). Однако при длительном (более 3 лет) катамнестическом наблюдении за 8 больными было выявлено медленное прогрессирование заболевания с нарастанием поражения проводящей системы сердца и сократительной функции миокарда по типу необструктивной симметричной гипертрофической кардиомиопатии. К 17-летнему возрасту у 5 детей постепенно сформировалась атриовентрикулярная блокада, что требовало своевременной установки пейсмейкера для поддержания нормального сердечного ритма.
При обследовании 8 пациентов с синдромом MELAS изменения сердца в виде гипертрофической кардиомиопатии были выявлены в 3 случаях. Степень гипертрофии была умеренной. Тяжесть состояния больных определялась перенесенными инсультоподобными эпизодами, повторными приступами лактат-ацидоза, мигренеподобной головной боли. Длительные курсы энерготропной терапии (коэнзим Q10, цитохром С, аргинин и др.) позволили добиться улучшения самочувствия, снижения частоты и тяжести мигренозных приступов, предупреждения инсультоподобных состояний на протяжении 3-летнего наблюдения.
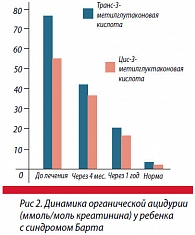
Выраженная эффективность была нами отмечена при лечении ребенка с синдромом Барта. В возрасте 3 лет у мальчика были выявлены низкорослость, миопатический синдром (слабость, гипотония, нарушение походки), необструктивная симметричная гипертрофическая кардиомиопатия (толщина задней стенки левого желудочка – 11 мм, межжелудочковой перегородки – 11,8 мм при норме 5,5 мм), транзиторная нейтропения (количество нейтрофилов 880 в 1 мкл при норме 2300), очень высокая (более чем в 30 раз выше нормы) почечная экскреция 3-метилглутаконовой кислоты. В комплексе лечения ребенка основными препаратами были цитохром С (4 курса в год) и левокарнитин (от 500 до 1000 мг/сут длительно). Благоприятный эффект проявился ликвидацией миопатического синдрома к возрасту 7-8 лет, полной нормализацией эхокардиографических показателей и параметров длины тела к возрасту 9-10 и 12 лет соответственно. Заметно снизилась, но осталась повышенной экскреция 3-метилглутаконовой кислоты. Бессрочное регистрационное удостоверение ЛРС-008117/08 на препарат «Цитохром С, лиофилизат для приготовления раствора для внутривенного и внутримышечного введения 10 мг» получено 14.10.2008 г. (рис. 2).
Заключение
Поражение сердца вносит существенный негативный вклад в состояние пациентов с митохондриальными заболеваниями, в значительной степени определяя уровень летальности и продолжительность жизни. Проблема лечения этих тяжелых заболеваний далека от разрешения. Патогенетическая терапия сердечно-сосудистых нарушений митохондриального происхождения направлена прежде всего на коррекцию тканевого обмена, повышение уровня окислительного фосфорилирования. В комплексе энерготропных препаратов важное место принадлежит препарату Цитохром С – антигипоксическому средству, активатору транспорта электронов в дыхательной цепи. Использование этого препарата способствует стабилизации патологического процесса, а в ряде случаев – и значительному улучшению состояния больных.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.