Вариабельность гликемии и сердечного ритма у пациентов с сахарным диабетом 2 типа
- Аннотация
- Статья
- Ссылки
- English
Цель – изучить параметры кардиоглюкомониторинга у пациентов с СД 2 типа, получавших пероральную сахароснижающую терапию, в зависимости от категории сердечно-сосудистого риска.
Материал и методы. В исследование включали пациентов в возрасте от 35 до 80 лет с СД 2 типа длительностью более года. Всем пациентам проводились электрокардиография, холтеровское мониторирование (ХМ) и непрерывное мониторирование глюкозы.
Результаты. 86 пациентов с СД 2 типа были разделены на две группы в зависимости от наличия или отсутствия атеросклеротических сердечно-сосудистых заболеваний (АССЗ) в анамнезе. Больные различались по возрасту, длительности СД 2 типа, индексу массы тела, уровню гликированного гемоглобина и скорости клубочковой фильтрации. Все пациенты имели нарушения ритма сердца по типу наджелудочковых (НЖЭС) и/или желудочковых (ЖЭС) экстрасистол. Медиана максимальной частоты сердечных сокращений (ЧСС) за 24 часа оказалась ниже у пациентов с АССЗ (группа 2) (p = 0,025). Максимальное количество НЖЭС в час было выше в группе 2 (p = 0,042). Значения индексов вариабельности сердечного ритма (ВСР) были ниже у пациентов с высокой ВГ. Кардиоваскулярная автономная нейропатия диагностирована у 17 (28,8%) пациентов. При этом она сопровождалась повышением ЧСС в покое (p = 0,013), минимальной ЧСС (p = 0,006), а также значений индекса риска гипергликемии (HBGI) (p = 0,017). Шансы развития КАН у пациентов с высокой ВГ были в 3,9 раза выше, чем у лиц с низкой ВГ.
Выводы. Снижение средней и максимальной ЧСС, увеличение максимального количества НЖЭС в час по данным ХМ у пациентов с СД 2 типа и АССЗ, вероятно, связано с возрастом и изменениями в миокарде. У больных СД 2 типа увеличение ВГ приводит к снижению ВСР. Увеличение ЧСС в покое и минимальной ЧСС во время сна может служить маркером наличия КАН у лиц с СД 2 типа.
Цель – изучить параметры кардиоглюкомониторинга у пациентов с СД 2 типа, получавших пероральную сахароснижающую терапию, в зависимости от категории сердечно-сосудистого риска.
Материал и методы. В исследование включали пациентов в возрасте от 35 до 80 лет с СД 2 типа длительностью более года. Всем пациентам проводились электрокардиография, холтеровское мониторирование (ХМ) и непрерывное мониторирование глюкозы.
Результаты. 86 пациентов с СД 2 типа были разделены на две группы в зависимости от наличия или отсутствия атеросклеротических сердечно-сосудистых заболеваний (АССЗ) в анамнезе. Больные различались по возрасту, длительности СД 2 типа, индексу массы тела, уровню гликированного гемоглобина и скорости клубочковой фильтрации. Все пациенты имели нарушения ритма сердца по типу наджелудочковых (НЖЭС) и/или желудочковых (ЖЭС) экстрасистол. Медиана максимальной частоты сердечных сокращений (ЧСС) за 24 часа оказалась ниже у пациентов с АССЗ (группа 2) (p = 0,025). Максимальное количество НЖЭС в час было выше в группе 2 (p = 0,042). Значения индексов вариабельности сердечного ритма (ВСР) были ниже у пациентов с высокой ВГ. Кардиоваскулярная автономная нейропатия диагностирована у 17 (28,8%) пациентов. При этом она сопровождалась повышением ЧСС в покое (p = 0,013), минимальной ЧСС (p = 0,006), а также значений индекса риска гипергликемии (HBGI) (p = 0,017). Шансы развития КАН у пациентов с высокой ВГ были в 3,9 раза выше, чем у лиц с низкой ВГ.
Выводы. Снижение средней и максимальной ЧСС, увеличение максимального количества НЖЭС в час по данным ХМ у пациентов с СД 2 типа и АССЗ, вероятно, связано с возрастом и изменениями в миокарде. У больных СД 2 типа увеличение ВГ приводит к снижению ВСР. Увеличение ЧСС в покое и минимальной ЧСС во время сна может служить маркером наличия КАН у лиц с СД 2 типа.
![Таблица 4. Сравнительный анализ временных индексов ВСР в двух группах, мс (Me [Q1; Q3] и абс. (%))](/upload/resize_cache/iblock/474/195_350_1/Kuzina5.jpg)
![Таблица 5. Анализ индексов ВСР в зависимости от вариабельности гликемии, мс (Me [Q1; Q3])](/upload/resize_cache/iblock/bdc/195_350_1/Kuzina6.jpg)

Введение
На сегодняшний день распространенность сахарного диабета (СД) приобрела характер неинфекционной пандемии, которая охватила все континенты земного шара и все возрастные группы. Согласно данным Всемирной организации здравоохранения (ВОЗ), за последние 30 лет количество больных СД увеличилось в четыре раза [1]. При этом эксперты Международной федерации диабета отмечают, что до 43% случаев СД остаются недиагностированными [2].
В структуре заболеваемости СД более 95% приходится на СД 2 типа. Основной причиной смерти больных СД 2 типа в мире в целом и в Российской Федерации в частности остаются сердечно-сосудистые заболевания (ССЗ).
Кардиоваскулярная автономная нейропатия (КАН) является частым осложнением СД 2 типа и характеризуется нарушением регуляции сердечной деятельности и тонуса сосудов вследствие повреждения нервных волокон вегетативной нервной системы, иннервирующих сердце и кровеносные сосуды [3]. Установлено, что КАН диагностируется у 20% пациентов с СД, 65% из которых подвержены высокому риску прогрессирования заболевания с увеличением возраста и продолжительности СД [4]. Известными факторами риска развития КАН при СД 2 типа являются артериальная гипертензия, дислипидемия, ожирение, курение и неудовлетворительный гликемический контроль. Сочетание этих факторов значительно повышает вероятность возникновения КАН. Многолетние исследования продемонстрировали прогностическую роль возраста, ретинопатии, нефропатии, уровня гликированного гемоглобина (HbA1c), индекса массы тела (ИМТ) и уровня триглицеридов в развитии и прогрессировании КАН при СД 2 типа [5]. Кардиоваскулярная автономная нейропатия также связана с ССЗ, прежде всего с безболевой ишемией миокарда [6]. Результаты исследования DIAD подтвердили связь КАН с сердечно-сосудистой заболеваемостью пациентов с СД 2 типа [7]. Кроме того, КАН является маркером риска сердечно-сосудистой смерти, однако патогенетические механизмы этого до конца не изучены. Предполагается, что определенную роль играют дисбаланс симпатовагальной активности, нарушение симпатической иннервации сердца и коронарных артерий, а также кальцификация коронарных артерий [8].
К клиническим проявлениям КАН относят тахикардию, ортостатическую гипотензию, синдром постуральной тахикардии, снижение переносимости физических нагрузок и немую ишемию миокарда.
В реальной клинической практике прицельная диагностика КАН редка, так как ее симптомы неспецифичны и маскируются сопутствующими заболеваниями, а кардиоваскулярные тесты требуют времени и специального оборудования. Универсального скринингового метода диагностики КАН в настоящее время не существует [9].
Маркерами доклинической стадии КАН служат показатели вариабельности сердечного ритма (ВСР). Индексы ВСР позволяют судить о дисфункции симпатической и парасимпатической иннервации миокарда [10]. Так, у пациентов с сахарным диабетом ВСР снижена, что является индикатором дисфункции автономной регуляции сердечного ритма [11]. Кроме того, получены данные о наличии вегетативной дисфункции миокарда при предиабете. Так, распространенность КАН в этой когорте составляет от 9 до 39% [12].
В последнее время все больше внимания уделяется вариабельности гликемии (ВГ). У пациентов с СД 2 типа она связана с повышенным риском развития сердечно-сосудистых заболеваний, изменениями структуры и функции сердца, ишемическим инсультом, смертью от ССЗ и от других причин, а также c уязвимостью коронарных бляшек [13]. В нескольких исследованиях КАН при СД 2 типа показана ее независимая связь с ВГ [14, 15].
Несмотря на важность гликемического контроля в профилактике ССЗ, в клинической практике непрерывное мониторирование глюкозы (НМГ) при СД 2 типа проводится только пациентам на инсулинотерапии [16], а данные о связи показателей НМГ с показателями холтеровского мониторирования (ХМ) у больных СД 2 типа ограниченны и противоречивы.
Целью настоящего исследования стала оценка параметров кардиоглюкомониторинга у пациентов с СД 2 типа, находившихся на пероральной сахароснижающей терапии, в зависимости от категории сердечно-сосудистого риска.
Материал и методы
Исследование проводилось на клинических базах кафедры эндокринологии ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» Минздрава России (Сеченовский университет) в период с 2021 по 2024 г.
В исследование включали пациентов в возрасте от 35 до 80 лет с СД 2 типа длительностью более года и предшествующей стабильной терапией пероральными сахароснижающими препаратами (ПССП) не менее трех месяцев.
Критериями исключения были острый инфаркт миокарда в течение 12 недель до включения в исследование, острое нарушение мозгового кровообращения в течение 12 недель до включения в исследование, беременность, терапия инсулином на момент включения в исследование, ИМТ более 45 кг/м2, наличие других тяжелых хронических заболеваний.
Для участия в исследовании было отобрано 86 пациентов. Все они прошли общее клиническое обследование с измерением роста, массы тела, систолического артериального давления (САД) и диастолического артериального давления (ДАД). Одновременно всем проводили ХМ в течение 24 часов и НМГ. Датчик НМГ устанавливали как минимум за 24 часа до проведения ХМ и использовали до окончания срока его действия (в течение 14 суток).
Уровень HbA1с определяли на анализаторе Lifotronic H9 (Shenzhen Lifotronic Technology Co., Китай). Биохимические лабораторные исследования проводили на автоматическом анализаторе AU5800 (Beckman Coulter, США).
Для НМГ использовали системы Flash мониторинга FreeStyle Libre (Abbott Diabetes Care Ltd, Соединенное Королевство). Датчик сканировали с помощью сканера или личного смартфона пациента с предварительно установленным приложением LibreLink.
Расчет индексов ВГ осуществлялся с помощью программного обеспечения EasyGV v.8.0. Оценивались индекс риска гипергликемии (HBGI) и средняя амплитуда колебаний гликемии (MAGE). Дополнительно пациенты были разделены на две группы: группу MAGE < 3,9 ммоль/л и группу MAGE ≥ 3,9 ммоль/л [17].
Наличие острых ишемических явлений в миокарде исключали на основании данных медицинских карт (электрокардиография (ЭКГ) в 12 отведениях с оценкой частоты сердечных сокращений (ЧСС), ритма сердца, измерением интервалов PQ, QRS и QT, фиксацией нарушений проводимости ритма, изменений миокарда).
Для ХМ использовали аппарат «Миокард-Холтер». Протокол обследования включал установку электродов и запись электрокардиограммы в течение 24 часов. Все пациенты во время исследования вели дневник, в котором отмечали период сна и бодрствования, физическую активность, прием пищи и самочувствие. По результатам исследования врачом функциональной диагностики с помощью программного обеспечения «Миокард-Холтер» (версия 8.67 DV от 31.08.2021) формировалось заключение с описанием ритма, минимальной (во время сна), максимальной (во время физических нагрузок) и средней ЧСС, нарушений желудочковой проводимости, наджелудочковой эктопической активности (наджелудочковых экстрасистол (НЖЭС)), желудочковой эктопической активности (желудочковых экстрасистол (ЖЭС)) и вариабельности ритма. Вариабельность сердечного ритма оценивалась по временным индексам: стандартному отклонению от среднего значения длительностей всех NN-интервалов (SDNN), стандартному отклонению средних значений RR-интервалов за все 5-минутные фрагменты (SDANN), стандартному отклонению усредненных за 5 минут значений интервалов RR (SDNNi), среднеквадратичной разнице соседних RR (rMSSD), проценту соседних интервалов, различающихся более 50 мс (PNN50). Наличие КАН устанавливали при снижении не менее двух параметров временной области ниже нижнего референса, установленного программой: SDNN < 103 мс, SDNNi < 39 мс, SDANN < 92 мс, rMSSD < 15 мс, или при сочетании снижения одного параметра временной области и ЧСС более 100 в минуту по данным ЭКГ [18].
Исследование проводилось в соответствии с Хельсинкской декларацией 2013 г. Все участники исследования предоставили письменное информированное согласие на участие в нем.
Статистический анализ проводился с использованием программы IBM SPSS Statistics v.26 (IBM Corporation). Количественные показатели на предмет соответствия нормальному распределению оценивали с помощью критерия Шапиро – Уилка (при количестве исследуемых менее 50) или критерия Колмогорова – Смирнова (при количестве исследуемых более 50), а также с помощью показателей асимметрии и эксцесса. При сравнении средних величин в нормально распределенных совокупностях количественных данных рассчитывали t-критерий Стьюдента. В отсутствие признаков нормального распределения данных для сравнения независимых совокупностей применяли U-критерий Манна – Уитни. Номинальные данные сравнивали с помощью критерия χ2 Пирсона. Для установления связи между количественными параметрами, распределение которых отличалось от нормального, рассчитывали коэффициент ранговой корреляции Спирмена.
Результаты
Характеристика пациентов
В исследование включены 86 пациентов с СД 2 типа длительностью более одного года, получавшие ПССП. Из них 33 – женщины, 53 – мужчины. Диагноз СД 2 типа устанавливали в соответствии с рекомендациями ВОЗ 1999–2013 гг. и на основании медицинской документации. Медиана длительности СД 2 типа составила восемь лет.
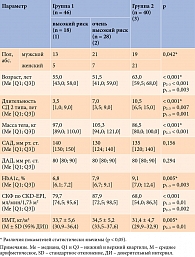
Участники исследования были разделены на группы в зависимости от наличия или отсутствия в анамнезе атеросклеротических сердечно-сосудистых заболеваний (АССЗ) и хронической сердечной недостаточности (ХСН) (табл. 1). Группу 1 составили пациенты с СД 2 типа без АССЗ и ХСН, группу 2 – пациенты с СД 2 типа и АССЗ с или без ХСН.
В группе 1 были выделены две подгруппы – высокого и очень высокого сердечно-сосудистого риска. К первым были отнесены пациенты без поражения органов-мишеней с длительностью СД 2 типа ≥ 10 лет или без поражения органов-мишеней с одним или двумя основными факторами сердечно-сосудистого риска, а именно возраст ≥ 50 лет, артериальная гипертензия, дислипидемия, курение, ожирение. Подгруппу очень высокого сердечно-сосудистого риска составили пациенты с поражением органов-мишеней (протеинурия, скорость клубочковой фильтрации (СКФ) < 45 мл/мин/1,73 м2, СКФ 45–59 мл/мин/1,73 м2 в сочетании с микроальбуминурией, гипертрофия левого желудочка или ретинопатия) или с двумя и более основными факторами сердечно-сосудистого риска либо пациенты с длительностью СД 2 типа более 20 лет.
В группе 2 АССЗ были представлены цереброваскулярной болезнью (37,5%), ишемической болезнью сердца (50,0%), стенозирующим атеросклерозом магистральных артерий головы и шеи (27,5%), атеросклерозом артерий нижних конечностей (5,0%), ХСН (45,0%).
Пациенты получали либо метформин, либо комбинацию метформина с производными сульфонилмочевины, ассоциированными с низким гипогликемическим риском, ингибиторами натрий-глюкозного котранспортера 2, ингибиторами дипептидилпептидазы 4. Статистически значимых различий в отношении получаемой сахароснижающей терапии в группах выявлено не было.
Анализ данных кардиоглюкомониторинга
Кардиоглюкомониторинг проводился в выборке из 59 человек. В отношении приема β-адреноблокаторов, а также гипотензивной терапии статистически значимых различий между группами не установлено.
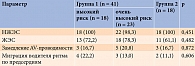
Все пациенты имели нарушения ритма сердца по типу НЖЭС и/или ЖЭС. При анализе данных ХМ статистически значимой разницы в частоте НЖЭС, ЖЭС, эпизодов замедления атриовентрикулярной проводимости (AV-проводимости) и миграции водителя ритма по предсердиям в группах не зафиксировано (табл. 2).
У пациентов группы 2 медиана максимальной ЧСС за 24 часа была ниже, чем у пациентов группы 1 подгруппы высокого сердечно-сосудистого риска. С помощью апостериорного критерия Шеффе установлено статистически значимое снижение средней ЧСС за сутки у пациентов группы 2 по сравнению с пациентами группы 1 подгруппы высокого риска. Максимальное количество НЖЭС в час у пациентов с АССЗ оказалось статистически значимо выше, чем у пациентов без АССЗ с очень высоким сердечно-сосудистым риском (табл. 3).
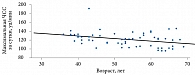
При проведении корреляционного анализа у всех пациентов выявлены прямая связь между максимальной ЧСС и уровнем HbA1c (r = 0,441, p < 0,001), а также СКФ (r = 0,363, p = 0,005) и обратная связь между максимальной ЧСС и возрастом (r = -0,343, p = 0,008) (рис. 1). Между средней ЧСС и возрастом пациентов прослеживалась обратная связь (r = -0,27, p = 0,039).
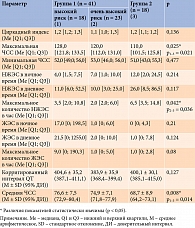
Анализ ВСР показал, что медиана индекса SDANN во всех группах была ниже нормальных значений, статистически значимых различий в группах не выявлено. Другие временные параметры ВСР в группах также статистически значимо не различались (табл. 4).
При проведении сравнительного анализа индексов ВСР в зависимости от индекса MAGE были обнаружены достоверные различия. Так, значения индексов ВСР были ниже у пациентов с высокой ВГ (табл. 5).
Согласно результатам анализа временных параметров ВСР и ЧСС в покое по данным ЭКГ, у 17 (28,8%) пациентов установлена КАН. Статистически значимых различий в частоте выявления КАН в группах выявлено не было.
У пациентов с диагностированной КАН отмечено статистически значимое повышение ЧСС в покое по данным ЭКГ и минимальной ЧСС по данным ХМ. Значения максимальной и средней ЧСС достоверно не различались в группах (табл. 6).
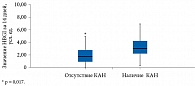
У пациентов с КАН выявлено статистически значимое повышение значений HBGI (p = 0,017) (рис. 2).
Обсуждение
Поиск скринингового метода диагностики КАН остается актуальной проблемой.
Одним из клинических проявлений КАН является тахикардия в состоянии покоя. В предшествующих работах данные ХМ сравнивали у пациентов с СД 2 типа и лиц без нарушений углеводного обмена, при этом оценивалась ЧСС в покое [19]. Исследований среди пациентов с СД 2 типа в зависимости от степени сердечно-сосудистого риска, а также от максимальной ЧСС во время физической нагрузки ранее не проводилось.
У всех пациентов, включенных в наше исследование, диагноз КАН, согласно данным медицинской документации, отсутствовал. Кардиоваскулярная автономная нейропатия была диагностирована в ходе проведения исследования. В зависимости от категории сердечно-сосудистого риска различий в частоте встречаемости КАН не обнаружено. Однако при детальном изучении выявлено достоверное снижение средней и максимальной ЧСС у пациентов группы 2 по сравнению с пациентами группы 1 подгруппы высокого сердечно-сосудистого риска.
Следует отметить, что в ранее проведенных исследованиях чаще наблюдалось увеличение ЧСС при СД 2 типа, что было связано с более высокими уровнями HbA1c и более низкой СКФ. В нашем исследовании у пациентов группы 2 имели место более продолжительный стаж СД, более высокие уровни HbA1c, более низкая СКФ по сравнению с пациентами группы 1. В группе 2 на ЧСС, по-видимому, в большей степени оказывал влияние возраст. Кроме того, на среднюю и максимальную ЧСС в данной группе непосредственно влияли АССЗ. С учетом того что при СД 2 типа нередко диагностируется брадикардия и возникает необходимость в установке кардиостимулятора, снижение средней и максимальной ЧСС у пациентов с СД 2 типа и АССЗ может быть неблагоприятным прогностическим фактором [20].
Кардиоваскулярная автономная нейропатия является фактором риска развития аритмий и неблагоприятных сердечно-сосудистых исходов. Так, установлена связь между тяжестью КАН и количеством желудочковых аритмий, особенно в ночное время [21]. В нашем исследовании показано, что практически у всех пациентов независимо от категории сердечно-сосудистого риска по результатам ХМ имели место НЖЭС. Максимальное количество НЖЭС в час достоверно чаще (медиана – 6,5) наблюдалось в группе 2. Возможно, данный параметр может также служить фактором риска неблагоприятного исхода, однако для подтверждения этого требуется проведение дополнительных исследований на большей выборке пациентов.
Имеющиеся данные свидетельствуют о связи ВГ со сниженной ВСР при СД [11, 22]. В предыдущих работах была показана зависимость частотных характеристик ВСР от ВГ, ВСР оценивали по данным амбулаторного гликемического профиля без использования индексов ВГ [23, 24]. В нашем исследовании у всех пациентов значения индекса SDANN оказались ниже референсных значений, что свидетельствует о преобладании парасимпатического тонуса вегетативной нервной системы. Кроме того, у лиц с высокой ВГ, определенной по индексу MAGE, наблюдалось уменьшение ВСР исходя из показателей временных индексов SDNNi, rMSSD и PNN50.
В ходе анализа параметров в зависимости от наличия или отсутствия КАН нами выявлены более высокие значения ЧСС в покое при проведении ЭКГ, минимальной ЧСС при проведении ХМ у пациентов с КАН. Нами также обнаружена зависимость КАН от индекса риска гипергликемии по результатам НМГ. При этом зависимости КАН от уровня HbA1с не обнаружено. Известно, что гипергликемия связана с развитием ишемии и атрофии вегетативных нервных волокон, иннервирующих сердечную и сосудистую ткани [25]. Поэтому оценка углеводного обмена с помощью НМГ в отличие от определения уровня HbA1с дает более детальное представление о ВГ и трендах, включая риски гипо- и гипергликемии, с возможностью выделения групп риска по развитию КАН.
Заключение
Полученные нами результаты свидетельствуют о том, что у больных СД 2 типа с АССЗ в анамнезе наблюдается снижение средней и максимальной ЧСС, а также увеличение максимального количества НЖЭС в час по данным ХМ, что, вероятно, связано с возрастом и изменениями в миокарде вследствие АССЗ. Данные параметры могут служить маркерами недиагностированных АССЗ у пациентов с СД 2 типа.
Увеличение вариабельности гликемии приводит к снижению ВСР у лиц с СД 2 типа, а КАН сопровождается увеличением ЧСС в покое и минимальной ЧСС во время сна. Потенциально это может служить маркером КАН. Зависимость КАН от индекса риска гипергликемии по данным НМГ диктует необходимость более широкого применения данного метода самоконтроля гликемии у пациентов с СД 2 типа.
I.A. Kuzina, K.I. Valeeva, T.M. Gazashvili, N.A. Petunina, Corresponding member of the RASci., PhD, Prof.
I.M. Sechenov First Moscow State Medical University
L.A. Vorokhobov City Clinical Hospital No. 67, Moscow
Contact person: Irina A. Kuzina, mia986@mail.ru
Cardiovascular autonomic neuropathy (CAN) and glycemic variability (GV) are associated with a high risk of cardiovascular mortality in type 2 diabetes mellitus (T2DM).
Objective – to investigate cardioglucomonitoring parameters in patients with type 2 diabetes on oral antidiabetic drugs, depending on the cardiovascular risk category.
Material and methods. The study included patients adults aged 18 to 65 years with a history of T2DM at least one-year were included. All participants underwent electrocardiography, Holter monitoring (HM) and continuous glucose monitoring.
Results. 86 participants with type 2 diabetes were divided into 2 groups depending on presence or absence of atherosclerotic cardiovascular disease (ASCVD) in the anamnesis. Patients differed in age, history of T2DM, body mass index, glycated hemoglobin level, and glomerular filtration rate. All patients had heart rhythm disorders such as supraventricular (SVEC) and/or ventricular (VEC) extrasystoles. The median maximum heart rating (HR) over 24 hours was lower in group 2 (p = 0.025). The maximum number of SVEC per hour was higher in group 2 (p = 0.042). Heart rate variability (HRV) indices were lower in patients with high glycemic variability. CAN was diagnosed in 17 (28.8%) patients and was associated with an increase in resting heart rate (p = 0.013), minimum heart rate (p = 0.006), and an increase in the high blood glucose index (HBGI) (p = 0.017). The odds of developing CAN in patients with high GV were 3,9 times higher than in those with low GV.
Conclusions. Mean and maximum HR decreasing and the maximum number of SVEC per hour increasing measured by HM in patients with type 2 diabetes and ASCVD, are likely related to age and myocardial changes. GV increasing leads to HRV decreasing in patients with T2DM. An increase in resting HR and minimum HR during sleep may serve as diagnostic markers of CAN in T2DM.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.