Постменопаузальный остеопороз: современные возможности лечения и профилактики переломов
- Аннотация
- Статья
- Ссылки

Во всем мире остеопороз все сильнее привлекает внимание врачей. С одной стороны, это обусловлено широкой распространенностью заболевания, его отрицательным влиянием на качество и продолжительность жизни людей, с другой – увеличением выявляемости остеопороза. Актуальность проблемы остеопороза в современной медицине вызвана, прежде всего, социальными и экономическими последствиями остеопоротических переломов [1, 2, 3].
Большую часть людей, подверженных остеопорозу, составляют женщины. Известно, что в первые пять лет после наступления менопаузы потеря костной массы может составить до трети от общей массы кости, утраченной за всю жизнь [4, 5]. В постменопаузе почти у трети женщин отмечается остеопороз, а у около 54% – остеопения, что предопределяет их уязвимость в плане развития остеопороза и остеопоротических переломов [6, 7]. Постменопаузальный остеопороз представляет собой наиболее распространенную форму заболевания – его доля в структуре первичного остеопороза равняется 85%. После менопаузы усиливаются процессы резорбции кости. Необходимо отметить, что в развитии постменопаузального остеопороза наиболее важную роль играют следующие факторы: костная масса ко времени начала менопаузы и последующая скорость потери костного вещества.
В основе функционирования костной системы лежат два тесно взаимосвязанных процесса: образование новой и разрушение старой кости – костное ремоделирование. На протяжении всей жизни этот процесс осуществляется с различной скоростью, меняется и направленность ремоделирования кости. Ежегодно перестраивается от 2–4 до 10% костной массы, иными словами, за 10–20 лет обновляется примерно половина скелета. Примерно до 35–40 лет поддерживается нулевой баланс. Возраст, в котором начинается потеря костной массы, точно не определен. Принято считать, что потери костной массы начинаются с конца третьего десятилетия жизни, их скорость зависит от пола и возраста. У мужчин они составляют 0,3–0,5% в год. У женщин процесс снижения плотности костной массы более сложен: до начала периода климактерия костная масса ежегодно снижается на 0,7–1,3%, а после наступления менопаузы ее потери достигают 2–3% в год.
У женщин в период менопаузы активируется полный цикл ремоделирования кости, при этом процессы резорбции преобладают над процессами костеобразования. Хотя возрастная потеря костной массы, составляющая в среднем 1% от уровня пика костной ткани, начинается уже в репродуктивном периоде, наибольшей выраженности процесс достигает, как правило, спустя 5–10 лет после наступления менопаузы. При этом костные потери могут достигать до 5% ежегодно [8]. В итоге масса кости снижается примерно на 25–30% и резко повышается риск атравматических переломов под влиянием минимальных нагрузок.
В патогенезе постменопаузального остеопороза пусковым фактором является дефицит эстрогенов, вызывающий ускорение потери костной массы. Однако, несмотря на то что все женщины в менопаузе имеют эстрогеновую недостаточность, недуг развивается только у каждой третьей из них. Это свидетельствует о влиянии различных факторов, включая генетические, на возникновение и развитие остеопороза. Кроме прочего, при остеопорозе нет характерных, в том числе ранних, клинических проявлений. В этой связи своевременный учет факторов риска в диагностике заболевания имеет особое значение. Факторами риска развития постменопаузального остеопороза являются пожилой возраст, злоупотребление алкоголем, кофеином, курение, семейный анамнез заболевания, указания на предшествующие малотравматичные переломы, низкий индекс массы тела (ИМТ) (менее 20 кг/м²), ранняя менопауза (до 45 лет), аменорея (более года) в репродуктивном возрасте, овариэктомия в молодом возрасте, иммобилизация. Среди заболеваний, увеличивающих риск развития остеопороза, следует в первую очередь отметить сахарный диабет, гиперпаратиреоз, тиреотоксикоз, синдром гиперкортицизма, ревматоидный артрит, заболевания ЖКТ, хронические заболевания почек. Длительный прием глюкокортикоидов (3 и более месяцев), психотропных препаратов также способствует риску развития остеопороза.
В любом возрасте, включая период постменопаузы, на фоне возрастного дефицита эстрогенов наиболее выраженные изменения происходят в трабекулярной (губчатой) кости, в основном представленной в телах позвонков, плоских костях, в костях предплечья и в пяточных костях. Так, например, масса трабекулярной кости позвонков снижается в год на 5%, а кортикального слоя – на 1,5%. Переломы тел позвонков, возникающие, как правило, раньше остеопоротических переломов любой другой локализации, являются наиболее частым осложнением заболевания, составляя около половины всех переломов [9]. Клинические проявления позвоночных переломов, включающие синдром острой или хронической боли в спине, нарушения осанки и снижение роста, ведут к депрессии, ухудшению качества жизни и инвалидности [2, 10].
Остеопороз – это основная причина переломов шейки бедра, часто встречающихся у женщин старше 65 лет. Печально, что в наши дни наметилась четкая тенденция к увеличению частоты переломов шейки бедра и в возрастной группе 50–60 лет. Риск переломов данной локализации у женщин достигает 15%, что приближается к уровню заболеваемости раком молочной железы, яичников и эндометрия, вместе взятых [3, 5, 7]. Лечение переломов проксимального отдела бедра считается экономически наиболее затратным, так как, среди прочего, требуется госпитализация. По данным ВОЗ, именно переломы проксимального отдела бедренной кости ставят остеопороз на четвертое место среди всех причин инвалидности и смертности [1].
К сожалению, поздняя диагностика и несвоевременное начало фармакотерапии остеопороза характерны для 75% женщин и 90% мужчин [5]. Согласно данным Национального комитета качества здравоохранения США, в стране более 90% взрослых с сердечно-сосудистыми заболеваниями получают β-блокаторы и только 19% взрослых с частыми переломами лечатся от остеопороза [11]. Приоритетной задачей практической медицины является не только своевременная диагностика, но и адекватное лечение остеопороза и его осложнений, имеющих порой фатальный характер, – остеопоротических переломов [1, 3, 6, 7]. Бесспорно, что рано начатое лечение может существенно повлиять на прогрессирование и исходы заболевания. Разрешению этой задачи, несомненно, способствует более широкое информирование о проблеме остеопороза как врачей различных специальностей, так и населения в целом.
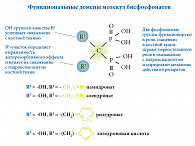
В настоящее время существуют эффективные программы лечения заболевания, включающие сочетание нефармакологических методов с современными противоостеопоротическими препаратами. Бисфосфонаты (БФ), представляя собой стабильные аналоги природных неорганических фосфатов, широко применяются в терапии постменопаузального остеопороза как препараты первой линии и позволяют проводить патогенетическую терапию заболевания, поскольку они наиболее выраженно ингибируют костную резорбцию [4, 6, 12]. История применения БФ насчитывает не один десяток лет. Этот класс лекарственных препаратов характеризуется следующей химической структурой: заменой атома кислорода в молекуле пирофосфата на атом углерода (Р-С-Р), в боковых цепях присутствуют два радикала: R1 – ОН-группа, увеличивающая физико-химическое связывание БФ с гидроксиапатитом, и R2 – группа, определяющая биологическое действие препаратов на костные клетки [13] (рис. 1). Селективное действие БФ на костную ткань, прежде всего, связано с высоким сродством к кристаллам гидроксиапатита кости, что определяет их способность откладываться в местах образования новой кости. БФ сохраняются в местах нового костеобразования до тех пор, пока не произойдет замена старой кости на новую [13, 14, 15].
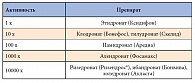
Основным фармакологическим эффектом БФ является снижение костного ремоделирования с более выраженным угнетением костной резорбции, нежели чем костеобразования, а также снижение частоты активации новых очагов ремоделирования [13, 16]. Вместе с тем БФ уменьшают или предупреждают отрицательное влияние на кость практически всех известных стимуляторов резорбции [13, 14]. Проникая в костную ткань и создавая высокую концентрацию в лакунах резорбции, БФ концентрируются вокруг остеокластов. В пределах этих клеток БФ вызывают много изменений, которые в итоге снижают способность остеокластов к резорбции костной ткани (например, потеря щеточной каймы, разрушение цитоскелета, неспособность остеокластов к передвижению или связыванию с костной тканью) [13, 15, 17]. Однако, несмотря на то что используемые в настоящее время препараты данной группы являются химически сходными, их механизмы действия различны. Антирезорбтивная активность отдельных БФ существенно варьирует, что связано с особенностями химической структуры препарата (табл.).
Первое поколение БФ – этидронат, клодронат и тилудронат, не содержащие в своей структуре атомов азота, метаболизируются остеокластами внутриклеточно до цитотоксичных аналогов аденозин трифосфата. В свою очередь, азотсодержащие БФ блокируют синтез фарнезилдифосфата синтазы. Тем самым снижается образование мевалоната – вещества, необходимого для поддержания нормальной цитоархитектоники и жизнедеятельности остеокластов [14, 15]. Азотсодержащие БФ являются более сильными ингибиторами остеокластической активности и остеолизиса по сравнению с препаратами, не содержащими в своей структуре азота [16, 17]. Структурные отличия в азотсодержащей цепочке БФ также влияют на их эффективность в отношении ингибирования костной резорбции (рис. 2). Присутствие атома азота в боковой цепи объясняет особый механизм действия азотсодержащих БФ, связанный со способностью ингибировать процесс модификации белков в остеокластах, что ведет к апоптозу зрелых клеток и подтверждается появлением специфических изменений в клетке и структуре ядра [17, 18]. Одновременно отмечается потеря клетками-предшественниками остеокластов способности дифференцировки и созревания, что приводит к уменьшению числа остеокластов. Тем не менее некоторые детали механизма их действия остаются не до конца изученными.
Остеобласты также являются потенциальными мишенями для БФ [18]. Данные in vitro свидетельствуют, что под воздействием БФ остеобласты снижают секрецию остеокласт-стимулирующего фактора [13, 15]. Препараты обладают и рядом анаболических эффектов, поскольку блокируют апоптоз остеобластов и остеоцитов, даже индуцированных глюкокортикоидами, а также стимулируют образование новой кости [13, 17].
До настоящего времени при остеопорозе на практике в основном использовались этидронат и алендронат, как наиболее изученные препараты. В 2010 г. в России появился пока единственный препарат ризедроновой кислоты – Ризендрос®. Ризендрос® относится к азотсодержащим БФ и используется в терапии постменопаузального остеопороза перорально по 35 мг 1 раз в неделю [19, 20].
Клиническая эффективность ризедроната (Ризендрос®) была подтверждена данными ряда многоцентровых исследований по изучению влияния препарата на минеральную плотность костной ткани (МПК) и качество кости, на риск развития новых переломов и переносимость препарата [8, 19, 20, 21, 22, 23].
Одним из важных результатов исследований эффективности ризедроната [9, 10] с практических позиций явилось доказательство того, что препарат способен снижать риск переломов в течение первого года терапии. Так, применение ризедроната позволило уменьшить риск перелома позвонков на 66% уже через 6 месяцев терапии по сравнению с контрольной группой [9].
Важно отметить положительное влияние ризедроната на механическую прочность кости. Длительное применение препарата, как и других БФ, сопровождается положительными изменениями костной микроархитектоники и увеличением толщины трабекул [4]. Так, исследование B. Borah и соавт. (2005) с использованием трехмерной микрокомпьютерной томографии в течение года костных биоптатов показало, что ризедронат сохраняет трабекулярную архитектонику кости у женщин в ранней постменопаузе [19]. Интересные результаты получены и в исследовании D. Mellstrom и соавт., которое продемонстрировало, что через 6–7 лет лечения ризедронатом МПК поясничных позвонков продолжала увеличиваться и частота остеопоротических переломов оставалась стабильной [24]. В метаанализе G. Wells и соавт., который включал 14 049 пациенток с постменопаузальным остеопорозом, было продемонстрировано, что ризедронат эффективен при вторичной профилактике переломов позвонков, периферических переломов, включая переломы бедра [25].
Терапия остеопороза, являющегося тяжелым хроническим заболеванием, должна проводиться в течение длительного времени (около 3–5 лет), а в случае тяжелого остеопороза у пациентов с переломами – не менее 5 лет [12, 26]. Согласно результатам исследования D. Mellstrom и соавт., долгосрочное лечение ризедронатом у женщин с постменопаузальным остеопорозом является безопасным и не сопровождается повышенным риском побочных явлений при приеме препарата в дозировках, принятых для лечения заболевания [24]. Еженедельный прием 35 мг ризедроната хорошо переносится и сейчас является стандартом схемы применения. К числу побочных эффектов, прежде всего, относятся нарушения со стороны желудочно-кишечного тракта (6–30% случаев): тошнота, рвота, диспепсические явления, абдоминальные боли, изъязвления слизистой оболочки пищевода и желудка [6, 7]. В этом плане интересно, что в сравнительном исследовании, касающемся безопасности различных БФ (ризедронат и алендронат), показано снижение случаев язвы желудка на 69% при использовании ризедроната [17]. Для уменьшения риска раздражающего действия на слизистую оболочку пищевода не следует разжевывать или рассасывать таблетку; также не следует принимать лежачее положение, по крайней мере, на протяжении получаса после приема препарата. Риск побочных явлений со стороны ЖКТ повышается при одновременном назначении ризедроната с нестероидными противовоспалительными препаратами. Поскольку препараты этой группы проникают через плаценту и могут отрицательно влиять на плод, их не следует применять во время беременности.
В практическом плане важно, что по результатам клинических исследований не выявлено каких-либо различий в эффективности или безопасности ризедроната в зависимости от возраста пациента [4, 19, 20, 21]. Иначе говоря, корректировать дозу препарата у пациентов пожилого возраста не требуется. Кроме того, коррекцию дозы не нужно проводить у пациентов с почечной недостаточностью легкой или средней степени тяжести. Следует иметь в виду, что при одновременном приеме пищи и напитков (включая минеральную воду), препаратов кальция, антацидов и некоторых других препаратов для перорального приема может снижаться всасывание ризедроновой кислоты. Именно поэтому между приемом препарата Ризендрос® и любых других пероральных препаратов или пищи пациенты должны соблюдать, по крайней мере, получасовой интервал. Ризедроновая кислота не влияет на активность ферментов цитохрома Р450 и слабо связывается с белками крови. Следует учитывать, что длительная терапия БФ эффективна при дополнительном приеме солей кальция (1–1,5 г в сутки) и 500 МЕ витамина D [6, 12].
В заключение следует отметить, что в настоящее время признана главенствующая роль бисфосфонатов в практике лечения постменопаузального остеопороза и профилактики его осложнений. Применение ризедроната (Ризендрос®) соответствует решению основной цели лечения остеопороза – снижению риска остеопоротических переломов различных локализаций.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.