Предикторы преждевременного разрыва плодных оболочек при поздних преждевременных спонтанных родах
- Аннотация
- Статья
- Ссылки
- English
Материал и методы. В исследование включено 100 женщин, поступивших для родоразрешения в родильное отделение № 1 ГБУЗ «Городская клиническая больница им. А.К. Ерамишанцева Департамента здравоохранения Москвы». В первую (основную) группу вошли 50 пациенток с преждевременным разрывом плодных оболочек на сроке 34–36,6 недели. Во вторую (контрольную) − 50 женщин с преждевременным разрывом плодных оболочек на сроке 37–41,6 недели.
Результаты. Истмико-цервикальная недостаточность и дисплазия соединительной ткани, преждевременные роды в анамнезе, железодефицитная анемия, инфекции мочевыводящих путей, бессимптомная бактериурия и рецидивирующий бактериальный вагиноз во время беременности, курение, наличие двух и более абортов и инструментальных вмешательств в полость матки в анамнезе, индекс массы тела выше нормы до беременности и повышенное содержание лейкоцитов в микроскопическом исследовании первого триместра беременности в цервикальном канале и влагалище являются наиболее значимыми предикторами преждевременного разрыва плодных оболочек при поздних преждевременных спонтанных родах.
Заключение. Профилактика, прогнозирование и своевременная диагностика перечисленных предикторов преждевременного разрыва плодных оболочек и поздних преждевременных спонтанных родов позволяют улучшить перинатальные и акушерские исходы беременности и родов.
Материал и методы. В исследование включено 100 женщин, поступивших для родоразрешения в родильное отделение № 1 ГБУЗ «Городская клиническая больница им. А.К. Ерамишанцева Департамента здравоохранения Москвы». В первую (основную) группу вошли 50 пациенток с преждевременным разрывом плодных оболочек на сроке 34–36,6 недели. Во вторую (контрольную) − 50 женщин с преждевременным разрывом плодных оболочек на сроке 37–41,6 недели.
Результаты. Истмико-цервикальная недостаточность и дисплазия соединительной ткани, преждевременные роды в анамнезе, железодефицитная анемия, инфекции мочевыводящих путей, бессимптомная бактериурия и рецидивирующий бактериальный вагиноз во время беременности, курение, наличие двух и более абортов и инструментальных вмешательств в полость матки в анамнезе, индекс массы тела выше нормы до беременности и повышенное содержание лейкоцитов в микроскопическом исследовании первого триместра беременности в цервикальном канале и влагалище являются наиболее значимыми предикторами преждевременного разрыва плодных оболочек при поздних преждевременных спонтанных родах.
Заключение. Профилактика, прогнозирование и своевременная диагностика перечисленных предикторов преждевременного разрыва плодных оболочек и поздних преждевременных спонтанных родов позволяют улучшить перинатальные и акушерские исходы беременности и родов.

Введение
Преждевременные роды (ПР) являются медицинской и социальной проблемой, представляют особый интерес для исследователей и практикующих специалистов и не утрачивают актуальности ввиду отсутствия на протяжении последних 50 лет тенденции к снижению частоты [1].
Обращаясь к протоколам Американской ассоциации гинекологов (ACOG, 2021) [2] и последним рекомендациям Всемирной организации здравоохранения (2015) [3], нельзя не заметить, что пристальное внимание при угрожающем преждевременном родоразрешении уделяется улучшению качества оказания помощи беременным до срока 34 недели. Вероятно, это обусловлено тем, что выживаемость доношенных детей отличается в большую сторону от таковой у поздних недоношенных новорожденных (ПНН) (рожденные на гестационном сроке 34–36,6 недели) не более чем на 1% [3]. Несмотря на практически абсолютную идентичность с доношенными новорожденными по клиническим и антропометрическим параметрам, ПНН имеют более высокие показатели заболеваемости и смертности как в раннем неонатальном периоде, так и в долгосрочной перспективе [4].
Поздние преждевременные роды (ППР) (34–36,6 недели) составляют примерно 70–75% всех ПР [5].
Согласно современной классификации, ПР подразделяют на индуцированные и самопроизвольные [6]. При этом большинство ППР являются самопроизвольными (60%) и возникают либо при целом плодном пузыре в связи с развитием регулярной родовой деятельности (35%), либо из-за преждевременного разрыва плодных оболочек (ПРПО) с последующим развитием спонтанной родовой деятельности (25%) [7].
Преждевременное излитие околоплодных вод – одна из наиболее значимых проблем в акушерстве и перинатологии, которая приводит к осложненному течению беременности, родов и послеродового периода и крайне неблагоприятно влияет на организм женщины, состояние плода и дальнейшее развитие заболеваемости у новорожденного [8].
Причины ПРПО многочисленны и разнообразны, однако вопросы этиопатогенеза данного акушерского осложнения до сих пор остаются малоизученными и контраверсионными. Одним из основных этиологических факторов считается инфицирование [9, 10]. По мнению ряда авторов, в настоящее время причиной прерывания беременности на сроке 34–36,6 недели у 67,7% женщин становится персистенция условно-патогенной микрофлоры в эндометрии вне беременности [11]. Тем не менее в ряде исследований опровергается ведущая роль инфекционного фактора в возникновении ППР [12, 13]. Немаловажную роль играет биоценоз влагалища, когда ПРПО рассматривается как проявление вирусных и бактериальных инфекций, сохраняющихся во время беременности [14]. По мнению ряда авторов, при доношенной беременности ПРПО обусловлен тем, что между предлежащей частью плода и входом в малый таз не образуется пояс соприкосновения и не происходит разделения околоплодных вод на передние и задние. Как следствие, сначала происходит растяжение плодных оболочек, а затем их разрыв [15].
Цель – выявить предикторы преждевременного разрыва плодных оболочек при поздних преждевременных спонтанных родах.
Материал и методы
Выполнено аналитическое обсервационное исследование по типу «случай – контроль». В него было включено 100 женщин, поступивших для родоразрешения в родильное отделение № 1 ГБУЗ «Городская клиническая больница им. А.К. Ерамишанцева Департамента здравоохранения Москвы» в период 2022–2024 гг.
В зависимости от гестационного срока на момент родоразрешения женщины были распределены на две группы. Первую (основную) группу составили 50 пациенток с преждевременным разрывом плодных оболочек на сроке 34–36,6 недели, вторую (контрольную) − 50 женщин с преждевременным разрывом плодных оболочек на сроке 37–41,6 недели.
Критерии включения пациенток в основную группу:
- поздние преждевременные роды (на сроке 34–36,6 недели);
- преждевременное излитие околоплодных вод с последующим самопроизвольным развитием родовой деятельности.
Критерии включения в контрольную группу:
- срочные роды (на сроке 37–41,6 недели);
- преждевременное излитие околоплодных вод с последующим самопроизвольным развитием родовой деятельности.
Критерии исключения:
- преждевременные роды на сроке 22–33,6 недели;
- своевременное или раннее излитие околоплодных вод;
- беременность, наступившая в результате использования вспомогательных репродуктивных технологий;
- мертворождение;
- преэклампсия;
- гестационный сахарный диабет;
- индуцированные роды по медицинским показаниям со стороны матери и/или плода;
- состояние беременной и/или плода, требующее родоразрешения с помощью операции кесарева сечения до начала спонтанной родовой деятельности (тяжелая преэклампсия, эклампсия, отказ женщины от родов через естественные родовые пути, дистресс-синдром плода);
- аномалии развития плода, несовместимые с жизнью;
- декомпенсация хронических экстрагенитальных заболеваний.
Исследование было проведено путем выкопировки данных из историй родов. Кроме того, был выполнен сбор сведений о течении и осложнениях настоящей беременности из обменной карты/индивидуальной карты беременной (формы № 113/у-20 и 096/у).
Статистический анализ проводился с использованием программ Jamovi (v. 1.2.27), StatTech v. 4.1.7.
На предмет соответствия нормальному распределению все количественные показатели оценивались на основании критерия Шапиро – Уилка. При нормальном распределении они описывались с помощью средних арифметических величин (M) и стандартных отклонений (SD), границ 95%-ного доверительного интервала (ДИ). В отсутствие нормального распределения количественные данные описывались с помощью медианы (Me) и квартилей (Q1–Q3).
Сравнение двух групп по количественному показателю, имеющему нормальное распределение, при условии равенства дисперсий выполнялось с использованием t-критерия Стьюдента. При сравнении двух групп по количественному показателю, распределение которого отличалось от нормального, применялся U-критерий Манна – Уитни.
Для категориальных данных учитывались абсолютные значения и процентные доли.
Процентные доли сравнивали исходя из критерия хи-квадрат Пирсона (при значениях ожидаемого явления более 10), точного критерия Фишера (при значениях ожидаемого явления менее 10). Различия считались статистически значимыми при p < 0,05.
Результаты
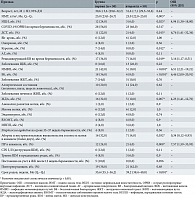
Предикторы ПРПО представлены в табл. 1.
Пациентки обеих групп были сопоставимы по возрасту: средний возраст в первой группе составил 30,6 ± 5,6 года, во второй – 31,6 ± 7,1 года (р = 0,44).
У женщин основной группы средний индекс массы тела (ИМТ) оказался выше аналогичного показателя в контрольной группе и был статистически значим (р = 0,003). Вместе с тем удельный вес ожирения в обеих группах не превышал 8,0% (р = 0,36).
Только у женщин основной группы встречался такой фактор риска, как курение, который был статистически значимым (р = 0,012).
Частота встречаемости беременных с отрицательным резус-фактором была полностью сопоставима в обеих группах (по 12%; р = 1,00).
У пациенток с ППР и пациенток с родоразрешением на доношенном сроке беременности обнаружено идентичное количество случаев аномалий развития матки (р = 0,9) и миомы матки (р = 1,00). Эндометриоз различной локализации выявлен у пациенток обеих групп со статистически незначимым преобладанием в первой группе (р = 0,74).
По сравнению со второй группой в первой в структуре экстрагенитальных заболеваний достоверно чаще преобладали железодефицитная анемия (ЖДА), дисплазия соединительной ткани (ДСТ), артериальная гипертензия, заболевания желудочно-кишечного тракта, печени и желчевыводящих путей, но статистически значимы были только показатели ЖДА (р = 0,007) и ДСТ (р = 0,015). Аллергические состояния и заболевания щитовидной железы, напротив, чаще регистрировались во второй группе (своевременные роды). Статистически значимых различий между группами по этим критериям не зафиксировано (p > 0,05).
Истмико-цервикальная недостаточность (ИЦН) диагностирована у 12 (24,0%) беременных основной группы, что оказалось статистически значимо выше (в четыре раза) по сравнению с контрольной группой (р = 0,023). Напротив, такие факторы риска ПРПО, как деструкция шейки матки (ШМ) в анамнезе по поводу CIN I или CIN II (р = 0,11) и травма ШМ в предыдущих родах с ее последующей хирургической коррекцией (р = 0,9), статистически значимыми не были. Однако случаи деструкции ШМ в анамнезе по поводу дисплазии в основной группе выявлялись достоверно чаще, чем в контрольной, – 12 и 2,0% соответственно.
В группе ППР, очевидно, средний гестационный срок на момент родоразрешения был ниже аналогичного показателя в контрольной группе и статистически значим (р < 0,001).
Как показал анализ данных, одним из самых значимых факторов риска ПРПО при последующей беременности, особенно в сочетании с ПР, являются ППР в анамнезе (р = 0,008).
Необходимо отметить, что повторнородящие достоверно чаще встречались в контрольной группе, но без статистически значимых различий между группами (р = 0,68).
Интересно, что на учет в женскую консультацию после 12 недель беременности вставали лишь женщины основной группы. По этому признаку статистически значимых различий между группами не выявлено (р = 0,056).
Анализ инфекционного фактора риска продемонстрировал, что частота абортов и инструментальных вмешательств в полость матки в анамнезе (более двух) (р = 0,032), инфекций мочевыводящих путей (ИМВП) (р < 0,001), бессимптомной бактериурии (ББ) (р < 0,001) и рецидивирующего бактериального вагиноза (БВ) во время беременности (р = 0,019) в основной группе оказалась статистически значимо выше, чем в контрольной. COVID-19 и/или острые респираторные вирусные инфекции диагностированы во время беременности у 28 (56%) пациенток первой и 23 (46%) пациенток второй групп в отсутствие статистически значимых различий между группами. Положительные результаты посева на Streptococcus agalactiae на сроке 35–37 недель гестации статистически незначимо преобладали в основной группе (в четыре раза; р = 0,36). Напротив, в контрольной группе выявлено статистически незначимо больше (в 1,5 раза) инфекций, передаваемых половым путем (р = 1,0). В обеих группах обнаружено равное количество случаев воспалительных заболеваний органов малого таза (статистически незначимо; р = 0,9).
В таблице 2 представлено количественное содержание лейкоцитов в микроскопическом исследовании в первом триместре беременности в цервикальном канале (ЦК) и влагалище. Интересно, что количество лейкоцитов как в ЦК, так и во влагалище статистически значимо преобладало в основной группе (в 4,5 и 4,08 раза соответственно) (р < 0,001).
Обсуждение
Настоящее исследование подтвердило мировые данные [16, 17] о том, что шанс ПРПО выше на более ранних сроках беременности, чем на доношенном сроке. При этом в случае недоношенной беременности ПРПО чаще возникает у женщин с преждевременными родами в анамнезе.
D. Lin и соавт. (2024) провели крупное исследование с участием 18 174 пациенток [18]. Согласно полученным данным, при недоношенной беременности в анамнезе риск ПРПО значительно (в 7,8 раза) превышает таковой у женщин без аналогичного осложнения в предыдущих родах [18].
Социально-экономическое положение женщины и наличие вредных привычек во время беременности играют важную роль в развитии ПРПО. По данным T. Nagaria и соавт. (2022), курение во время беременности является предиктором ПРПО при недоношенной беременности. Кроме того, курение – один из факторов риска задержки внутриутробного развития плода, аномалий его развития, маловодия и кровотечения в послеродовом периоде [19].
В нашем исследовании установлено, что риск ПРПО при ППР повышается в семь раз, если женщина курит во время беременности. Вероятно, патогенез обусловлен вазоконстрикцией, вызванной никотином. Вазоконстрикция возникает в результате кадмиевого нарушения кальциевой сигнализации, измененной продукции стероидных гормонов, воздействия на сосуды монооксида углерода, нарушения синтеза простагландинов и измененных реакций на окситоцин [20].
В нашем исследовании более высокий средний ИМТ (25 кг/м2) выявлен в основной группе. Мнения разных авторов по данному критерию расходятся. Например, А.А. Гирис и соавт. (2023) выяснили, что избыточная масса тела, ожирение и патологическая прибавка массы тела во время беременности (ИМТ ≥ 28,5 кг/м2) повышают риск ПР и ПРПО [21]. В исследовании R. Hu и соавт. (2022), наоборот, сниженный ИМТ до беременности (≤ 22 кг/м2) чаще коррелировал с возникновением такого акушерского осложнения, как ПРПО [22].
Известно, что ЖДА является одним из часто встречаемых соматических заболеваний, тесно связанных с ПР и ПРПО [23–25]. Так, в нашем исследовании частота ЖДА в основной группе в 3,2 раза превышала таковую в контрольной группе.
Согласно данным отечественных и зарубежных исследований [26–28], а также клиническому федеральному протоколу [6], рецидивирующий БВ, ИМВП и ББ во время беременности являются неоспоримыми факторами риска как спонтанных ППР, так и ПРПО в сочетании с ПР. В соответствии с результатами нашего исследования, ИМВП при недоношенной беременности повышают риск ПРПО в 4,2 раза (отношение шансов (ОШ) 6,51; 95% ДИ 2,21–19,21), ББ – в 4,5 раза (ОШ 6,46; 95% ДИ 2,00–20,91) и рецидивирующего БВ во время беременности – в 2,4 раза (ОШ 3,16; 95% ДИ 1,17–8,51). Несмотря на это, в настоящее время отсутствуют убедительные данные, подтверждающие эффективность скрининговых программ в отношении указанных факторов риска [29–31]. Кроме того, не разработан единый алгоритм лечебных мероприятий и усугубляется проблема, связанная с антибиотикорезистентностью [32, 33].
Количественное содержание лейкоцитов в микроскопическом исследовании в первом триместре беременности в ЦК и влагалище, вероятно, является неспецифическим инфекционным фактором риска ПРПО. Наше исследование продемонстрировало, что средний показатель лейкоцитов в ЦК у пациенток основной группы составил 18 клеток в поле зрения, во влагалище – 24,5 клетки в поле зрения. При этом в контрольной группе данные показатели оказались намного ниже – 4 и 6 клеток в поле зрения соответственно.
В.Ф. Долгушина и соавт. (2024) изучали иммунологические предикторы ПР у женщин с ИЦН и установили, что среднее количество лейкоцитов и нейтрофильных внеклеточных ловушек, лизосомальная активность нейтрофилов, уровни макрофагального 1-бета- и BOX1-белка группы протеинов высокой мобильности в цервикальной слизи статистически значимо выше, чем в группе сравнения (срочные роды и ИЦН) и контрольной группе (нормальная беременность без ИЦН) [34].
ИЦН способствует инфицированию нижнего полюса плодного пузыря, что является одним из наиболее распространенных механизмов возникновения ПРПО при недоношенной беременности [35]. Согласно полученным нами данным, ИЦН в четыре раза повышает риск ПРПО при ППР.
К.Р. Бахтияров и соавт. (2024) выдвинули предположение, что изменения в цервиковагинальном микробиоме коррелируют с ПРПО, ИЦН и ПР в равных пропорциях [36]. В настоящем исследовании мы выявили значительное преобладание (в 5,5 раза) пациенток с ДСТ в группе ППР. По данным многих авторов, ИЦН – одно из клинических проявлений недифференцированной ДСТ [37, 38], поэтому последняя косвенно может выступать в качестве фактора риска ПРПО при ППР.
Немаловажным фактором риска ПРПО, исходя из результатов нашего исследования, являются аборты и инструментальные вмешательства в полость матки в анамнезе, что подтверждается многими исследователями. M. Enjamo и соавт. (2022) установили, что у 31,2% женщин с двумя хирургическими абортами и более в анамнезе роды осложняются ПРПО. Интересно, что среди женщин с одним вмешательством в полость матки по поводу прерывания беременности в анамнезе процент ПРПО значительно выше (68%) [39].
Заключение
Природа преждевременного разрыва плодных оболочек при поздних преждевременных родах многогранна и полиэтиологична. Инфекционные, экстрагенитальные и социально-экономические предикторы в сочетании с отягощенным акушерско-гинекологическим анамнезом создают всевозможные предпосылки для досрочного родоразрешения.
Итак, истмико-цервикальная недостаточность и дисплазия соединительной ткани, инфекции мочевыводящих путей, бессимптомная бактериурия и рецидивирующий бактериальный вагиноз во время беременности, преждевременные роды в анамнезе, железодефицитная анемия, курение, наличие двух и более абортов и инструментальных вмешательств в полость матки в анамнезе, индекс массы тела выше нормы до беременности и увеличенное содержание лейкоцитов в микроскопическом исследовании первого триместра беременности в цервикальном канале и влагалище являются наиболее значимыми клинико-анамнестическими факторами риска преждевременного разрыва плодных оболочек при поздних преждевременных спонтанных родах.
На текущий момент представления об этиологии и патогенезе ПРПО не имеют единой концепции, до сих пор отсутствуют надежные современные методы его прогнозирования и профилактики. В свою очередь это способствует увеличению частоты возникновения как перинатальных, так и акушерских осложнений.
Таким образом, выявление клинико-анамнестических факторов риска преждевременного разрыва плодных оболочек при поздних преждевременных спонтанных родах считается важной задачей современной медицины для определения алгоритма своевременного диагностического поиска и лечебных мероприятий, направленных на улучшение исходов беременности и родов.
Финансирование. Авторы заявляют об отсутствии спонсорской поддержки.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
S.V. Apresyan, PhD, Prof., Z.V. Zyukina, Ye.V. Loginova, PhD, L.B. Kushkhatueva, A.R. Gabrielyan, PhD
Patrice Lumumba Peoples’ Friendship University of Russia
A.K. Eramishantsev City Clinical Hospital, Moscow
Contact person: Zoya V. Zyukina, zoya.zukina@yandex.ru
The aim – to identify predictors of premature rupture of the fetal membranes in late preterm spontaneous labor.
Material and methods. The study involved 100 women who were admitted to the maternity ward № 1 of A.K. Eramishantsev City Clinical Hospital for delivery. Group I (main group) included 50 women with premature rupture of the fetal membranes at 34–36,6 weeks of pregnancy, and group II (control group) consisted of 50 women with premature rupture of the fetal membranes at 37–41,6 weeks.
Results. The most significant predictors of premature rupture of the fetal membranes in late preterm spontaneous labor are: cervical insufficiency, connective tissue dysplasia, a history of previous preterm birth, iron deficiency anemia, urinary tract infections, asymptomatic bacteriuria, recurrent bacterial vaginosis during pregnancy, smoking, two or more previous abortions, instrumental interventions in the uterus cavity in the history, a body mass index higher than normal before pregnancy, and an increased number of white blood cells in microscopic examination of the cervical canal and vagina during the first trimester.
Conclusion. Prevention, prediction, and timely diagnosis of predictors for premature rupture of the fetal membranes and late spontaneous preterm labor will improve neonatal and obstetric outcomes of pregnancy and delivery.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.