Преимущества мультипробиотического комплекса Бак-Сет в коррекции микроэкологических нарушений при острых кишечных инфекциях у детей
- Аннотация
- Статья
- Ссылки
- English

Острые кишечные инфекции (ОКИ) продолжают занимать ведущее место в инфекционной патологии у детей, уступая лишь острым респираторным заболеваниям и гриппу. По данным Всемирной организации здравоохранения, в мире ОКИ ежегодно болеют свыше 1 млрд человек, из которых 65–70% дети в возрасте до пяти лет [1].
В этиологической структуре инфекционной диареи в последние годы все большее значение приобретают вирусы, в частности рота- и норовирусы [2, 3]. Среди бактериальных возбудителей одну из лидирующих позиций занимают сальмонеллы, эшерихии, представители условно патогенной микрофлоры [4].
Практически у всех детей с инфекционной диареей изменяется состав кишечной микробиоты (снижение индигенной и избыточный рост условно патогенной флоры), что существенно влияет на клиническую симптоматику, тяжесть заболевания, длительность элиминации возбудителей. Нерациональное использование антибактериальных препаратов при кишечной инфекции усугубляет дисбиотические нарушения, способствует формированию синдрома мальабсорбции, манифестации пищевой аллергии, затяжному течению ОКИ, возникновению рецидивов и реинфекции [5].
К средствам, предназначенным для коррекции качественных и количественных нарушений состава кишечной микрофлоры у детей на фоне инфекционной диареи, относятся пробиотики. Это непатогенные для человека бактерии, характеризующиеся антагонистической активностью в отношении патогенных и условно патогенных бактерий и обеспечивающие восстановление нормальной микрофлоры [6].
Для создания пробиотических препаратов используют преимущественно живые культуры представителей микробиоты кишечника человека (лакто- и бифидобактерии, непатогенные эшерихии, молочнокислые стрептококки, непатогенные энтерококки) (см. таблицу). Кроме того, пробиотической функцией обладают микробные антагонисты, не вегетирующие в организме человека в естественных условиях, но оказывающие благоприятный эффект на микроэкологический статус при пероральном способе применения (непатогенные бациллы и дрожжевые грибки) [7, 8].
Пробиотические культуры, входящие в состав препаратов, должны обладать:
- кислотоустойчивостью и резистентностью к действию желчных кислот и панкреатических ферментов;
- совместимостью с индигенной флорой;
- высокой адгезией к кишечному эпителию;
- способностью к оптимальному размножению и сохранению длительной жизнеспособности в кишечнике;
- низкой степенью транслокации через кишечный барьер;
- доказанной эффективностью и безопасностью;
- стабильностью при хранении [9].
В зависимости от количества включенных в препарат штаммов микроорганизмов и их сочетаний различают:
- монокомпонентные пробиотики – содержат один вид бактерий – постоянных представителей кишечной флоры (лакто-, бифидо- или колисодержащие);
- поликомпонентные пробиотики – состоят из нескольких разновидностей бактерий, максимально приближенных по составу к естественному микробиоценозу кишечника для достижения комплексного эффекта;
- комбинированные пробиотики – дополнительно включен пребиотический компонент – неперевариваемые в кишечнике ингредиенты различного происхождения (олигосахариды, растительные волокна, витамины, аминокислоты и др.), что позволяет стимулировать рост аутохтонной микрофлоры и повышать выживаемость пробиотиков;
- самоэлиминирующиеся антагонисты – транзиторные микроорганизмы (Saccharomyces boulardii, Bacillus subtilis, B. cereus), характеризующиеся антагонистической активностью в отношении патогенной и условно патогенной микрофлоры [10].
К несомненным преимуществам поликомпонентных пробиотиков относятся совокупность полезных свойств, присущих отдельным штаммам микроорганизмов, и, как следствие, повышение биологической активности препарата. Кроме того, появляется возможность избирательного заселения кишечника ребенка наиболее адекватными для микробиоценоза видами бактерий.
В настоящее время особое внимание уделяют специфичности действия отдельных штаммов пробиотических микроорганизмов и возможности их использования при конкретных патологических состояниях. Так, при выборе препарата для лечения кишечной инфекции прежде всего следует обращать внимание на выраженность антибактериальной функции входящих в его состав пробиотических культур:
- продукцию биологических субстанций, оказывающих антибактериальный эффект в отношении патогенной и условно патогенной кишечной микрофлоры (органические кислоты, бактериоцины, Н2О2);
- способность конкурировать с патогенной и условно патогенной микрофлорой за рецепторы связывания и питательный субстрат;
- стимулирование иммунокомпетентных клеток и фагоцитарной активности слизистой оболочки кишечника.
Согласно рекомендациям по применению пробиотиков, разработанным группой ученых Йельского университета (США) и основанным на принципах доказательной медицины, наивысшим уровнем доказательности А при лечении инфекционной диареи у детей обладают штаммы Lactobacillus rhamnosus (GG), L. reuteri, L. casei, S. boulardii [11]. Именно эти четыре штамма вошли в Протокол ведения детей с гастроэнтеритом, утвержденный Европейским обществом детских гастроэнтерологов, гепатологов и нутрициологов (European Society for Paediatric Gastroenterology Hepatology and Nutrition – ESPGHAN) совместно c Европейским обществом детских инфекционных болезней (European Society for Paediatric Infectious Diseases – ESPID) в 2014 г. [12].
Кроме того, в многочисленных исследованиях показано, что Streptococcus thermophilus и L. bulgaricus улучшают перевариваемость лактозы [13]. Поэтому наличие этих культур в составе пробиотических препаратов особенно важно в терапии кишечной инфекции вирусной этиологии, когда дисахаридазная недостаточность является ключевым звеном в патогенезе диареи.
В 2014 г. на российском фармацевтическом рынке появился новый мультипробиотический комплекс Бак-Сет, изготовленный на основе оригинальных штаммов микроорганизмов, включенных в перечень европейского качества. Результаты исследования кислотоустойчивости пробиотических штаммов Бак-Сет при pH = 2 в течение двух часов подтвердили их высокую жизнеспособность. К преимуществам препарата относятся также гарантия жизнеспособности и заявленного количества бактерий до конца срока годности, отсутствие в составе лактозы, ароматизаторов и генетически модифицированного организма. Препарат не требует хранения в холодильнике.
С учетом возрастных особенностей состава кишечной микробиоты пробиотический комплекс выпускают в двух сбалансированных формах – Бак-Сет Беби и Бак-Сет Форте. Бак-Сет Беби содержит семь штаммов микроорганизмов – L. casei, L. rhamnosus, L. acidophilus, Bifidobacterium breve, B. infantis, B. longum, S. thermophilus, а также наиболее оптимальный для пищеварения детей раннего возраста пребиотик (фруктоолигосахариды из инулина), усиливающий действие пробиотических бактерий. Разрешен к применению у детей с рождения.
В состав Бак-Сет Форте входит 14 видов живых пробиотических бактерий в высоких концентрациях – L. casei, L. plantarum, L. rhamnosus, B. bifidum, B. breve, B. longum, L. acidophilus, L. lactis, S. thermophilus, B. infantis, L. bulgaricus, L. helveticus, L. salivarius, L. fermentum, что позволяет им достигать толстого кишечника без потери активности и жизнеспособности.
Цель настоящего клинического наблюдения – оценить эффективность и безопасность мультипробиотического комплекса Бак-Сет в терапии ОКИ у детей.
Материал и методы
В открытом сравнительном проспективном клиническом наблюдении приняли участие 83 ребенка с ОКИ в возрасте от одного месяца до 14 лет. Дети первого года жизни составили 36,1%, дети в возрасте от года до трех лет – 26,5%, от трех до семи лет – 20,5%, от семи до 14 лет – 16,9%. В большинстве случаев ОКИ протекала по типу энтерита или гастроэнтерита (58%). Реже отмечались энтероколит (24%), колит (12%), гастроэнтероколит (6%).
Этиологический диагноз подтверждали на основании клинико-эпидемиологических данных и результатов бактериологического и серологического исследований, иммуноферментного анализа (диагностика на обнаружение генома бактерий или вирусов), исследования кала на дисбактериоз.
Критерии включения в исследование:
- первые-вторые сутки заболевания;
- отсутствие терапии до начала наблюдения;
- способность пациента/родителей адекватно оценивать состояние и выраженность клинических симптомов.
- Критерии исключения:
- развитие осложнений;
- непереносимость препарата;
- отказ пациента или родителей от дальнейшего участия в наблюдении.
Совокупность исследований позволила верифицировать этиологическую природу ОКИ у 66,3% пациентов, в том числе у 20,0% – сальмонеллез, у 7,3% – шигеллез Зонне и Флекснера, у 20,0% – кампилобактериоз, у 36,4% – ротавирусную инфекцию, у 16,3% – ОКИ, вызванную норовирусом. У 33,7% больных этиологию ОКИ установить не удалось.
Участники исследования были рандомизированы на две группы, однородные по половозрастным характеристикам (средний возраст в основной группе составил 8,4 ± 3,1 года, в контрольной – 8,6 ± 3,6 года), исходным клиническим проявлениям, что допускало проведение сравнительной оценки результатов наблюдения и определения достоверности результатов. Размер выборки был достаточным для формулирования выводов.
Все больные ОКИ принимали этиотропные (антибактериальные, противовирусные), патогенетические и симптоматические средства. 40 пациентов первой группы дополнительно к стандартной терапии получали мультипробиотик Бак-Сет: дети до трех лет – по одному саше один раз в сутки, старше трех лет – по одной капсуле один раз в сутки в течение десяти дней. 43 пациента второй группы в составе комплексной терапии получали монопробиотик Лактобактерин: дети до шести месяцев – три дозы два раза в сутки, от шести месяцев до года – три дозы три раза в сутки, от года до трех лет – пять доз два раза в сутки, старше трех лет – пять доз три раза в сутки в течение десяти дней.
Эффективность и безопасность терапии оценивали по динамике клинических симптомов (нормализация температуры тела, прекращение рвоты и диареи, восстановление аппетита) при ежедневном осмотре до выздоровления, длительности бактерио- и вирусовыделения, определению уровней фекального кальпротектина (ФК) и С-реактивного белка в сыворотке крови, показателям копроцитограммы и дисбактериоза.
На протяжении всего периода наблюдения проводился мониторинг нежелательных явлений, при возникновении которых применение препарата могло быть прекращено.
Статистическая обработка результатов проведена с помощью пакетов программы Microsoft Excel 2010. Для параметрических переменных определяли среднее значение показателя по группе пациентов (М), стандартного отклонения (s). Различие средних величин считалось достоверным при уровне значимости p < 0,05, соответствующем достоверной вероятности ≥ 0,95.
Результаты и их обсуждение
У 72,3% пациентов заболевание протекало преимущественно в среднетяжелой форме, у 27,7% – в легкой. Преморбидный фон в 15,6% случаев был отягощен экссудативно-катаральным диатезом, аллергодерматозом. У шести детей отмечалась поливалентная сенсибилизация к антибиотикам и сульфаниламидам, у пяти – стойкая молочница.
Начальными проявлениями ОКИ более чем у половины детей было повышение температуры от 37,1 до 38 0С, у 25 (30,1%) пациентов – от 38,1 до 39 0С, у восьми (9,6%) – выше 39,1 0С.
У всех больных имели место признаки поражения желудочно-кишечного тракта. Рвота отмечалась у 68 (81,9%) детей: у 25 (36,8%) – от одного до трех раз в сутки, у 43 (63,2%) – от четырех до десяти раз в сутки. Нелокализованные абдоминальные боли наблюдались у половины больных, локализованные в левой подвздошной области – у 7,3%, явления метеоризма – у 46 (55,4%) детей. Одновременно или через несколько часов после рвоты возникала диарея – от пяти до 12 раз в сутки. У 31,3% детей визуально определялись патологические примеси в стуле (слизь, зелень).
У 50 (72,3%) пациентов зафиксированы умеренные симптомы интоксикации (беспокойство, слабость, вялость, снижение аппетита и др.). Развитие токсикоза с эксикозом 1-й степени выявлено у 39 (47,0%) больных, 2-й степени – у 44 (53,0%).
При ОКИ вирусной этиологии (52,8% детей) во всех случаях имели место катаральные явления со стороны верхних дыхательных путей в виде фарингита и/или ринита, которые в большинстве случаев возникали с первого-второго дня заболевания, а у 1/3 пациентов предшествовали развитию кишечных расстройств.
В остром периоде заболевания у 52,8% детей в гемограмме отмечались лейкопения с лимфоцитозом, у 47,2% – лейкоцитоз, нейтрофилез с палочкоядерным сдвигом, повышенная скорость оседания эритроцитов.
У пациентов с вирусной диареей зафиксировано умеренное повышение ФК от 50 до 100 мкг/г. При бактериальной диарее повышение этого показателя было более значительным – от 100 до 550 мкг/г. То есть референсные значения превышены более чем в десять раз.
Нами получено статистически значимое увеличение показателей С-реактивного белка при кишечной инфекции бактериальной этиологии (до 50 мг/л – при норме до 5 мг/л), что обусловлено воспалением кишечной стенки. При вирусной диарее показатели С-реактивного белка составили от 5 до 20 мг/л.
У всех больных копроцитограмма показала наличие жирных кислот, нейтрального жира, крахмала, перевариваемой клетчатки, йодофильной флоры. Это свидетельствовало о недостаточном всасывании в тонкой кишке и дисбиотических нарушениях. У 26 (31,3%) детей наряду с признаками нарушения переваривания и всасывания в копроцитограмме определялись лейкоциты и эритроциты, покрывающие поле зрения.
При изучении количественного и качественного состава микрофлоры кишечника у больных ОКИ установлено, что до начала лечения у 81,9% пациентов имели место дисбиотические изменения в микрофлоре кишечника. Отмечалось снижение количества бифидобактерий до 106–104 КОЕ/г вплоть до их полного отсутствия в экскрементах у восьми (11,8%) больных, лактобактерий – менее 106 КОЕ/г у 55,9%, энтерококков – у 51,5% детей. Количество Escherichia coli превышало их нормальное содержание в кале (106–107 КОЕ/г) у 60,3% больных, в том числе лактозонегативных у 12 (29,3%), гемолитических у восьми (20,5%) детей. Установлено резкое угнетение кокковой микрофлоры. Молочнокислые стрептококки в начале наблюдения не обнаруживались в кишечнике у 35 (42,2%) детей. У 46 (55,4%) больных их содержание не превышало 103 КОЕ/г.
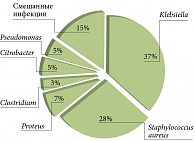
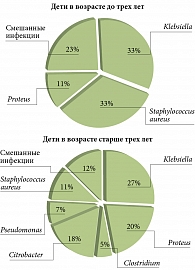
У 38 (45,8%) пациентов в высоких концентрациях (108–1010 КОЕ/г) высевались представители условно патогенной микрофлоры: наиболее часто выявлялись клебсиеллы, золотистый стафилококк, протей, энтеробактер (рис. 1). При этом различий в структуре условно патогенной микрофлоры в зависимости от бактериальной или вирусной этиологии ОКИ не наблюдалось. Тем не менее у детей в возрасте до трех лет золотистый стафилококк определялся в три раза чаще, чем у детей старшего возраста (рис. 2).
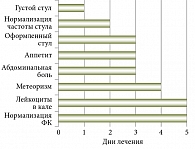
Проведенное клиническое наблюдение показало, что у пациентов, получавших Бак-Сет, уже через сутки от начала лечения улучшалась консистенция стула. К третьему дню терапии отмечалась нормализация частоты и характера стула, к третьему-четвертому дню купировались диспепсические проявления. К пятому дню в копроцитограмме уменьшались признаки нарушения переваривания и всасывания, показатели ФК приходили в норму (рис. 3).
При анализе клинических данных установлено, что в основной и контрольной группах средняя продолжительность болевого синдрома составила 1,71 ± 0,11 и 2,21 ± 0,09 дня, явлений метеоризма – 2,51 ± 0,13 и 3,28 ± 0,11 дня, диарейного синдрома – 4,21 ± 0,23 и 6,35 ± 0,31 дня соответственно. Уже к третьему дню лечения у 80,0% детей, получавших Бак-Сет, появился аппетит. В группе Лактобактерина аналогичный показатель составил 46,5%. Различия в средней продолжительности лихорадки и рвоты оказались статистически недостоверными.
К пятому дню лечения у больных первой группы исчезла молочница, уменьшились аллергические проявления, нормализовались показатели ФК и С-реактивного белка, улучшились показатели гемограммы. Во второй группе за аналогичный период положительная динамика названных показателей зафиксирована лишь у 24 (55,8%) детей.
В копроцитограмме на фоне приема препарата Бак-Сет уменьшались признаки нарушения переваривания и всасывания (исчезали зерна крахмала, мышечные волокна и нейтральный жир) у 36 (90,0%) детей. В группе Лактобактерина таких детей насчитывалось 22 (51,2%).
После лечения у детей первой группы наблюдались положительные сдвиги в состоянии микробиоценоза кишечника. Нормальная концентрация бифидобактерий отмечалась у 32 (80,0%), лактобактерий – у 34 (85,0%) пациентов. Среднее содержание молочнокислых стрептококков, выделенных из кишечника у 100% детей, увеличилось более чем в три раза. Количество полноценной кишечной палочки возросло, количество гемолизирующих, неподвижных и лактозонегативных бактерий снизилось у 36 (90,0%) детей. В полтора раза реже высевались условно патогенные микроорганизмы (S. aureus, Klebsiella pneumoniae, K. oxytoca, Proteus mirabilis, P. vulgaris, Citrobacter freundii).
Ни в одном случае на фоне применения препарата Бак-Сет не зарегистрировано нежелательных явлений.
В то же время у всех детей второй группы дисбиотические изменения в микрофлоре кишечника прогрессировали. Это проявлялось прежде всего в дальнейшем снижении бифидобактерий (максимальный титр составил 105 КОЕ/г). Зафиксированы последующее уменьшение плотности колонизации кишечника молочнокислыми стрептококками (максимальный титр – 103 КОЕ/г), увеличение количества гемолитических и лактозонегативных вариантов в общей популяции колифлоры. У 35 (81,4%) детей высевались условно патогенные микроорганизмы (S. aureus, P. mirabilis, P. vulgaris, P. rettgeri, K. pneumoniae, K. oxytoca, C. freundii, Enterobacter cloacae), уровень которых в полтора-два раза превышал допустимые концентрации. У 12 (27,9%) пациентов одновременно высевалось несколько возбудителей. Между тем количество детей с нормальными показателями лактофлоры увеличилось в полтора раза.
Заключение
Развитие ОКИ у детей проявляется резким угнетением всех трех наиболее значимых аутохтонных представителей микробиоты кишечника – бифидо- и лактобактерий, молочнокислых стрептококков.
Полученные данные продемонстрировали высокую эффективность и высокий профиль безопасности мультипробиотического комплекса Бак-Сет. В группе пациентов, получавших Бак-Сет, средняя продолжительность диарейного синдрома была на 2,14 дня меньше, чем в группе сравнения. К третьему дню терапии аппетит восстановился у 80% детей основной группы и у 46,5% контрольной группы. Что касалось состояния микробиоценоза кишечника, в основной группе положительная динамика в виде нормализации количества бифидобактерий наблюдалась у 80,0%, лактобактерий – у 85,0%, снижения количества гемолизирующих, неподвижных и лактозонегативных бактерий – у 90,0% детей.
Высокая пробиотическая активность препарата Бак-Сет в сочетании с хорошей переносимостью и удобством применения предопределяет выбор препарата для коррекции микроэкологических нарушений при инфекционной диарее у детей разного возраста.
Результаты данной работы позволяют рекомендовать мультипробиотик Бак-Сет для включения в комплексное лечение ОКИ у детей с целью интенсификации этиотропной терапии и улучшения микробиоценоза кишечника.
Включение в терапию детей с инфекционной диареей комплекса Бак-Сет позволяет сократить сроки выздоровления и снизить эпидемиологические риски по распространению возбудителей кишечных инфекций в организованных детских коллективах.
M.D. Subbotina, T.M. Chernova
Saint-Petersburg State Pediatric Medical University
Contact person: Tatyana Maratovna Chernova, t-chernova@mail.ru
In the article results of comparative clinical research of efficacy and safety of multi-strain Bac-Set probiotic in the treatment of infectious diarrhea in children is presented. It was estimated that in patients treated with Bac-Set there were significantly shortening of duration of dyspeptic and diarrheal syndromes, recovery of activity of obligate colonic microflora was observed much earlier. At the 5-th day from the start of treatment normalization of fecal calprotectin, CRP and hemogram’s parameters was registered in 92.5% of patients in tested group. In the comparison group over the same period a positive trend was recorded in 55.8% of children only. The tested product was well-tolerated and no side effects were registered.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.