Преимущества таргетной терапии при остеопорозе
- Аннотация
- Статья
- Ссылки
- English
Деносумаб – моноклональное человеческое антитело к лиганду рецептора ядерного фактора каппа бета (RANKL) – первый таргетный препарат для лечения остеопороза. Деносумаб действует подобно молекуле остеопротегерина (OPG) в системе RANKL – RANK – OPG, уменьшая образование остеокластов, и обладает мощным антирезорбтивным эффектом.
Деносумаб эффективен в предупреждении низкотравматичных переломов тел позвонков, бедра и внепозвоночных переломов у женщин с постменопаузальным остеопорозом. Кроме того, по сравнению с бисфосфонатами (БФ) деносумаб позволяет добиться большего увеличения минеральной плотности кости (МПК) во всех отделах скелета. Циркулируя в крови и межклеточной жидкости, моноклональное антитело проникает во все участки скелета, в том числе кортикальную кость. Его распределение не зависит от активности костного ремоделирования. Если после двух- или трехлетнего использования БФ МПК бедренной кости стабилизируется и не увеличивается, то на фоне применения деносумаба она стабильно повышается до достижения целевых значений.
Деносумаб – моноклональное человеческое антитело к лиганду рецептора ядерного фактора каппа бета (RANKL) – первый таргетный препарат для лечения остеопороза. Деносумаб действует подобно молекуле остеопротегерина (OPG) в системе RANKL – RANK – OPG, уменьшая образование остеокластов, и обладает мощным антирезорбтивным эффектом.
Деносумаб эффективен в предупреждении низкотравматичных переломов тел позвонков, бедра и внепозвоночных переломов у женщин с постменопаузальным остеопорозом. Кроме того, по сравнению с бисфосфонатами (БФ) деносумаб позволяет добиться большего увеличения минеральной плотности кости (МПК) во всех отделах скелета. Циркулируя в крови и межклеточной жидкости, моноклональное антитело проникает во все участки скелета, в том числе кортикальную кость. Его распределение не зависит от активности костного ремоделирования. Если после двух- или трехлетнего использования БФ МПК бедренной кости стабилизируется и не увеличивается, то на фоне применения деносумаба она стабильно повышается до достижения целевых значений.
С увеличением продолжительности жизни населения и достижением успехов в лечении инфекций и острой хирургической патологии наибольшее социальное значение приобретают заболевания, ассоциированные с возрастом. Речь идет об онкологических, сердечно-сосудистых патологиях, сахарном диабете 2 типа и остеопорозе.
За последние 20–30 лет было сформулировано определение остеопороза, закрепившее связь снижения минеральной плотности кости (МПК) и нарушения внутренней микроархитектоники костной ткани с низкотравматичными переломами (при падении с высоты собственного роста). Точкой приложения для терапевтического вмешательства у лиц без переломов было предложено считать снижение МПК в шейке бедра на 2,5 стандартного отклонения и ниже по сравнению с показателем молодых здоровых женщин в возрасте 20–30 лет [1]. Впоследствии было рекомендовано обращать внимание на снижение МПК не только в шейке бедра, но также в поясничных позвонках и бедре в целом.
В настоящее время концепция точки приложения сместилась к оценке 10-летней вероятности переломов (FRAX) у конкретного пациента. FRAX наряду с показателем денситометрии учитывает совокупность факторов риска переломов и конкурирующую вероятность летального исхода по другим причинам в определенной возрастной группе пациентов [2]. Основная задача врача – оценить краткосрочную и долгосрочную вероятность перелома и на основании этого принять решение о лечении.
Коррекция модифицируемых факторов риска (отказ от курения, злоупотребления алкоголем, поддержание индекса массы тела, компенсация вторичных причин остеопороза) считается самым эффективным методом предупреждения переломов [3]. Однако механизмы развития остеопороза у женщин в постменопаузе и мужчин старше 50 лет сложны и здорового образа жизни обычно недостаточно для предупреждения развития остеопороза.
Возможности медикаментозного лечения остеопороза
С появлением заместительной терапии женскими половыми гормонами было предложено первое патогенетическое лечение постменопаузального остеопороза. Чуть позже для лечения остеопороза применяли кальцитонин лосося и препараты активных метаболитов витамина D [4, 5]. Однако настоящий прорыв в терапии остеопороза связан с клиническими исследованиями алендроната и его регистрацией для лечения остеопороза в 1994 г. [6].
Бисфосфонаты (БФ) служат ярким примером эмпирического, или традиционного, подхода к поиску терапевтического агента. Эти препараты разрабатывались с целью предупреждения эктопической кальцификации и лечения мочекаменной болезни. Но их массовое применение началось значительно позже, после ряда модификаций и создания аминобисфосфонатов. Даже после успешного применения алендроната для лечения постменопаузального остеопороза прошло несколько лет, прежде чем ученые смогли объяснить механизм его действия [7]. Все последующие разработки в этой области были направлены на поиск более удобных форм применения БФ [8, 9].
Период развития антирезорбтивной терапии остеопороза охарактеризовался появлением первого анаболического препарата – терипаратида. И хотя его эффективность не вызывает сомнений, механизм действия обсуждается и сегодня [10, 11].
В последние годы в фармакологии прочно закрепилось понятие таргетной терапии. Ее основное отличие от традиционной, или эмпирической, заключается в том, что синтезу молекулы – фармакологического препарата предшествуют глубокое изучение механизмов заболевания и поиск потенциальных мишеней для терапевтического вмешательства.
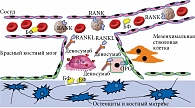
В постменопаузе показатели костного обмена меняются: возрастает частота активаций костных ремоделирующих единиц, активность остеокластов, то есть костной резорбции. Наряду с этим увеличивается и образование костной ткани, но оно не способно полностью компенсировать резорбцию [12, 13]. Как известно, снижение уровня эстрогенов способствует значительному увеличению экспрессии лиганда рецептора ядерного фактора каппа бета (Receptor Activator of Nuclear Factor Kappa-B Ligand – RANKL) и относительному уменьшению остеопротегерина (osteoprotegerin – OPG) в остеобластах [14]. Как следствие – избыточное привлечение остеокластов и повышение костной резорбции.
Активация системы RANKL – RANK – OPG является универсальным механизмом привлечения остеокластов в норме. Именно через эту систему усиливается остеокластогенез при подавляющем большинстве патологических состояний (тиреотоксикоз, гиперпаратиреоз, ревматоидный артрит и т.д.) [14].
Деносумаб – полностью человеческое моноклональное антитело, высокоспецифичный ингибитор RANKL. Применение деносумаба у человека имитирует эффект OPG, предупреждая взаимодействие RANK – RANKL и тем самым останавливая созревание новых остеокластов [15].
Механизм действия и фармакокинетика деносумаба принципиально отличаются от таковых БФ. Бисфосфонаты в момент поступления в организм примерно на 50% выводятся почками и на 50% абсорбируются костной тканью. Степень распределения БФ зависит от метаболической активности кости. В большей степени препарат поступает в метаболически активную трабекулярную кость и в меньшей – в кортикальную. При костной резорбции создается кислая среда, и препарат поступает внутрь остеокласта вместе с костным матриксом. В результате сокращается продолжительность жизни остеокласта.
Деносумаб по аналогии с OPG связывает RANKL, что предупреждает взаимодействие с RANK, а соответственно и образование остеокласта. Циркулируя в крови и межклеточной жидкости, деносумаб проникает в каждую ремоделирующую единицу. Его распределение не зависит от скорости костного ремоделирования, типа костной ткани. Это обеспечивает хорошие терапевтические результаты в кортикальной кости и эффективность препарата даже после прекращения приема (рис. 1).
Антитело к RANKL имеет значительно больший период полувыведения в отличие от OPG, который также был синтезирован. Однако период полувыведения даже модифицированного OPG требует частых инъекций. Что касается антитела, рекомендована одна подкожная инъекция в шесть месяцев [16]. Кроме того, будучи биологическим препаратом, деносумаб не накапливается в костной ткани и не оказывает отсроченного влияния с полным обратным развитием эффекта после отмены лечения [15].
Эффективность терапии деносумабом
В регистрационном исследовании эффективности деносумаба продемонстрировано снижение риска переломов тел позвонков на 68% (относительный риск (ОР) 0,32; 95%-ный доверительный интервал (ДИ) 0,26–0,41), бедра на 40% (ОР 0,6; 95% ДИ 0,37–0,97) и внепозвоночных переломов на 20% (ОР 0,80; 95% ДИ 0,67–0,95; p = 0,01) [16]. Деносумаб повышал МПК в поясничных позвонках (+9,2%) и в бедре в целом (+6%) за три года терапии. При этом увеличение МПК было стабильно линейным. Как показали результаты нелинейного анализа методом конечных элементов, по сравнению с плацебо деносумаб увеличивал прочность костной ткани в бедре на 14,3% (p < 0,0001), в позвонках на 22,4% (p < 0,0001) [17].
На фоне лечения деносумабом значительно снижаются сывороточные концентрации маркера костного разрушения – С-концевого телопептида коллагена 1 типа (СТх), который остается подавленным в течение шести месяцев от момента инъекции препарата с легкой тенденцией к повышению к пятому и шестому месяцам. Концентрация маркера остается сниженной на протяжении всего периода лечения, в том числе при его пролонгации на шесть и более лет, но сразу после отмены препарата быстро увеличивается и даже несколько превышает исходное значение [18].
В ходе исследования установлена дополнительная польза препарата для предупреждения падений: 175 (4,5%) случаев падения в группе деносумаба за период терапии по сравнению с 219 (5,7%) случаев в группе плацебо (p = 0,02). И, видимо, как следствие – уменьшение случаев ушибов: один – в группе препарата (< 1%) и 11 (0,3%) – в группе плацебо [16].
Повышение МПК, сходное с полученным у женщин, наблюдалось у мужчин со сниженной костной массой: до +5,7% в поясничных позвонках за первый год лечения и +8% за второй год терапии, а также на 3,4% в шейке бедра за два года лечения [19, 20].
Деносумаб продемонстрировал эффективность в предупреждении переломов у мужчин, получавших андроген-депривационную терапию по поводу рака предстательной железы в течение 36 месяцев без метастатического поражения костей скелета (ОР 0,38; 95% ДИ 0,19–0,78) [21]. Кроме того, деносумаб предупреждал новые переломы тел позвонков у женщин, получавших лечение по поводу гормонально-зависимого рака молочной железы без метастатического поражения скелета [22].
При гистоморфометрическом исследовании образцов костной ткани, взятых из подвздошной кости, пациентов, находившихся на лечении деносумабом в течение 1–3 лет, площадь поверхностей, подвергавшихся резорбции, была снижена на 80%, и практически не удавалось визуализировать остеокласты [23]. Двойная тетрациклиновая метка (костеобразование) была видна только у 20% участников исследования. Структурные индексы (ламелярная кость, минерализация, остеоид, толщина трабекул, количество и их разделение) сохранялись неизменными, без признаков ухудшения качества кости. Интересно, что показатели костных маркеров у пациентов, в образцах костной ткани которых удалось зарегистрировать двойные тетрациклиновые метки, не превышали таковые у пациентов, у которых метки не были выявлены. Более того, микрокомпьютерная томография показала снижение порозности кости и увеличение объемной МПК в кортикальной кости по сравнению с плацебо [24]. Результаты гистологических исследований костной ткани были идентичны и при пятилетнем исследовании деносумаба, продемонстрировав нормальную минерализацию и микроархитектонику костной ткани с признаками низкой активности костного ремоделирования [24, 25].
Безопасность деносумаба
Тот факт, что RANKL экспрессируется в лимфоцитах, заставляет задуматься о возможном повышении частоты инфекций на фоне лечения деносумабом [26]. Однако, согласно результатам трехлетнего исследования с участием 7868 пациентов, препарат продемонстрировал хороший профиль безопасности. В частности, не зарегистрировано увеличения общего количества всех инфекций в группе лечения по сравнению с группой плацебо. В группе деносумаба статистически значимо чаще наблюдалась экзема – 118 (3%) больных. В группе плацебо таких случаев зарегистрировано 65 (1,7%). Метеоризм имел место у 84 (2,2%) больных группы деносумаба и у 53 (1,4%) – группы плацебо. Кожные инфекции, хотя и очень редкие, воспаление подкожной жировой клетчатки, в том числе рожистое, чаще встречались на фоне лечения деносумабом: 12 (0,3%) случаев в группе лечения и один (< 0,1%) – в группе плацебо.
Деносумаб, как и другие антирезорбтивные препараты, может способствовать развитию гипокальциемии. Поэтому важно до начала лечения компенсировать дефицит витамина D и обеспечить достаточное поступление кальция.
В ключевых исследованиях эффективности деносумаба при остеопорозе не выявлено повышения частоты остеонекроза челюсти. Однако впоследствии подобные случаи были описаны в основном у пациентов, получавших высокие дозы деносумаба по поводу метастатического поражения скелета [27].
Восемь случаев остеонекроза челюсти описано только в рамках исследования деносумаба для лечения остеопороза, причем пять из них – на пятом и шестом году терапии (два случая после 11-й дозы, два после 12-й и один после 13-й дозы). Три случая остеонекроза зафиксированы в группе плацебо, пациенты которой были переведены на терапию деносумабом. Причем в двух случаях остеонекроз развился после двух лет лечения и в одном – после четырех лет терапии [28]. Систематический анализ случаев остеонекроза челюсти на фоне терапии деносумабом позволил выделить основные факторы риска развития этого состояния: плохая гигиена ротовой полости, удаление зубов, химиотерапия [28]. Между тем частота развития остеонекроза челюсти очень низкая – не более 0,18% [27, 28].
На фоне лечения БФ зарегистрированы редкие случаи атипичных переломов. На восьмом году лечения деносумабом описан один перелом, по характеристике аналогичный атипичному. Кроме того, один похожий перелом описан у пациента после трех лет терапии плацебо сразу после перевода на лечение деносумабом [28]. Скорее всего критерии определения атипичных переломов несовершенны.
В целом польза от лечения деносумабом существенно превосходит риски редких нежелательных эффектов.
Противопоказаниями и ограничением для терапии деносумабом являются гипокальциемия и повышенная чувствительность к препарату.
Длительность лечения деносумабом и его место среди других препаратов для лечения остеопороза
Остеопороз – хроническое заболевание, что предполагает пожизненное лечение и наблюдение пациентов. В силу фармакокинетических особенностей БФ можно применять курсами с так называемыми каникулами.
Полностью обратимый эффект действия деносумаба с восстановлением костного ремоделирования и снижением МПК после прекращения его приема позволяет предположить уменьшение противопереломной эффективности после его отмены [18].
Результаты ретроспективного исследования с участием 797 пациентов, прекративших прием деносумаба, получавших от двух до пяти доз плацебо (n = 470) или деносумаба (n = 327) и остававшихся в исследовании как минимум семь месяцев после прекращения лечения, не показали увеличения частоты переломов в группе плацебо в течение в среднем 24-месячного пребывания без препарата [29]. Однако нельзя сказать, что данное ретроспективное исследование полностью исключает эту вероятность.
Вместе с тем распределение деносумаба в костной ткани в отличие от БФ не зависит от активности костного ремоделирования в отдельных участках скелета, что позволяет добиться сопоставимой концентрации препарата в трабекулярной и кортикальной кости.
Возможно, эти особенности фармакокинетики объясняют то, что деносумаб был более эффективен в приросте МПК при прямом сравнении со всеми БФ [30] и эффективно повышал МПК, будучи назначенным как после БФ [31], так и после терипаратида [32].
При прямом сравнении эффективности алендроната и деносумаба после курса терапии терипаратидом деносумаб продемонстрировал более значимое увеличение МПК [33]. Систематический анализ литературы и метаанализ показали, что эффективность деносумаба в прибавке МПК во всех отделах скелета превышала таковую всех БФ, в том числе золедроновой кислоты 5,0 мг один раз в год – БФ с наиболее сильными антирезорбтивными свойствами. Различия были статистически значимы уже в течение первого года терапии. Однако среди 4890 пациентов, получавших лечение деносумабом или другими препаратами для лечения остеопороза в течение от 12 до 24 месяцев, статистически значимых различий по переломам не выявлено. Отсутствие различий по переломам в принципе ожидаемо ввиду относительно небольшой выборки пациентов и небольшого периода наблюдения [30].
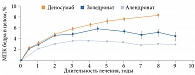
Существенные различия в терапии деносумабом наблюдаются при более длительном периоде лечения. Так, за восемь лет непрерывного применения деносумаба общая прибавка МПК составила 16,5% в поясничных позвонках, 6,8% в бедре в целом [34]. Десятилетние результаты пролонгирования фазы III клинического исследования продемонстрировали стабильную прибавку МПК с общим кумулятивным приростом до 21,6% в поясничных позвонках и 9,1% в бедре от исходного уровня [35]. Это уникальное непрерывное линейное увеличение МПК на фоне терапии деносумабом не имеет единого объяснения. Известно, что при использовании БФ максимальная прибавка МПК обычно наблюдается в первые два года терапии, затем выходит на плато, особенно в кортикальной кости, в частности в бедре. Вероятно, это обусловлено особенностью распределения БФ преимущественно в трабекулярной кости и накоплением БФ в зависимости от активности костного обмена в различных участках скелета. Вследствие этого в некоторые зоны скелета БФ может не поступать вовсе. В то же время деносумаб циркулирует в том числе в глубоких слоях кортикальной кости. Терапия деносумабом позволяет увеличивать МПК в бедренной кости в течение всего времени терапии, в том числе за 8–10 лет непрерывного использования (рис. 2) [36]. Возможно, деносумаб, значительно снижая ремоделирование, не влияет на процессы моделирования скелета, которые иногда могут иметь место у взрослого человека, что объясняет увеличение МПК.
Изменение МПК на фоне терапии является важным предиктором противопереломной эффективности [1–3]. Действительно, количество переломов тел позвонков в пролонгированной фазе исследования за три дополнительных года составило 3,5%. Это меньше, чем за первые три года лечения в корневом исследовании FREEDOM. То же наблюдалось и в отношении внепозвоночных переломов: 3,8% за три года пролонгированной фазы исследования по сравнению с 6,5% в группе лечения и 8% в группе плацебо за первые три года терапии. Со временем частота переломов уменьшалась прогрессивно параллельно с ростом МПК. Особенно заметным был эффект в отношении внепозвоночных переломов [24]. Эти результаты, по всей видимости, демонстрируют необходимость более длительного непрерывного лечения остеопороза.
По мнению ряда экспертов, после достижения желаемой МПК можно отменить деносумаб и назначить БФ на один-два года во избежание быстрой потери МПК. Однако продолжительность лечения определяется не временем разрешенной терапии, а именно достижением желаемой прибавки МПК.
Частота нежелательных эффектов на фоне пролонгированной терапии деносумабом не нарастала и была такой же или даже ниже для всех серьезных нежелательных эффектов и смертельных исходов по сравнению с частотой в исходной группе пациентов [24]. Следует отметить, что на фоне терапии деносумабом не наблюдается гриппоподобной реакции в отличие от БФ. Кроме того, не зарегистрировано случаев аритмии.
Заключение
Терапия остеопороза деносумабом эффективна для предупреждения переломов и прибавки МПК у женщин в постменопаузе, мужчин с остеопорозом и мужчин и женщин, получающих андроген-и эстроген-депривационную терапию по поводу онкологических заболеваний. Деносумаб позволяет добиться лучшей прибавки МПК при прямом сравнении со всеми БФ (золедроновая кислота, ибандронат, алендронат и ризедронат). Препарат также эффективен для дальнейшей прибавки МПК при назначении после БФ и терипаратида. Эффективность деносумаба в увеличении МПК и предупреждении переломов сохраняется в течение 10 лет терапии, что позволяет добиться хорошей прибавки МПК у подавляющего большинства пациентов.
Деносумаб хорошо переносится, достаточно безопасен. В частности, при его применении не выявлено нарушений со стороны микроархитектоники костной ткани при гистологическом исследовании. Вместе с тем терапия деносумабом полностью обратима. При отмене препарата наблюдаются снижение МПК и восстановление костного ремоделирования.
Лечение деносумабом у лиц с остеопорозом целесообразно начинать до достижения индивидуальной терапевтической цели в отношении увеличения МПК. Терапия деносумабом оправданна также после лечения БФ, когда желаемая прибавка МПК не достигнута, или после лечения терипаратидом, срок применения которого ограничен двумя годами.
Zh.Ye. Belaya
Endocrinology Research Center
Contact person: Zhanna Yevgenyevna Belaya, jannabelaya@gmail.com
Development of pharmacological technologies and accumulation of knowledge regarding pathogenesis of various diseases contributed to emergence of targeted therapy. Compared to traditional approaches, when drug efficacy was confirmed experimentally that, in some cases, let to use drug for a long time without fully understanding mode of its action, targeted therapy implies a deep knowledge of disease pathogenesis and search for points of application for therapeutic intervention.
Denosumab is a human monoclonal antibody against receptor activator of nuclear factor kappa-B ligand (RANKL), the first targeted drug designed for treating osteoporosis. Denosumab acts similarly to osteoprotegerin (OPG) in RANKL – RANK – OPG axis by reducing development of osteoclasts and has a potent anti-resorptive effect.
Denosumab is efficient in preventing fragility fractures of vertebral bodies, femur and extravertebral fractures in women with postmenopausal osteoporosis. Moreover, compared to bisphosphonates (BPH) denosumab allows to achieve higher increase of bone mineral density (BMD) in all parts of skeleton. By circulating in the blood and intercellular fluids denosumab enters all regions of skeleton including cortical bone. Biodistribution of denosumab does not depend on activity of bone remodeling process. Whereas BMD in femoral bone becomes stabilized without further increase after using BPH for two or three years, administration of denosumab was found to result in stably increasing BMD until reaching target values.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.