Эндокринная остеопатия и антирезорбтивная терапия
- Аннотация
- Статья
- Ссылки
- English

![Таблица 2. Эффекты гормонов гипофиза на костную ткань [31]](/upload/resize_cache/iblock/90f/195_350_1/6_3.jpg)
![Таблица 3. Применяющиеся в России азотсодержащие бисфосфонаты [32]](/upload/resize_cache/iblock/056/195_350_1/6_4.jpg)
Из-за увеличения продолжительности жизни некоторые заболевания, ранее не расценивавшиеся клинически значимыми, сегодня становятся проблемой мирового масштаба. Одним из них является остеопороз.
Кость – это минерализованная ткань, состоящая из органического матрикса коллагеновых волокон, распределенных по неорганической массе минералов, в подавляющем большинстве состоящей из гидроксиапатита кальция. При остеопорозе происходят количественные и качественные изменения компонентов костной ткани, в которой процесс деминерализации становится интенсивным и длительным, превышающим возможности процесса минерализации, до точки, после которой кости становятся хрупкими и легко ломаются [1].
Старение само по себе связано с ускорением потери костной массы – от 0,5 до 1% в год [2]. Потеря костной массы у женщин после менопаузы происходит более стремительно – в среднем до 3–5% в год в течение первых пяти лет, в дальнейшем процесс несколько замедляется. Прежде всего это обусловлено снижением концентрации циркулирующих эстрогенов. В среднем остеопороз встречается у каждой третьей женщины в постменопаузе. Риску остеопоротических переломов подвержены порядка 40% женщин [3]. У мужчин остеопороз развивается на десять лет позже, чем у женщин. Однако показатели смертности после свершившихся остеопоротических переломов у них более высокие: при переломе бедра уровень смертности в первый год составляет 36% (у женщин – 21%) [2, 4].
На развитие патологии костной ткани как у женщин, так и у мужчин непосредственно влияют особенности питания и функционирования эндокринной системы. Эндокринные причины многочисленны и разнообразны: тиреотоксикоз, сахарный диабет (СД) 1 и 2 типа, гиперпаратиреоз, гипогонадизм у мужчин и женщин, эндогенный и экзогенный гиперкортицизм, гиперпролактинемия, акромегалия и гипопитуитаризм [2, 3, 5, 6] (табл. 1).
Тиреотоксикоз
Известно, что у детей при недостатке гормонов щитовидной железы происходит задержка роста (полностью восстанавливается при своевременно начатом лечении). И наоборот, избыток гормонов (тиреотоксикоз) приводит к ускорению роста, повышению костного возраста и снижению конечного роста вследствие преждевременного закрытия эпифизарных зон роста [7].
Проведенные исследования показывают, что супрессивная терапия при высокодифференцированном раке щитовидной железы не оказывает существенного влияния на минеральную плотность кости (МПК) у мужчин и женщин в пременопаузе [8, 9], в то время как эндогенный гиперкортицизм является фактором риска снижения МПК и связан с повышением костного обмена [9, 10]. Эндогенный тиреотоксикоз также связан с увеличением риска переломов в течение жизни, даже после достижения эутиреоза [11].
Сахарный диабет
Локальные костные изменения стопы, например стопа Шарко, – серьезные и признанные осложнения СД. В отличие от этой патологии связь между остеопорозом и СД менее признана и его клиническое значение кажется менее очевидным.
Различный патогенез СД 1 и 2 типа обусловливает различие проявлений остеопатий. При СД 1 типа в основе развития остеопороза лежат нарушения в дифференцировке остеобластов и их активности. Немаловажный вклад также вносят аккумуляция конечных продуктов гликирования и осложнения СД (нейропатии, нефропатии, гипогликемии), которые приводят к дальнейшему снижению МПК и, как следствие, ухудшению геометрических свойств кости и повышению риска падений. В результате пациенты с СД 1 типа в 6,9 раза более подвержены риску перелома бедра по сравнению со здоровыми лицами. Несмотря на такой высокий риск переломов, хрупкость костей как несомненное осложнение СД 1 типа недооценивает большинство выпущенных к настоящему времени клинических рекомендаций [12, 13].
При СД 2 типа основным патогенетическим механизмом является ухудшение качества кости, а не снижение ее массы [14, 15]. У данных пациентов риск развития остеопении не столь очевиден – в два раза выше, чем в общей популяции. И переломы чаще всего происходят при более высоких показателях МПК, например в остеопеническом диапазоне.
Гиперпаратиреоз
Паратиреоидный гормон (ПТГ) и витамин D являются основными модуляторами гомеостаза кальция. ПТГ воздействует на кости и почки. В почках он увеличивает реабсорбцию кальция, повышает конверсию 25(OH)D в его активную форму – 1,25(OH)2D, в результате увеличивается всасывание кальция в кишечнике. В костях через остеокласты вызывает мобилизацию кальция из скелета [16].
При гиперпаратиреозе процесс ремоделирования кости значительно повышается. Исследования костных маркеров демонстрируют увеличение как маркеров резорбции, так и маркеров формирования кости. Это согласуется с гистоморфометрическими данными. Больше всего подвержена влиянию ПТГ кортикальная костная ткань. Ее пористость отражает активность ремоделирования на гаверсовых поверхностях – при гиперпаратиреозе увеличивается на 30–65%. Именно поэтому наиболее выраженную потерю МПК при данной патологии можно наблюдать в лучевой и бедренной костях [17].
Гипогонадизм
Половые стероиды – важные регуляторы костного обмена, сдерживающие резорбцию и активирующие анаболические процессы в костях. При этом и у женщин, и у мужчин костные эффекты опосредуются через эстрадиол – у женщин напрямую, у мужчин через ароматизирование тестостерона в клетках костной ткани [3]. Прекращение работы яичников/яичек (естественное, медикаментозное либо хирургическое) ускоряет потерю костной массы. Исследования показывают, чем раньше наступает менопауза, тем ниже в дальнейшем МПК. Резкое снижение МПК наблюдается даже после удаления яичников после естественно наступившей менопаузы [4].
Медикаментозная кастрация все чаще применяется для лечения гормонозависимых онкологических заболеваний, например рака молочной и предстательной желез. Используются препараты агонистов гонадотропин-рилизинг-гормона (ГнРГ), ингибиторов ароматазы.
Действие эстрогенов на кости довольно сложное. Костные клетки имеют два вида ядерных рецепторов для эстрогенов, но есть и внерецепторные эффекты, в том числе через факторы роста и интерлейкины. Основным физиологическим эффектом эстрадиола является подавление резорбции кости за счет активации апоптоза остеокластов [18]. При постменопаузальном остеопорозе, как правило, страдает трабекулярная костная ткань (позвонки и шейка бедренной кости) [2].
Гиперкортицизм
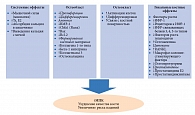
Избыток глюкокортикоидных гормонов возникает по разным причинам. Чаще всего он наблюдается на фоне приема глюкокортикоидов (экзогенный гиперкортицизм) при различных аутоиммунных, воспалительных, онкологических заболеваниях. Применение высоких доз глюкокортикоидов в течение длительного времени приводит к быстрой потере костной массы. Они снижают активность остеобластов, активируют остеокласты и повышают резорбцию костной ткани, снижают мышечную силу, способствуют снижению абсорбции и повышенной экскреции кальция с мочой, а также влияют на пути действия гормона роста (ГР) и других локальных ростовых факторов в костной ткани (см. рисунок). Глюкокортикоид-индуцированный остеопороз чаще поражает трабекулярную костную ткань [19].
Статистика показывает, что у 30% пациентов, ежедневно принимавших глюкокортикоиды в дозе 7,5–15 мг (в перерасчете на преднизолон) более пяти лет, происходят низкоэнергетические переломы вне зависимости от возраста и менопаузального статуса, при этом риск переломов у данных больных превышает популяционный риск переломов в 5,67 раза [20]. Характерным является также то, что переломы при глюкокортикоид-индуцированном остеопорозе происходят при высоких уровнях МПК, чаще в остеопеническом диапазоне [20, 21].
Причинами эндогенного гиперкортицизма могут стать синдром и болезнь Иценко – Кушинга, АКТГ-эктопированный синдром (АКТГ – адренокортикотропный гормон), которые, как правило, ассоциированы с более яркой картиной гиперкортицизма и его осложнений ввиду более высокой суммарной нагрузки секретируемых гормонов на организм. При эндогенном гиперкортицизме изменения структуры кости приводят к переломам в 70% случаев, чаще в позвонках, бедре, ребрах и костях таза. Нередко переломы бывают спонтанными или вследствие низкой травмы [22].
Гиперпролактинемия
Гиперпролактинемия вызывает вторичный гипогонадизм, подавляя пульсаторную секрецию ГнРГ, но она также может оказывать и независимое от половых гормонов влияние на метаболизм костной ткани [23, 24]. Дефицит эстрогенов у 50% пациенток в пременопаузе с вторичной аменореей объясняется приобретенным нарушением регуляции ГнРГ, включая гиперпролактинемию. Дефицит эстрогенов способствует ускорению метаболизма костной ткани с более высокой резорбцией, чем формированием [19].
Трабекулярная костная ткань в большей степени подвержена остеопорозу, чем кортикальная (как и при гипогонадизме). У 80% пациентов с гиперпролактинемией выявляется снижение МПК в поясничном отделе позвоночника, у 30% – в шейке бедра. G. Mazziotti и соавт. отметили высокую распространенность переломов позвонков (по данным боковой рентгенографии) в группе с пролактин-секретирующими аденомами гипофиза по сравнению с контрольной группой [24, 25].
Акромегалия
Акромегалия характеризуется избыточной секрецией ГР, в большинстве случаев обусловленной наличием соматотропной опухоли гипофиза. ГР и медиатор его периферического действия, инсулиноподобный фактор роста 1 (ИФР-1), стимулируют пролиферацию, дифференцировку и синтез внеклеточного матрикса остеобластов. ГР и ИФР-1 повышают резорбцию кости, активируя остеокласты [26]. В препубертатном периоде ГР ответствен за рост костей в длину, в то время как в подростковом и юношеском возрасте – за созревание скелета до достижения пика костной массы. В зрелом возрасте ГР регулирует костный обмен, таким образом способствуя поддержанию костной массы [27]. При акромегалии меняются размер и плотность костей, повышается костный обмен, развивается остеоартропатия. Установлено, что акромегалия является причиной вторичного остеопороза [27].
Показатели МПК при акромегалии могут быть как выше, так и ниже показателей в популяции. Это зависит от пола, возраста и активности заболевания, а также наличия гипогонадизма [28]. У пациентов с акромегалией и гипогонадизмом более высокий риск развития остеопороза на участках, сложенных преимущественно из трабекулярной костной ткани. Нормальные или повышенные показатели МПК могут быть следствием анаболического эффекта ГР. МПК может быть повышена из-за дегенеративной модификации позвоночника и других костей скелета, имеющей место при акромегалии. Несмотря на сравнительно высокие показатели МПК, переломы наблюдаются у 39–59% пациентов с акромегалией. Это объясняется низким уровнем микроархитектурной организации костной ткани [27].
Дефицит гормона роста
У пациентов с изолированным дефицитом ГР (ДГР) и множественным дефицитом гормонов гипофиза часто отмечается низкая МПК, особенно при манифестации заболевания в детском возрасте вследствие недостижения пика костной массы [29]. Исследования показывают, что ДГР имеет решающее значение для развития остеопении у пациентов с гипопитуитаризмом [29], а его устранение улучшает МПК и снижает риск переломов [30]. Дефицит гормонов гипофиза, приводящий к гипогонадизму, гипотиреозу или гипокортицизму, также может способствовать потере костной массы (табл. 2) [31].
Лечение остеопороза
Основной целью лечения остеопороза является предотвращение переломов. Прием пероральных бисфосфонатов сопровождается клинически значимым снижением риска новых переломов позвонков и в настоящее время считается золотым стандартом терапии постменопаузального остеопороза, в том числе вследствие эндокринных заболеваний [2].
Антирезорбтивное действие бисфосфонатов с адекватной дозой кальция и витамина D повышает МПК, снижает костный обмен, что способствует восстановлению костной ткани, и частоту как вертебральных, так и вневертебральных остеопоротических переломов. При этом бисфосфонаты могут применяться перорально (ежедневно, еженедельно, ежемесячно или периодически) или внутривенно (каждые три месяца или один раз в год) (табл. 3).
Современные азотсодержащие бисфосфонаты различаются не только дозировкой, способом введения и кратностью приема, но и способностью связывания с гидроксиапатитом, что проявляется высоким сродством с поверхностью кости и меньшим проникновением в нее. В результате обеспечивается длительный эффект терапии. Кроме того, бисфосфонаты различаются степенью подавления фарнезилпирофосфатсинтазы, что и является точкой приложения препаратов данной группы [32].
Залог успешного лечения остеопороза – долгосрочная приверженность терапии (в течение нескольких лет). Известно, что долгосрочная приверженность лечению, независимо от заболевания, явление редкое [33]. А низкая приверженность терапии ведет к уменьшению скорости костного метаболизма, а следовательно, к более низкому приросту МПК и незначительному снижению риска переломов. Как следствие, увеличиваются затраты на медицинское обслуживание и снижается качество жизни пациентов [2].
Ибандронат – относительно новый и хорошо изученный препарат группы бисфосфонатов. Ибандронат имеет потенциальное преимущество перед другими препаратами данной группы, поскольку предлагает пациентам и врачам свободу выбора способа приема, что может улучшить приверженность лечению и его результат [2, 34]. В настоящее время показанием для назначения ибандроната является постменопаузальный остеопороз.
Были проведены два рандомизированных контролируемых исследования (РКИ) по оценке снижения риска переломов на фоне приема ибандроната: первое – BONE, анализировалась эффективность ежедневного приема 2,5 мг и прерывистого приема (через день 12 доз по 20 мг каждые три месяца) в течение трех лет [35, 36], второе – исследование эффективности внутривенного введения (0,5 и 1,0 мг каждые три месяца) в течение трех лет [37].
В исследовании BONE уже после года лечения ибандронатом в дозе 2,5 мг относительный риск вертебральных переломов снизился на 58% (р = 0,0561) в сравнении с плацебо, снижение риска переломов наблюдалось и в следующие два года (на третий год лечения – -62%, р = 0,0001). Вторая исследуемая схема лечения привела к снижению частоты переломов на 56% (р = 0,0017) и 50% (р = 0,0006) на второй и третий годы терапии соответственно [36].
Целью исследования MOBILE было сравнение эффективности различных режимов перорального приема ибандроната (две дозы по 50 мг с интервалом в один день в месяц, 100 мг в месяц однократно, 150 мг в месяц однократно и 2,5 мг ежедневно). Все ежемесячные режимы приема оказались эффективнее ежедневных.
При изучении эффективности внутривенного введения ибандроната было показано снижение переломов на 26% с пограничной статистической значимостью данного показателя (р = 0,0549) [38]. Невысокая эффективность режима 0,5 и 1 мг внутривенно каждые три месяца при неоспоримой высокой эффективности перорального приема послужила поводом для проведения исследования IRIS [37]. Его результаты показали высокую эффективность внутривенного введения ибандроната более 2 мг каждые три месяца. Исследование DIVA и его пятилетнее продолжение подтвердили преимущество внутривенного интермиттирующего введения [39, 40]. В исследовании DIVA применялись две дозы ибандроната: 2 мг каждые два месяца и 3 мг каждые три месяца. Оба режима показали высокую эффективность, но с практической точки зрения преимущество было отдано второму в связи с более редким введением препарата.
Таким образом, в РКИ были обоснованы оптимальные дозировки и режим применения пероральной и внутривенной форм ибандроната – препарата Бонвива: 150 мг перорально ежемесячно и 3 мг/3 мл внутривенно каждые три месяца.
Проведенные три метаанализа данных исследований BONE, MOBILE и DIVA показывают эффективность ибандроната и в снижении частоты вневертебральных переломов (на 28,8–34,4%), причем данный эффект был дозозависимым. Отмечено, что применение 150 мг перорально ежемесячно и 3 мг внутривенно ежеквартально на 38% эффективнее ежедневного перорального приема препарата в дозе 2,5 мг [41–43].
Ибандронат продемонстрировал хорошую переносимость. Так, частота нежелательных явлений (НЯ), серьезных НЯ, НЯ со стороны желудочно-кишечного тракта, прекращения терапии из-за НЯ была в целом сопоставима с плацебо [35, 36]. Характерные для всех пероральных бисфосфонатов НЯ со стороны желудочно-кишечного тракта встречались с одинаковой частотой у пациентов, получавших препарат как ежедневно, так и ежемесячно, а также сопутствующую терапию нестероидными противовоспалительными препаратами, однако на 18% чаще у пациентов с предшествующей патологией верхних отделов желудочно-кишечного тракта [44]. Гриппоподобный синдром наблюдался редко: у 0,9–3% больных на фоне ежедневного приема ибандроната в дозе 2,5 мг, у 8% – ежемесячного приема в дозе 150 мг и у 4,1–4,5% больных при ежеквартальном внутривенном введении 3 мг, что значимо реже, чем при применении препаратов золедроновой кислоты [32]. НЯ со стороны почек при различных схемах лечения отмечались крайне редко, без изменения среднего уровня креатинина. Снижение клиренса креатинина оставалось стабильным – в среднем 1,5 мл/мин/год, что сопоставимо с естественным возрастным снижением скорости клубочковой фильтрации. В корневых исследованиях не было зафиксировано случаев атипичных переломов или остеонекроза нижней челюсти [32].
В исследованиях также было показано, что интермиттирующие схемы лечения бисфосфонатами повышают приверженность лечению [45], а прием один раз в месяц по сравнению с еженедельным улучшает гастроэнтерологическую переносимость [46]. Это обусловливает снижение числа преждевременно прекративших лечение на 37–43% по сравнению с числом пациентов, ежедневно или еженедельно принимавших бисфосфонаты [47], и, как следствие, более эффективное снижение риска остеопоротических переломов и, возможно, благоприятный фармакоэкономический профиль. Таким образом, единственным бисфосфонатом, имеющим как парентеральную, так и таблетированную форму (принимается перорально один раз в месяц), является ибандронат (Бонвива). Оба режима дозирования обеспечивают высокую приверженность пациентов лечению, что сочетается с доказанной эффективностью ибандроната в снижении риска остеопоротических переломов.
Endocrine Osteopathy and Antiresorptive Therapy
E.A. Pigarova, L.Ya. Rozhinskaya
Endocrinology Research Centre
Contact person: Ekaterina Aleksandrovna Pigarova, kpigarova@gmail.com
Various endocrine diseases are manifested by development of osteoporosis, which is a skeletal disease characterized by reduced bone mass and increased risk of bone fractures. Here we present modern knowledge regarding pathophysiology of osteoporosis and discuss an impact of the most common endocrine diseases in increasing a risk of bone fractures as well as outline effective ways for its treatment.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.