Препарат «Генферон» – новый подход к профилактике инфекционно-воспалительных осложнений после операции медицинского аборта
- Аннотация
- Статья
- Ссылки

Эта ситуация значительно обостряет проблему демографического кризиса, несущего серьезнейшую угрозу национальной безопасности. Однако последствия абортов в виде разнообразных осложнений и нередко развивающегося бесплодия могут оказаться не менее пагубными для демографических показателей, что заставляет обратить на данную проблему самое пристальное внимание.
Частота послеоперационных воспалительных осложнений при медицинском аборте не имеет тенденции к снижению и составляет от 7 до 25%, а у первобеременных пациенток частота их доходит до 45% (4, 5, 6, 9, 10, 11, 16). Через 2 месяца после аборта хронический воспалительный процесс в органах малого таза диагностируется в 18%, через два года – в 12,5% случаев. В структуре материнской смертности аборт и его последствия (особенно септические осложнения) занимают первое место (26%). В этой связи постоянно ведется поиск наиболее эффективных способов профилактики гнойно-воспалительных осложнений этой операции.
Этиологический спектр возбудителей инфекционных осложнений абортов практически сходен с воспалительными заболеваниями органов малого таза. Характерна полимикробная этиология с преобладанием аэробно-анаэробных ассоциаций микроорганизмов, являющихся частью влагалищной микрофлоры (2, 9, 10). Основными возбудителями являются энтеробактерии (Escherichia coli), грамположительные кокки (Streptococcus gr. B, Enterococcus spp., Staphylococcus aureus), неспорообразующие анаэробы (Bacteroides spp., Peptococcus spp., Peptostreptococcus spp.). Несмотря на то, что многие исследователи пытались разработать методы профилактики гнойно-септических осложнений аборта (в основном применение антибактериальных, противомикробных препаратов и физиотерапевтических методов), частота их практически не уменьшилась.
В частности это сопряжено со значительным снижением сопротивляемости организма, индуцированным подобным вмешательством – медицинский аборт приводит не только к анатомическим изменениям в половых органах женщины, но и к многочисленным нарушениям состояния систем целостного макроорганизма. Все внутриматочные вмешательства являются стрессом и для иммунной системы, со своими особенностями при беременности. А это нередко приводит к развитию вторичных иммунодефицитных состояний, являющихся ключевым звеном для реализации послеоперационных гнойно-воспалительных осложнений.
Вышесказанное актуализирует вопрос применения в рамках профилактики осложнений медицинских абортов иммуномодулирующих средств в виде монотерапии или в сочетании с антибактериальными препаратами (4, 7, 8).
Из всей палитры иммунологических препаратов, применяемых сегодня в медицинской практике для лечения урогенитальных инфекций, наиболее востребованными оказались препараты цитокинового ряда (4, 7, 12, 14), в первую очередь – ИФН-α, обладающего противовирусным, противомикробным и иммуномодулирующим действием.
Противовирусная активность ИФН-α состоит в подавлении белкового синтеза и репликации ДНК в инфицированных клетках за счет рецептор-зависимой активации внутриклеточных ферментов 2’5’-олигоаденилатсинтазы и протеинкиназы, а также белков группы MX, ингибирующих репликацию вирусов, в активации натуральных киллеров, лизирующих пораженные клетки, в усилении экспрессии молекул I класса МНС. Уровень активности интерферонов имеет непосредственное отношение к индукции специфического (адаптивного) иммунного ответа, так как обеспечивает повышенную генерацию антивирусных цитотоксических T-клеток (CD8).
Действие ИФН-α на иммунный ответ проявляется в усилении выработки некоторых цитокинов (в частности ИЛ-1 и ИЛ-2), хотя в функциональном отношении интерфероны часто выступают как их антагонисты. В чрезмерно высоких дозах интерфероны подавляют как гуморальный, так и клеточный иммунный ответ, однако в более умеренных концентрациях оказывают иммунорегуляторное действие, что, скорее всего, реализуется в естественных условиях.
Важная роль среди факторов неспецифической защиты отводится фагоцитарной активности мононуклеарных лейкоцитов. Имеющиеся данные позволяют говорить, что фагоцитарная функция макрофагов в течение вирусной инфекции может регулироваться интерфероном, т. к. при этом Fc-опосредованная фагоцитарная активность макрофагов коррелирует с синтезом ИФН. При этом индукция и уровень интерферона зависят от функции Т-клеток. В настоящее время считается, что усиление фагоцитарной активности макрофагов, вызванное действием ИФН, связано с повышением на макрофагах экспрессии Fc-рецепторов. Оптимальной формой ИФН для использования в гинекологической практике являются суппозитории. При их использовании имеет место гораздо меньший риск передозировки и связанных с этим нежелательных явлений, чем при инъекционном введении, кроме того локальное применение суппозиториев дает быстрый терапевтический эффект непосредственно в очаге поражения. По результатам проведенных в ГНЦ Институте биофизики исследований фармакодинамики ИФН-α2b при различных путях введения было установлено, что при вагинальном применении отмечалась высокая концентрация ИФН в яичниках и матке, в десятки раз превышающая таковую при внутримышечном введении.
Препарат Генферон (ЗАО «БИОКАД», Россия) – новая лекарственная форма интерферона-α в виде свечей для вагинального и ректального введения. Основными компонентами препарата Генферон являются интерферон человеческий рекомбинантный α-2, таурин и анестезин. Комбинация активных и вспомогательных веществ, входящих в состав Генферона, обеспечивает не только сохранение активности и физических свойств препарата, но также усиление и расширение спектра действия основных его компонентов.
Главным активным компонентом препарата является человеческий рекомбинантный ИФН-α2, о свойствах которого было сказано выше.
Таурин – серосодержащая аминокислота, образующаяся в организме в процессе метаболизма цистеина, – широко применяется при целом ряде заболеваний. Таурин способствует нормализации метаболических процессов, обладает регенерирующими, репаративными, мембрано- и гепатопротекторными свойствами. Таурин действует и как антиоксидантное средство, непосредственно взаимодействует с активными формами кислорода, избыточное накопление которых способствует развитию патологических процессов (воспаление, интоксикация и т.д.). Сочетание интерферона с таурином в одной лекарственной форме позволяет обеспечить широкий спектр действия препарата и пролонгировать действие интерферона. Анестезин, являясь местным анестетиком, устраняет болезненные ощущения, зуд, жжение при обострении воспаления.
Цель данного исследования состояла в изучении эффективности действия препарата Генферон в профилактике инфекционно-воспалительных осложнений после медицинского аборта.
Материалы и методы исследования. В исследовании приняли участие 40 пациенток, обратившихся для проведения медицинского аборта в клинику акушерства и гинекологии Военно-медицинской академии г. Санкт-Петербурга. После проверки на соответствие критериям включения и исключения они были методом рандомизации распределены в две равные группы.
В I группу (опытную) вошли 20 беременных пациенток с инфекционно-воспалительными заболеваниями гениталий, которым в качестве профилактики гнойно-воспалительных осложнений аборта назначался препарат «Генферон» в дозе 500000 МЕ 2 раза в сутки в виде суппозиториев, вагинально на протяжении 5 дней до операции.
Во 2-ю группу (контрольную) вошли 20 беременных женщин с инфекционно-воспалительными заболеваниями гениталий, которым назначали плацебо, также в свечах вагинально по схеме применения Генферона.
В качестве плацебо использовались суппозитории, неотличимые по внешнему виду от стандартного препарата, содержащие все компоненты Генферона за исключением ИФН и таурина.
Суппозитории вводились вагинально, два раза в сутки, в одни и те же часы.
В течение всего исследования дозы исследуемого препарата были одинаковыми.
В рамках данного исследования использовались следующие методы лабораторной диагностики: клинический анализ крови, НСТ-тест, уровень ИФН-γ, фактор некроза опухоли альфа (ФНО-α) и интерлейкин 6 (ИЛ-6) в сыворотке крови, микроскопия мазков, окрашенных по Граму, а также оценка адаптационных реакций пациенток по методикам Л.Х. Гаркави (1990) и оценка адаптационных резервов пациенток по методике Г.В. Долгова (2001).
Тип адаптационных реакций, отражающих неспецифическую резистентность, определяли по показателям лейкограммы крови по методике Л.Х. Гаркави и соавт. (1990). Авторы выделяют реакции стресса (острого и хронического), тренировки, активации (спокойной и повышенной) и неблагоприятные реакции (таблица 1).
Реакции острого и хронического стресса появляются при действии сильного раздражителя. Раздражители средней силы вызывают реакции спокойной и повышенной активации, а раздражители слабой силы – реакцию тренировки. К неблагоприятным реакциям авторы относят реакции стресса, тренировки и активации, протекающие с явлениями десинхронизации, что свидетельствует о снижении и предельном напряжении системы естественной резистентности организма.
Кроме того, оценка адаптационных резервов организма по клиническому анализу крови проводилась на автоматизированной системе компьютерного мониторинга (АСКМ) «Прогноз» по методике Г.В. Долгова (2001), где наряду с показателями лейкограммы оценивались и показатели красной крови.
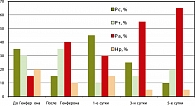
Результаты исследования и их обсуждение. При анализе адаптационных реакций их характер в обеих группах пациенток до введения суппозиториев был практически одинаков (рисунок 1, 2). В обеих группах у каждой второй пациентки наблюдались реакции стресса. Реакции тренировки в группах были выявлены у каждой третьей беременной женщины, а благоприятные реакции – активации - составляли в среднем 15% случаев.
После введения Генферона реакции активации увеличились почти в 2,7 раза за счет уменьшения доли реакций стресса, при этом при проведении плацебо-терапии существенных изменений в адаптационных реакциях не произошло.
После операции медицинского аборта у пациенток обеих групп (1-е сутки) адаптационные реакции стресса являлись доминирующими (45% – в опытной и свыше 60% – в контрольной). В последующем (на 3-и и 5-е сутки после операции) доля реакций активации в опытной группе значительно возросла и превысила исходные значения до введения препарата более чем в 3,7 и 4,3 раза соответственно. В контрольной же группе реакции активации увеличились на 3-и и 5-е сутки послеоперационного периода только в 2,3-2,6 раза. На 5-е сутки после операции доля реакций стресса в основной группе составила 15%, а в группе сравнения – 35%, т. е. превышала аналогичные показатели основной группы в 2,3 раза.
Оценка состояния адаптационных резервов организма на АСКМ «Прогноз» выявила преобладание саногенетических резервов в основной группе сразу после введения Генферона. Саногенетические варианты превышали патогенетические на протяжении всего периода наблюдения, а к 5-м суткам после операции были выше исходных до введения Генферона в 3 раза. Совершено иная ситуация была выявлена у пациенток контрольной группы. До 5-х суток преобладал патогенетический вариант течения послеоперационного периода над саногенетическим.
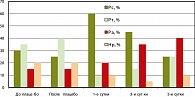
Среди показателей клинического анализа крови наибольшие различия между группами были выявлены по показателю СОЭ (рисунок 3). Это отражает степень интоксикации организма, после операции у женщин группы сравнения. И в наших наблюдениях был достоверно выше аналогичного у пациенток основной группы.
Значительный интерес вызывает анализ динамики изменений НСТ у пациенток исследуемых групп. Он показывает, что введение Генферона значительно и достоверно увеличивало бактерицидность сыворотки крови и фагоцитоз у женщин опытной группы на протяжении всего периода наблюдения (кроме 1-х суток после операции). У пациенток группы сравнения повышение НСТ было выявлено на 3-и 5-е сутки послеоперационного периода, что, вероятно, связано с продукцией эндогенных ИФН после хирургического стресса, вызванного абортом, и влияния их на фагоцитоз, но более замедлено по времени, что нашло свое подтверждение при определении уровня ИФН-γ у пациенток обеих групп (рисунок 4).
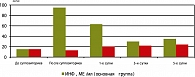
После введения Генферона пациенткам основной группы уровень ИФН-γ увеличился в 4 раза и был достоверно выше их за весь период наблюдения в послеоперационном периоде при сравнении с изначальными значениями. В группе сравнения значения ИФН-γ также изменялись, но незначительно и только к 5-м суткам послеоперационного периода были выше исходных.
В настоящее время среди медиаторов системной воспалительной реакции у пациентов высокого риска развития воспаления ведущее значение отводится таким провоспалительным цитокинам, как ИФН-γ, ФНО, IL-2 и IL-6 (1, 2, 8, 11, 12, 15). Согласно данным литературы, среди этих цитокинов наиболее информативным для определения ответа организма на микробную нагрузку является уровень IL-6. Он является своеобразным стандартом для определения динамики микробной агрессии (12, 14).
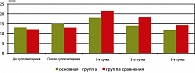
Анализ особенностей изменения ФНО-α и ИЛ-6 у пациенток опытной и контрольной групп указывает на активное повышение этих показателей у пациенток основной группы при сравнении с исходным уровнем после введения Генферона, особенно на 1-е сутки послеоперационного периода, а затем следует снижение показателей. В группе сравнения достоверное повышение исследуемых показателей начинается только после операции на 3-и и 5-е сутки послеоперационного периода, т. е. отсрочено по времени по отношению к основной группе.
По данным УЗИ, проведенного до выполнения медицинского аборта, у 7 женщин в обеих группах были выявлены признаки хронического воспаления в придатках матки. Из этих пациенток при проведении УЗИ на 3 и 5 сутки после выполнения аборта у 3-х женщин группы сравнения были признаки реактивного воспалительного процесса в придатках и матке, потребовавшие назначения дополнительной антибактериальной и симптоматической терапии. В основной группе подобных явлений не отмечалось.
Таким образом, полученные результаты позволяют сделать вывод, что применение препарата Генферон перед медицинским абортом с целью предоперационной подготовки у пациенток высокого риска по инфекционным осложнениям является патогенетически обоснованным. Профилактическое применение Генферона по стандартной схеме позволяет избежать постабортных гнойно-воспалительных осложнений и антибактериальной терапии.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.