Препараты гиалуроновой кислоты в терапии остеоартроза: фокус на Хондрорепарант Гиалрипайер
- Аннотация
- Статья
- Ссылки
- English
Введение
Остеоартроз (ОА) лидирует по своей распространенности среди других ревматических болезней. Он рассматривается как хроническое прогрессирующее заболевание синовиальных суставов с поражением прежде всего гиалинового хряща и субхондральной кости в результате воздействия комплекса биомеханических, биохимических, микроциркуляторных и/или генетических факторов [1]. В основе патогенеза ОА лежит нарушение равновесия между анаболическими и катаболическими процессами в тканях сустава, в особенности в гиалиновом хряще – основном плацдарме патологических изменений. В последние годы обсуждается также теория об участии в патогенезе разрушения гиалинового хряща сниженного кровотока в субхондральной кости.
Истинную распространенность ОА оценить трудно, поскольку отсутствует параллелизм между клинической симптоматикой и данными рентгенографии суставов, магнитно-резонансной томографии, ультразвуковых методов, а также макро- и микроскопическими показателями, полученными при проведении артроскопии или биопсии синовиальной оболочки. Так, у многих пациентов при рентгенпозитивности не наблюдаются клинические проявления заболевания. Напротив, при выраженной клинической картине может отмечаться рентгеннегативность. Согласно последним эпидемиологическим исследованиям распространенность симптоматического ОА коленного сустава в популяции составляет примерно 10%, тазобедренного – 5–7% [2]. В то же время выявляется тенденция к дальнейшему увеличению распространенности ОА вследствие увеличения продолжительности жизни и нарастания процентного соотношения лиц с ожирением в возрасте 60 лет и старше.
При ОА прежде всего поражаются нагрузочные (коленные и тазобедренные) суставы, что значительно ухудшает качество жизни больных и представляет серьезную социально-экономическую проблему [3]. Несмотря на то что заболевание непосредственно не влияет на жизненный прогноз, оно является одной из основных причин преждевременной потери трудоспособности и инвалидизации, уступая в этом только ишемической болезни сердца. В отчете Всемирной организации здравоохранения о социальных последствиях заболеваний опорно-двигательного аппарата указывается, что ОА коленных суставов занимает четвертое место среди причин нетрудоспособности у женщин и восьмое – у мужчин [4].
Заинтересованность всех структур, составляющих сустав, который можно рассматривать как самостоятельный орган, приводит к различным механизмам возникновения боли, одного из ведущих симптомов этого заболевания. Так, поражение субхондральной кости способствует развитию боли путем возникновения внутрикостной гипертензии и микропереломов, сформировавшиеся остеофиты приводят к травматизации чувствительных нервов, а поражение периартикулярных мышц сопровождается их спазмом. Однако ведущее значение в происхождении боли и прогрессирующей хронизации заболевания принадлежит воспалению, которое имеет первостепенное значение в развитии и прогрессировании ОА [5].
Индивидуализированная терапия ОА во многом обусловлена его фенотипом или его гетерогенностью. Выделяют следующие фенотипы заболевания:
- первичный (идиопатический) и вторичный ОА;
- локализация: гонартроз, коксартроз, остеоартроз суставов кистей, полиостеоартроз и т.п.;
- характер прогрессирования;
- основная причина (или причины) болевого синдрома;
- наличие, выраженность и локализация воспаления (синовит, периартрит);
- коморбидность;
- наличие и выраженность функциональной недостаточности, определение ее ведущей причины.
Лечение пациента с ОА представляет сложную задачу и включает комплекс мероприятий, состоящих из программы физической реабилитации (ограничение нагрузки, стабилизация пораженного сустава, коррекция ортопедических нарушений) и назначение препаратов, направленных на уменьшение боли и замедление структурных повреждений в тканях сустава.
Большое значение в терапии отводится воздействию на метаболизм хрящевой ткани с целью восстановления баланса между нагрузкой и репаративными возможностями хондроцитов. Для этой цели используются медленно действующие симптом-модифицирующие или хондропротективные (хондроактивные) препараты.
Применение гиалуронанов в артрологии
Соли гиалуроновой кислоты (ГК) широко используются в клинической практике с начала 80-х гг. прошлого века. Терапевтическая активность ГК доказана во многих рандомизированных контролируемых исследованиях.
В настоящее время это соединение входит в перечень препаратов, рекомендуемых Американской коллегией ревматологов (American College of Rheumatology – ACR), Европейской антиревматической лигой (European League Against Rheumatism – EULAR), Международной организацией по изучению остеоартроза (Osteoarthritis Research Society International – OARSI) (уровень доказательности 1b) [6–8].
ГК образует ось гигантской молекулы протеогликана, являющейся вместе с коллагеном основным биополимером соединительной ткани в целом и суставного хряща в частности. Протеогликан представляет собой супермолекулу, состоящую из субъединиц аггрекана и линейного сульфатированного полимера ГК [9, 10]. В линейной форме ГК секретируется синовиальной оболочкой в полость сустава, где является основным видом макромолекул. Именно ГК ответственна за уникальные вязкоэластичные свойства нормальной синовиальной жидкости, которая без ГК представляет собой простой диализат плазмы. In vivo полисахарид постоянно находится на поверхности суставного хряща и синовиальной оболочки, действуя как лубрикант и поглотитель механических нагрузок. Данное свойство чрезвычайно важно, так как механический стресс способствует не только продукции металлопротеиназ – одних из основных молекул, ответственных за дегенерацию хряща, но и экспрессии провоспалительных цитокинов. Кроме того, ГК является облигатным компонентом для хондроцитов в процессе синтеза протеогликанов гиалинового хряща.
В синовиальной жидкости неизмененного сустава высокая концентрация гиалуронана с большой молекулярной массой (2–4 мг/мл) обеспечивает механическую защиту клеток хряща. Постепенная утрата фибробластами полноценной синтетической функции и, как следствие, уменьшение молекулярной массы и концентрации гиалуронана в синовиальной жидкости – одни из ведущих звеньев патогенеза ОА. Введение в полость сустава высокомолекулярной ГК в высокой концентрации способствует восстановлению вязкоэластичных свойств синовиальной жидкости. Вновь образованная ГК восстанавливает гомеостаз сустава.
Потенциальная способность гиалуронана влиять на метаболизм хрящевой ткани позволяет отнести его к средствам патогенетической терапии ОА [9].
Противовоспалительный потенциал ГК реализуется через снижение уровня простагландинов, прежде всего ПГЕ2, ослабление экспрессии провоспалительных цитокинов (ИЛ-1β, ФНО-α), подавление синтеза металлопротеиназ с одновременным стимулированием синтеза тканевых ингибиторов этих эндопептидаз. Кроме того, гиалуронан снижает образование оксида азота, подавляет экспрессию цитокина RANTES (Regulated on Activation Normal T-Expressed and Secreted).
Хондрорепарант® Гиалрипайер®. Формула препарата
Сотрудники Международного научно-исследовательского центра инновационных технологий «МАРТИНЕКС» и Института синтетических полимерных материалов им. Н.С. Ениколопова разработали серию уникальных формул с запатентованным составом Гиалрипайер. Линейка препаратов Хондрорепарант Гиалрипайер прошла доклинические и первые клинические исследования.
Репаранты – новый класс препаратов на основе ГК биосинтетического происхождения, модифицированной низкомолекулярными соединениями. При их создании был использован метод твердофазного реакционного смешения. Твердотельный метод сшивания и модифицирования (стабилизации) солей ГК разработан в 2007 г. российскими учеными [10, 11]. Данная технология позволяет получать стабильные препараты на основе механополимеров.
При твердофазной стабилизации (механосинтезе) ГК не применяются химические агенты с полимеризующими свойствами, что обеспечивает хорошую переносимость и высокую безопасность препаратов. Модифицированная ГК с «нашитыми» низкомолекулярными соединениями не распознается тканевыми гиалуронидазами, в результате чего повышается ее эффективность благодаря замедлению энзимной биодеградации в тканях.
Хондрорепарант Гиалрипайер способствует формированию локального депо активных элементов с адресной доставкой и пролонгированным действием (до трех недель) и, как следствие, запуску каскадных механизмов репарации соединительной ткани.
Хондрорепарант Гиалрипайер-02 содержит модифицированную ГК высокой степени очистки, аскорбилфосфат магния, L-пролин, L-лизин и глицин. L-пролин – протеиногенная аминокислота. Он участвует в синтезе коллагена и обладает антиоксидантными свойствами. L-лизина гидрохлорид также обладает протеиногенными свойствами и стимулирует формирование коллагена и эластина. Глицин участвует в синтезе коллагена и улучшает процессы регенерации (рис. 1). В состав Хондрорепарант Гиалрипайер-10 помимо модифицированной ГК входят цинк, аскорбилфосфат натрия, L-цистеин, L-глутатион, то есть триада активных антиоксидантов с внеклеточной и внутриклеточной синергической активностью.
Исследование эффективности и переносимости новых гелевых препаратов линейки Хондрорепарант Гиалрипайер проводилось как на лабораторных животных, так и у больных ОА.
Анализ результатов доклинических исследований
Целями доклинического исследования in vivo на крысах-самцах линии Вистар стали изучение и оценка репаративных свойств препаратов в условиях, наиболее приближенных к условиям их практического применения, для возможности экстраполяции результатов на организм человека (свидетельство об аккредитации Росздравнадзора от 18.02.2011). В данном исследовании проводилось моделирование патологии коленного сустава, а именно воспаления и травмы, с последующим лечением препаратами Гиалрипайер-02 и Гиалрипайер-10 (внутрисуставное введение) и анализом их влияния на репаративные процессы в хряще.
Две различные экспериментальные патологии коленного сустава на разных группах животных получали путем моделирования травмы (использовали ланцет LifeScan для взятия крови) и воспалительного процесса (в полость сустава однократно вводили 0,02 мл стерильного 1,5%-ного раствора лиофилизированного липополисахарида Escherichia coli на физрастворе). Схема лечения моделей двух типов патологии включала двукратное введение в полость сустава с трехдневным интервалом Гиалрипайер-02 или Гиалрипайер-10. Животным контрольной группы вводили нативную ГК. Часть животных выводили из эксперимента на сроке формирования патологических изменений в суставах для гистологического подтверждения факта моделирования. Вторая серия выведения проводилась на седьмые сутки после курса инъекций с последующим морфологическим исследованием образцов гиалинового хряща [12].
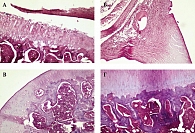
Гистологическое исследование модели травмы сустава показало, что повреждение затрагивает поверхностный и промежуточный слои хряща. Отсутствует четкое разграничение слоев гиалинового хряща; наблюдаются признаки деструкции хондроцитов, дистрофических и некробиотических изменений. Дистрофические изменения превалируют над воспалительными. Воспаление имеет преимущественно продуктивный характер (рис. 2А). При исследовании модели воспаления сустава воспалительные и поствоспалительные изменения превалируют над дистрофическими и некробиотическими. Четко определяются зона деструкции (изъязвления хряща), резкое полнокровие сосудов и застойные явления в лимфатических сосудах. В местах погибших хондроцитов – набухшие пучки коллагеновых волокон, местами пучки настолько отечны, что превращаются в эозинофильную массу, напоминающую очаги фибриноида (рис. 2Б).
Авторы установили, что Гиалрипайер-02 и Гиалрипайер-10 обладают выраженным репаративным эффектом: ускоряют восстановление хрящевой ткани из полнослойных дефектов при обоих типах патологического процесса. В то же время в контрольной группе выраженные изменения тканей сохраняются. Так, после проведенного лечения модели травмы препаратом Гиалрипайер-10 гистологическое исследование показало полное восстановление поверхности хряща, полярности и рядности хондроцитов. Визуализируются четкие, среднего размера ядра клеток, суженные сосуды микроциркуляторного русла, рыхлая соединительная ткань с мелкими сосудами, сосудистый спазм, отсутствие фиброза (рис. 2В). Морфологически результат лечения модели артрита выражается в практически полном восстановлении целостности хряща, очаговой пролиферации хондроцитов, формировании и восстановлении полярности и рядности хряща. Выявляются также компактное межклеточное вещество с большей базофильностью, сосудистый спазм, целые костные балки без дистрофических изменений (рис. 2Г).
Более значимый эффект репарации при использовании Гиалрипайер-10 может быть объяснен его антиоксидантным действием. Этот факт подтверждают данные, что окислительный стресс участвует в деструкции хрящевой ткани и снижении ее репаративного потенциала. В то же время при предварительной оценке влияния исследуемых препаратов на интактный сустав без моделирования морфологически было показано, что препарат не вызывает патологических процессов в здоровых тканях. После его введения структурная организация сустава остается сохранной, дисплазия соединительной ткани и нарушение трофики гиалинового хряща не наблюдаются [12, 13].
В другой серии исследований оценивалось влияние нативной ГК и ее модифицированных формул на биологическую ткань и клеточные линии.
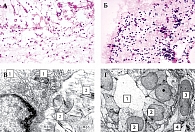
При субдермальном введении животным наблюдалось равномерное распределение всех исследуемых препаратов с пропитыванием подкожной жировой клетчатки и соединительной ткани. Ответ тканей на повреждение и введение препарата сопровождался умеренной нейтрофильной инфильтрацией, в динамике сменяющейся на лимфоцитарно-макрофагальную. Морфологически уже на третьи сутки отмечались пролиферация фибробластов и образование новых капилляров. Указанные процессы оказались наиболее выраженными при введении гелей на основе модифицированной ГК. Так, гистологическое исследование реакции соединительной ткани животных на третьи сутки после субдермального введения геля модифицированной аскорбилфосфатом ГК по сравнению с введением геля нативной ГК показало усиление пролиферации фибробластов и новообразование капилляров (рис. 3А). При проведении электронной микроскопии фрагментов тканей, взятых на третьи сутки после интрадермального введения геля ГК, модифицированной аскорбилфосфатом и глутатионом, визуализировались фибробласты с выраженной гиперплазией эндоплазматического ретикулума, вблизи которых определялись новообразованные коллагеновые фибриллы (рис. 3В), а также новообразованные капилляры без патологических изменений (рис. 3Г).
На 14-й день гель с иммобилизированной ГК обнаруживали в виде небольших фрагментов в жировой ткани или гиперплазированных лимфоузлах и макрофагах, что свидетельствовало об активном фагоцитозе. Резорбцию нативной ГК наблюдали начиная с третьего дня, а модифицированной формулы – не ранее 14–21-го дня. Так, гистологическое исследование показало, что на 14-е сутки после субдермального введения препарата Гиалрипайер-02 гель имел тонкофибриллярную, мелкозернистую и мелковакуольную структуру с включением лимфоцитов, макрофагов и гигантских многоядерных клеток (рис. 3Б).
Таким образом, результаты исследования подтвердили способность препаратов модифицированной ГК активизировать пролиферацию фибробластов, синтез коллагена и неоангиогенез, а также противостоять быстрой биодеградации, длительность которой у данных препаратов в несколько раз выше, чем у нативной ГК [14].
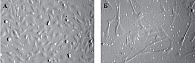
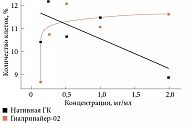
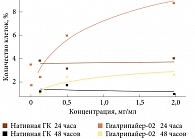
Проведено цитологическое исследование на культурах фибробластов и эндотелиоцитов влияния материала Гиалрипайер-02 на метаболическую активность и распределение по фазам клеточного цикла. В данном сравнительном исследовании показано влияние нативной ГК и препарата Гиалрипайер-02 на различные культуры клеток (рис. 4А, Б).
Инкубирование монослоя эндотелиоцитарных и фибробластоидных клеток с препаратом Гиалрипайер-02 не вызывало цитодеструкции, при этом их митотическая активность несколько повышалась. Анализ метаболической активности клеток эндотелиоцитарной линии EA.hy926 свидетельствовал, что оба препарата вызывают прежде всего увеличение метаболической активности клеток, а не их пролиферацию. Оценка влияния препаратов на клеточный цикл эндотелиоцитов, проводимая на основе данных проточной цитофлуориметрии, свидетельствовала об отсутствии значимых изменений (рис. 5).
Напротив, Гиалрипайер-02 стимулировал метаболизм фибробластной линии FRSN – указанный эффект зарегистрирован при сравнительно низких концентрациях. При этом отмечена тенденция к накоплению фибробластов в фазе S при инкубации с обоими препаратами, что было более выражено при инкубировании с Гиалрипайер-02. Этот результат косвенно подтверждает репаративную активность компонентов в составе исследуемого препарата (рис. 6).
Кроме того, Гиалрипайер-02 продемонстрировал сравнительно низкую цитотоксичность в отношении эндотелиоцитов и фибробластов. Стимуляция пролиферации выявлена только в отношении фибробластов, о чем свидетельствовало изменение распределения клеток по фазам клеточного цикла со смещением в сторону фазы синтеза преимущественно при воздействии Гиалрипайер-02 [15].
Анализ результатов клинических исследований
В последнее время большое значение в развитии и клинической презентации ОА отводится нарушению биомеханики суставов [16, 17]. С особенностями биомеханических характеристик связывают интенсивность болевого синдрома, ограничение подвижности суставов и темпы прогрессирования ОА. Данные оценочные методики стали широко применяться в силу выявленного факта отсутствия полной корреляции между выраженностью рентгенологических признаков ОА, его клиническими проявлениями и реальными функциональными нарушениями в суставе и околосуставных структурах.
Совместно с кафедрой реабилитации и спортивной медицины Российского национального исследовательского медицинского университета им. Н.И. Пирогова проведена клинико-инструментальная оценка применения препарата для внутрисуставного введения – Хондрорепаранта Гиалрипайер-02 при вторичном ОА коленных суставов у спортсменов высокой квалификации (мастеров спорта, призеров чемпионата мира), занимающихся борьбой [18]. Хроническая травматизация (перегрузка) коленных суставов у данного контингента часто приводит к развитию травматического ОА.
Группа исследования включала 10 борцов со средним стажем занятий спортом ≥ 10 лет и в возрасте ≤ 35 лет. У всех участников выявлен вторичный пателло-феморальный гонартроз II стадии. Интенсивность боли в коленном суставе – не ниже 40 мм по стандартной визуальной аналоговой шкале (ВАШ). Курс лечения предполагал три внутрисуставных введения исследуемого препарата по 2 мл через каждые две недели.
Для оценки результатов помимо стандартного обследования, включающего рентгенологическое исследование и по показаниям магнитно-резонансную томографию, также использовали комбинированный диагностический план:
- субъективная оценка боли с помощью модифицированной ВАШ;
- оценка проприоцептивнойфункции нижних конечностей с помощью компьютерной стабилометрии;
- оценка функции равномерности фазы переката во время шага – подометрия;
- оценка амплитуды тремора и скоростно-угловых характеристик сгибания/разгибания в коленном суставе – биомеханическое исследование.
Данная диагностическая программа позволила исследователям выявить и оценить адаптационные и компенсаторные процессы в опорно-двигательном аппарате.
Определяли выраженность боли, в том числе после спортивной нагрузки. Для этого использовали ВАШ, принятую в отечественных и международных исследованиях при ОА, с добавлением оценки боли непосредственно после спортивной нагрузки. Словесная рейтинговая шкала, разработанная сотрудниками кафедры, включала в себя оценку по пятибалльной шкале выраженности боли в покое, при пальпации, движении, «стартовой» боли, боли после спортивной нагрузки, а также ночной боли в течение недели. Максимальный суммарный балл по данной шкале – 30.
Анализировали динамику показателей биомеханики и проприоцепции. Для оценки нарушений биомеханики применяли компьютерную стабилометрию в американской и европейской стойках на аппаратно-программном комплексе ProKin B (компания TecnoBody, Италия). Для получения более точных результатов и определения коэффициента Ромберга использовали акселерометрический датчик. С его помощью сопоставлялась проекция остистых отростков Th-отдела позвоночника с проекцией общего центра давления (ОЦД). На данном комплексе регистрировали и анализировали такие стабилометрические показатели, как среднее положение ОЦД во фронтальной и сагиттальной плоскостях, скорость ОЦД, площадь статокинезиограммы. Параметр проприоцепции коэффициент Ромберга (QR) рассчитывали исходя из полученных площадей статокинезиограммы с закрытыми и открытыми глазами (SЗГ / SОГ).
Равномерность фазы переката стоп во время шага оценивали при проведении подометрии с использованием барометрической платформы Winpod (компания Medicapteurs, Франция) c шаговой длиной 2 м. При анализе программным обеспечением устройства силы давления стопы на платформу результаты отображались в виде подометрических кривых.
Амплитуду тремора и скоростно-угловые характеристики сгибания и разгибания в коленном суставе определяли с помощью системы беспроводных инерционных датчиков Motion Analysis (компания TecnoBody, Италия).
Два последних метода исследования позволяли с высокой чувствительностью диагностировать изменения опоры и фаз ходьбы на стороне поражения, а также отслеживать динамику состояния пациентов на фоне проводимого лечения.
Динамику клинических и биомеханических показателей анализировали через месяц от начала лечения (перед последней инъекцией), а также через три и шесть месяцев после последнего введения препарата.
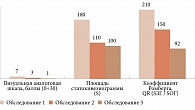
На начало исследования у всех пациентов выявлены существенные нарушения проприоцепции: увеличена площадь опоры, скорость ОЦД, повышен коэффициент Ромберга. 80% спортсменов щадили конечность на стороне поражения коленного сустава при стоянии и ходьбе. Через месяц терапии и три месяца после ее окончания наблюдалось улучшение опорной функции поврежденной конечности и проприоцептивной функции (коэффициент Ромберга исходно составлял 210 единиц, через три месяца – 150). Это сопровождалось существенным уменьшением интенсивности боли и нивелированием клинических проявлений синовита. Через шесть месяцев после окончания лечения отмечены отсутствие боли, статистически значимое улучшение проприоцептивной функции, нормализация биомеханических показателей (рис. 7–9).
Значительная положительная динамика проявлений гонартроза как после двух введений препарата, так и через шесть месяцев наблюдения подтвердила наличие базисного действия Хондрорепаранта Гиалрипайер-02. Следовательно, исследуемый гелевый материал можно отнести к медленно действующим хондроактивным препаратам. Кроме того, исследование продемонстрировало длительность эффектов терапии. Безопасность Гиалрипайер-02 оказалась аналогичной безопасности препаратов на основе солей ГК для внутрисуставного введения [18].
В Центральной клинической больнице Российской академии наук проведено клиническое исследование эффективности и переносимости внутрисуставного введения препаратов Хондрорепарант Гиалрипайер-02 и Гиалрипайер-10 у пациентов с ОА коленных и тазобедренных суставов.
Исходно у всех участников отмечались интенсивная боль в суставах (более 40 мм по ВАШ) и нарушение функции пораженных суставов. Последнее определяли с помощью индекса WOMAС (Western Ontario and McMaster Universities Оsteoarthritis Index).
Терапевтическая значимость препаратов устанавливалась исходя из оценки общего состояния здоровья больными и врачами. Достоверное уменьшение боли в целевом суставе зафиксировано на третий – пятый день после введения препарата. При этом у большинства пациентов она купировалась полностью. Кроме того, наблюдалось существенное увеличение амплитуды движений (неопубликованные данные). Более 80% пациентов отметили улучшение или значительное улучшение состояния на фоне проводимой терапии, что соответствовало оценке врачей.
Таким образом, результаты клинических исследований позволяют охарактеризовать терапевтическую активность линейки препаратов Хондрорепарант Гиалрипайер следующим образом:
- уменьшают интенсивность боли в целевом суставе на период от шести до 12 месяцев;
- обладают анальгетическим эффектом за счет улучшения вязкоэластичных свойств синовиальной жидкости и защиты болевых рецепторов в тканях сустава;
- оказывают противовоспалительное действие и способствуют разрешению симптомов воспаления в синовиальной оболочке и периартикулярных мягких тканях, не воздействуя на циклооксигеназы (ЦОГ);
- активизируют образование коллагена и эластина за счет действия протеиногенных аминокислот;
- оказывают репаративный эффект на гиалиновый хрящ и другие структуры сустава за счет стимуляции синтетической активности клеток.
Кроме того, на фоне их применения сокращается потребность в нестероидных противовоспалительных препаратах (НПВП). Повторные курсы введения снижают риск эндопротезирования.
Хондрорепарант Гиалрипайер-02 и Гиалрипайер-10 обладают хорошей переносимостью и высокой безопасностью. Так, нежелательные явления встречались примерно у 5% больных, носили преходящий характер и не требовали отмены препарата или какой-либо медикаментозной интервенции.
Известно, что метаболиты ГК в условиях ярко выраженного воспалительного процесса обладают провоспалительной активностью и способны инициировать обострение. Следовательно, перед началом терапии пациентов с ОА препаратами Хондрорепарант Гиалрипайер-02 и Гиалрипайер-10 необходимо оценить возможное наличие и остроту воспалительного процесса в тканях и в случае необходимости предварительно назначить противовоспалительную терапию.
Показаниями к внутрисуставному применению препаратов Хондрорепарант Гиалрипайер в шприцах являются первичный и вторичный ОА коленных суставов без проявлений вторичного (реактивного) артрита, а также ОА другой локализации, посттравматические поражения суставов (менископатия, травмы внутрисуставных связок, оперативное вмешательство на суставах). Курс лечения предполагает от трех до пяти внутрисуставных введений. Частота введений – один раз в две недели. Повторные курсы проводят в зависимости от клинической картины заболевания и эффективности предыдущего курса.
Другая форма выпуска препаратов Хондрорепарант Гиалрипайер-02 и Гиалрипайер-10 – во флаконах 5,0 мл может использоваться также для периартикулярного применения при периартритах, тендинитах, энтезопатиях. По рекомендации производителя данные препараты могут применяться внесуставно при дегенеративных заболеваниях позвоночника (межпозвонковом остеохондрозе, спондилезе и спондилоартрозе). Курс локальной инъекционной терапии также предполагает от трех до пяти введений с интервалом в две недели. Повторение курсов – по показаниям.
Место препаратов ГК в рекомендациях ESCEO
В настоящее время предложено большое количество международных и национальных рекомендаций по лечению ОА. Наибольший интерес представляют рекомендации Европейского общества по клиническим и экономическим аспектам остеопороза и остеоартроза (European Society for Clinical and Economic Aspects of Osteoporosis and Osteoarthritis – ESCEO) от 2014 г. [7]. ESCEO впервые предложило подробный алгоритм ведения пациентов, который позволит врачам различных специальностей сориентироваться в многочисленных методах терапии ОА и выбрать рациональную схему лечения в зависимости от стадии заболевания. В рекомендациях ESCEO фигурирует коленный сустав как наиболее частая и наиболее значимая анатомическая локализация ОА.
Помимо общих принципов ведения больных: обучение, снижение массы тела, выполнение аэробных упражнений – разработанный алгоритм предусматривает четыре мультимодальных шага.
Шаг 1. Лечебная физкультура и применение симптом-модифицирующих препаратов медленного действия, таких как глюкозамин сульфат или хондроитин сульфат. Эти два препарата являются единственными симптом-модифицирующими препаратами медленного действия, которые исследовательская группа рекомендует на основании веских клинических доказательств. Наружные НПВП могут применяться для дополнительного обезболивания.
Шаг 2. Назначение пероральных селективных или неселективных НПВП пациентам с выраженными клиническими проявлениями, включая боль и симптомы персистирующего воспаления в тканях сустава. Пероральные НПВП должны использоваться короткими курсами из-за возможности развития серьезных нежелательных явлений, при этом назначение неселективных или ЦОГ-2-селективных НПВП определяется наличием сопутствующего желудочно-кишечного, сердечно-сосудистого или почечного риска. При наличии отчетливой симптоматики вторичного синовита или периартрита рекомендуется внутрисуставное введение пролонгированных глюкокортикостероидов. Эти препараты способствуют прогрессирующей дегенерации суставного хряща, поэтому их можно вводить не более трех раз в год в один сустав. На данном этапе также рекомендуется применение ГК, особенно у пациентов с рефрактерностью к НПВП и симптом-модифицирующим препаратам медленного действия, а также кристаллическим кортикостероидам. ГК и стероидные противовоспалительные препараты вводятся внутрь сустава и только по обоснованным показаниям. Терапия данными препаратами клинически различна: быстрота развития терапевтического эффекта более выражена у внутрисуставных кортикостероидов, но он менее продолжителен по сравнению с ГК. В последнем случае эффект сохраняется от шести до 12 месяцев после трех – пятинедельного курса терапии.
В перечень инструментов терапии шагов 3 и 4 входят центральные и/или опиоидные анальгетики, назначение которых обосновано необходимостью управления стойким болевым синдромом на претерминальных и терминальных стадиях заболевания.
В каждом конкретном случае выбор рациональной терапии ОА основывается на сравнении эффективности и безопасности вмешательств, анализе предикторов ответа на проводимую терапию, темпах рентгенологического прогрессирования, наличии коморбидности, анализе прогностических параметров, психологических факторов, механизмов боли, уровня социализации пациента, определении баланса между риском и пользой и доступности препаратов. При определении инъекционной тактики лечения гонартроза учитывают наличие локальных (избыточный вес, неблагоприятные механические факторы, высокая физическая активность) и общих (возраст, сопутствующие заболевания, полимедикация) факторов риска, выраженность альго-функциональных проявлений в суставе, наличие признаков воспаления, а также локализацию и степень структурных повреждений. Консервативное лечение гонартроза направлено на уменьшение боли и воспаления, а также на замедление деградации хряща.
Заключение
Твердофазная модификация ГК является способом ее стабилизации, то есть без применения жидкофазной химической полимеризации. При этом формируются нековалентные связи гиалуроната с аминокислотами и аскорбилфосфатом.
Полученные с использованием данной технологии препараты в шприцах для внутрисуставного введения – Хондрорепарант Гиалрипайер-02 и Гиалрипайер-10 – применяются для временного восполнения вязкоэластичных свойств синовиальной жидкости. Модификация пространственной структуры компонентов обусловливает затруднение «узнавания» гиалуронидазами модифицированной ГК. Благодаря этому увеличивается время действия препарата. Хондрорепарант Гиалрипайер-02 и Гиалрипайер-10 способствуют быстрой активации антиоксидантных и репаративных процессов.
Показанием к применению препаратов являются первичный и вторичный ОА. Препараты Хондрорепарант Гиалрипайер могут быть использованы как в режиме монотерапии, так и в сочетании с симптоматическими препаратами быстрого и медленного действия, включая НПВП, глюкозамин сульфат и хондроитин сульфат.
Для более полной оценки симптоматического и базисного действия данных препаратов, а также их переносимости, в том числе в комбинации с другими методами лечения, следует продолжить их изучение на модели первичного ОА с участием достаточного количества пациентов с различными фенотипами заболевания.
V.V. Badokin, N.P. Mikhaylova
Russian Medical Academy of Postgraduate Education
Autonomous Non-Profit Organization ‘International Scientific Research Center of Innovation Technologies Martinex’
Contact person: Vladimir Vasilyevich Badokin, vbadokin@yandex.ru
Chondroreparants represent the new class of preparations based on hyaluronic acid salts modified with the low-molecular weight biologically active components. The article considers manufacturing technology of Chondroreparant® Hyalrepair® as well as presents the data from studies on their efficacy and safety during osteoarthritis of various etiology.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.