Новые возможности терапии остеоартроза препаратами гиалуроновой кислоты (результаты открытого проспективного многоцентрового исследования внутрисуставного применения трех курсов Хондрорепарант® Гиалрипайер®)
- Аннотация
- Статья
- Ссылки
- English






Введение
Остеоартроз (ОА) является заболеванием, при котором имеет место нарушение нормального баланса между деградацией и восстановлением суставного хряща и субхондральной кости, что сопровождается воспалением (различной степени) синовиальной мембраны, фиброзом капсулы и формированием краевых остеофитов [1–3]. ОА рассматривается как основная нозологическая форма дегенеративных заболеваний опорно-двигательного аппарата, хотя в его патогенезе и клинической презентации существенную роль играет воспалительный процесс, во многом определяющий темпы прогрессирования и исходы заболевания [4–6].
К наиболее значимым патологическим проявлениям ОА относятся уменьшение объема и разволокнение гиалинового хряща – основного плацдарма развития заболевания. Имеют значение также субхондральный венозный стаз и внутримедуллярная гипертензия, трабекулярные микропереломы, субхондральный склероз, образование остеофитов, кисты в периартикулярной кости и, конечно, функциональная нестабильность сустава. ОА характеризуется постепенным разрушением суставного хряща вследствие дисбаланса между синтезом и деградацией хрящевого матрикса. Изменения состава хрящевого матрикса приводят к потере вязкости и упругости, необходимых для выполнения основной (механической) функции сустава.
Лечение пациента с ОА – задача сложная, требующая дифференцированного комплексного подхода. Терапия ОА включает в себя комплекс мероприятий, в частности программу физической реабилитации (ограничение нагрузки, стабилизация пораженного сустава, коррекция ортопедических нарушений, лечебная гимнастика), а также применение препаратов, направленных на уменьшение боли и замедление структурных повреждений в тканях сустава. Большое значение имеет воздействие на метаболизм хрящевой ткани с целью восстановления дисбаланса между синтезом и деградацией суставного матрикса. Для этого используются медленно действующие симптом-модифицирующие или хондропротективные препараты.
Препараты гиалуроновой кислоты в терапии остеоартроза
Гиалуроновая кислота (ГК) образует ось гигантской молекулы протеогликана, которая вместе с коллагеном является основным биополимером соединительной ткани в целом и суставного хряща в частности. Именно ГК отвечает за уникальные вязкоэластические свойства нормальной синовиальной жидкости (СЖ), которая в отсутствие ГК представляет собой простой диализат плазмы. ГК действует как любрикант и поглотитель механических сотрясений. Это чрезвычайно важно, поскольку механический стресс способствует не только продукции металлопротеиназ (MMP), но и экспрессии провоспалительных цитокинов. ГК служит облигатным компонентом для хондроцитов в процессе синтеза протеогликанов гиалинового хряща. Она способна индуцировать агрегацию и синтез гликопротеинов, модулировать воспалительный процесс, уменьшать хемотаксис и миграцию лейкоцитов, нейтрофилов и лимфоцитов, а также нейтрализовывать свободные радикалы кислорода. В здоровом суставе существуют тесные функциональные и метаболические взаимосвязи между СЖ и суставным хрящом, между хондроцитами и хрящевым матриксом и между протеогликанами и коллагеном гиалинового матрикса. В этом взаимодействии особую роль играет ГК.
При ОА уменьшается как концентрация, так и молекулярный вес ГК в СЖ, формируются дефектные цепи в ее структуре. Как следствие, снижается вязкость и эластичность СЖ, ослабляются межмолекулярные взаимодействия и повышается чувствительность гиалинового хряща к повреждению, что наряду с ингибицией протеогликанов приводит к разрушению коллагеновой сети и деградации матрикса. На фоне усиления механического стресса тканей сустава ухудшается функция клеток хряща и синовиальной мембраны, что сопровождается депрессией дальнейшей выработки гликозаминогликанов, протеогликанов и гликопротеидов и негативно влияет на структуру хряща и качественный состав СЖ.
Перспективным методом патогенетического лечения ОА считаются внутрисуставные инъекции различных препаратов, в том числе ГК.
В 1974 г. E.A. Balazs обосновал терапевтическое значение гиалуроната для функции сустава, а позже предложил концепцию вискосапплементации – поддержания вязкоупругих свойств СЖ как метод лечения ОА [7]. Впоследствии проводились многочисленные научные работы по применению солей ГК, но только в 1998 г. было получено первое разрешение FDA на применение гиалуроната в инъекционном лечении пациентов с ОА. ГК широко используется в клинической практике, а ее терапевтическая активность доказана в десятках рандомизированных контролируемых исследований. Она входит в перечень препаратов, рекомендуемых ACR, EULAR, OARSI с уровнем доказательности 1В [8–11].
Нативный гиалуронан помимо анальгетического и противовоспалительного действия способен ингибировать макрофагальный фагоцитоз и адгезию нейтрофилов, в том числе снижая высвобождение арахидоновой кислоты из синовиоцитов, а также связывая субстанцию Р. При этом экзогенная ГК может уменьшать степень апоптоза, устранять проявления синовита, усиливать продукцию нативного гиалуронана, способствовать энзимной перестройке синовиальной среды. Внутрисуставное введение экзогенной ГК отчасти компенсирует тканевые, клеточные и биохимические нарушения в суставе и обеспечивает восполнение дефицита гликозаминогликанов, восстановление смазочных свойств СЖ и уменьшение действующей на сустав нагрузки. При достаточно высокой концентрации в суставной полости ГК способна уменьшать проявления вторичного синовита за счет адсорбции на своих крупных молекулах ряда медиаторов воспаления.
Противовоспалительный потенциал ГК реализуется преимущественно:
- через снижение уровня простагландинов, прежде всего PGE2;
- ослабление экспрессии провоспалительных цитокинов (интерлейкина (ИЛ) 1-бета, фактора некроза опухоли (ФНО) альфа);
- подавление синтеза эндопротеаз группы MMP с одновременным стимулированием синтеза их тканевых ингибиторов;
- снижение образования оксида азота;
- подавление экспрессии цитокина RANTES [12–15].
Оксидативный стресс в патогенезе ОА. Новые терапевтические подходы
Последнее десятилетие внимание исследователей приковано к проблеме оксидативного стресса (ОС) тканей сустава при ОА. По данным авторов, реактивные формы кислорода (ROS) повреждают целостность клеточной мембраны, разрушают как ГК синовиальной жидкости, так и экстрацеллюлярный матрикс гиалинового хряща, а также нарушают основные процессы анаболизма хрящевой ткани и выработку эндогенного гиалуронана. Провоспалительные цитокины и ROS участвуют в инициировании и прогрессировании не только воспалительного процесса, но и самого патогенеза ОА.
Результаты новых исследований, подтверждающие корреляцию между ROS и воспалением, показали, что ОС может влиять на уровень провоспалительных цитокинов [16–19]. В патогенезе повреждения тканей ОС рассматривается как одно из звеньев воспалительного процесса, поскольку является его полноценным участником наряду с циклооксигеназным и липооксигеназным путями реализации. Оксидативное повреждение затрагивает как внеклеточные, так и внутриклеточные структуры. При этом супероксидный анион и его производные выступают как медиаторы воспаления при ОА [20].
Y. Henrotin и соавт. при систематическом анализе Medline оценивали влияние кислорода и ROS на «старение» хондроцитов и их метаболическую функцию, выделяя хондрогенный фенотип. Как известно, суставной хрящ представляет собой аваскулярную ткань. Несмотря на то что базальные метаболические функции клеток адаптированы к гипоксии, хондроциты, по-видимому, чувствительны к кислороду. In vitro гипоксия способствует экспрессии «хондрогенного» фенотипа и образованию специфического хрящевого матрикса. Это говорит о том, что давление кислорода может быть ключевым параметром в повреждении хондроцитов in vitro. Кроме того, ROS играют решающую роль в регуляции ряда основных функций хондроцитов – активации клеток, пролиферации и ремоделировании матрикса. Однако, когда продукция ROS превышает антиоксидантные возможности клетки, происходит окислительный стресс, что приводит к структурным и функциональным повреждениям хряща, таким как гибель клеток и деградация матрикса. Таким образом, от количества ROS зависят степень «старения» хондроцитов, их метаболическая функция и хондрогенный фенотип. Это играет решающую роль в контроле гомеостаза и деградации хряща [21].
A. Ostalowska и соавт. изучали изменения вязкости СЖ, а также активность антиоксидантных ферментов и ферментов трансформации глутатиона и определяли степень перекисного окисления липидов в СЖ у здоровых добровольцев и пациентов с первичным и вторичным гонартрозом. Пациенты с гонартрозом обеих групп (особенно в группе вторичного ОА) имели значительно более высокую активность всех ферментов и меньшую вязкость СЖ по сравнению с пациентами контрольной группы. Максимальная активность всех антиоксидантных ферментов сопровождалась низкой вязкостью СЖ. По сравнению с контрольными образцами синовии в опытных образцах у пациентов с ОА выявлены достоверное снижение уровня вязкости СЖ и повышенный уровень перекисного окисления липидов, что свидетельствовало о ее оксидативных изменениях вследствие воздействия ROS [22].
Таким образом, согласно новым данным, ГК в терапии ОА рассматривается не только как необходимый вискосапплементирующий агент, но в том числе и как биохимическая субстанция, способная противодействовать ОС синовиальной среды и гиалинового хряща. Экзогенная ГК нейтрализует ROS, а также обеспечивает возобновление синтеза протеогликанов в хрящевой ткани, что показывает ее множественные эффекты – анаболический и антиоксидантный [17, 23, 24]. Однако, чем большая нейтрализующая роль приходится на ГК, тем меньшее амортизационное действие она оказывает. Наряду с оксидативным разрушением нативного гиалуронана это приводит к недостаточному восполнению вязкости СЖ, в том числе при условии проведения локальной инъекционной терапии [25]. В этой связи активно применяются комбинированные препараты на основе ГК и многоатомных спиртов с антиоксидантной активностью, исследуются и разрабатываются новые формулы с компонентами, относящимися к иным химическим группам, также обладающими прямым антиокислительным потенциалом [26–33].
M.D. Carlo и соавт. на культуральном монослое хондроцитов, выделенных из суставного хряща молодых и пожилых доноров, показали, что индуцированный повышенный ОС снижает выживаемость хондроцитов у более пожилых испытуемых. Это находится в прямой корреляции с внутриклеточным уровнем глутатиона. Снижение уровня глутатиона значительно отличается между возрастными когортами: в хондроцитах пожилых доноров отмечается повышенный уровень окисленного глутатиона, не имеющего антиоксидантной активности. Такие изменения могут способствовать цитотоксическим условиям ОС в этих клетках, а сдвиг внутриклеточного тиолооксидного статуса хондроцитов может быть основным фактором, способствующим повышенной гибели клеток при увеличении продукции ROS, что наблюдается при ОА. Следовательно, при старении индуцированный ОС делает хондроциты более восприимчивыми к опосредованной гибели через нарушение регуляции антиоксидантной системы глутатиона, что может стать важным фактором развития ОА у пожилых людей. Авторы пришли к выводу, что препараты с антиоксидантной активностью, основанной как на восстановлении эндогенной продукции ROS, так и на увеличении общей антиоксидантной способности клеток, могут оказаться важными в профилактике прогрессирования ОА [26].
На человеческих фибробластоподобных синовиоцитах изучали антиоксидантную активность и влияние на экспрессию провоспалительных цитокинов комбинации ГК и восстановленного глутатиона. Исследователи исходили из доказанного факта, что восстановленный глутатион оказывает противовоспалительное действие, реализуемое через защиту клеток от реактивных форм кислорода и азота (ROS/RNS). Контрольная культура синовиоцитов инкубировалась с добавлением ГК, опытные – вместе с ГК и восстановленным глутатионом. При добавлении медиатора воспаления ИЛ-1-бета отмечалось значительное снижение общей антиоксидантной способности клеток контрольной культуры, в опытных – сохранная антиоксидантная активность и сниженное количество ROS/RNS во внутриклеточной среде. Установлена значимая разница в уменьшении уровня ИЛ-1-бета в культурах, обработанных ГК с глутатионом в различных концентрациях, по сравнению с показателями контрольной группы в пользу опытных культур. ГК в комбинации с восстановленным глутатионом улучшает антиоксидантную способность и модулирует провоспалительные цитокины в синовиоцитах. Сказанное позволяет утверждать, что подобная комбинация может усиливать эффект вискосапплементации у пациентов с ОА [33].
Две независимые группы авторов показали протективное действие l-аскорбиновой кислоты (АК) на культуры хондроцитов человека в условиях повышения уровня окислительной активности. Z. Chang и соавт. выявили, что АК уменьшала апоптоз и потерю жизнеспособности клеток, обработанных H2O2. При этом АК стимулировала степень экспрессии коллагена и протеогликанов, подавляла дифференцировку хондроцитов в условиях ОС и уменьшала активность MMP-3. Таким образом, АК при контакте с культурой за счет множественных регуляторных путей эффективно защищала клетки от повреждения, вызванного H2O2 [34]. На тех же клеточных культурах изучали синергические эффекты комбинации ГК + АК на экспрессию провоспалительных цитокинов и MMP. Показано, что АК оказывает противовоспалительное действие и улучшает выработку матрикса хондроцитами. T.L. Huang и соавт. определяли влияние ГК в сочетании с АК на интактные хондроциты и стимулированные ИЛ-1-бета. ГК и ГК + AК частично восстанавливали жизнеспособность и морфологию измененных хондроцитов и выраженно снижали цитотоксичность ИЛ-1-бета. ГК у индуцированных ИЛ-1-бета хондроцитов значительно снижала экспрессию ИЛ-1-бета, ФНО-альфа, MMP-3 и MMP-9, а комбинация ГК + АК дополнительно значительно уменьшала экспрессию MMP-3 и MMP-9. Выработка MMP-3 более значимо была снижена при сочетании ГК + АК, чем только в присутствии ГК. В стимулированных хондроцитах также частично восстанавливалась активность антиоксидантов и супероксиддисмутаз. Исследователи сделали вывод, что комбинация ГК + АК модулирует экспрессию MMP и антиоксидантную активность в хондроцитах. При этом АК может усиливать антикатаболический эффект ГК у хондроцитов при ОА [27].
Хондрорепарант® Гиалрипайер®: принцип действия формул
Сотрудники АНО МНИЦИТ «МАРТИНЕКС» и ИСПМ им. Н.С. Ениколопова РАН разработали две уникальные формулы с запатентованным составом Хондрорепарант® Гиалрипайер®, которые прошли доклинические и первые клинические исследования и активно внедряются в практику. Хондрорепарант® Гиалрипайер® выпускается в двух видах состава и двух формах выпуска: шприцевой для внутрисуставного введения и флаконной для внесуставных инъекций.
Хондрорепаранты – новый класс препаратов на основе ГК, модифицированной низкомолекулярными соединениями методом твердофазной стабилизации. При физической стабилизации (механосинтезе) ГК не применяются химические «сшиватели», что обеспечивает хорошую переносимость и высокую безопасность препаратов.
Модифицированная ГК в формулах Гиалрипайер® имеет ряд структурных особенностей и не распознается тканевыми гиалуронидазами, вследствие чего замедляется ее биодеградация в тканях. Среднемолекулярная ГК массой 2,6 МДа высокой степени очистки стабилизируется при одновременном воздействии сверхвысокого давления и сдвиговой деформации (скручивания) и сшивается в механополимер с помощью «мостиков» из аскорбилфосфата (химически стабильной формы аскорбиновой кислоты). Дальнейшее изменение пространственной структуры ГК обеспечивается нашиванием биоактивных компонентов – аминокислот и олигопептидов. Таким образом, макрокомплекс представляет собой локальное депо активных элементов с пролонгированным действием. Вследствие неферментного гидролиза в течение трех недель происходит постепенное высвобождение активных компонентов и запускаются каскадные механизмы репарации соединительной ткани. Период биодеградации Гиалрипайер® в несколько раз превышает подобный показатель нативной ГК. Поскольку механополимер стабилизирован без ковалентных химических связей, макрокомплекс не является новым химическим соединением, его эффекты реализуются через действие отдельно взятых компонентов состава.
ГК в обеих формулах препаратов Хондрорепарант® Гиалрипайер® играет типичную роль любриканта и регулирует состояние синовиальной среды и гиалинового хряща. Аскорбилфосфат также содержится в обеих формулах и выполняет несколько функций: сшивающий агент между цепями ГК, ингибитор гиалуронидаз и антиоксидант. Остальные компоненты двух формул препаратов принципиально различны, что объясняет разницу клинических эффектов при их применении.
Хондрорепарант® Гиалрипайер®-02 (ХР-02) помимо ГК и аскорбилфосфата содержит пролин, лизин и глицин. Пролин – протеиногенная аминокислота, участвующая в синтезе коллагена и обладающая антиоксидантными свойствами. Аминокислота лизин также обладает протеиногенными свойствами, за счет которых стимулирует синтез и формирование коллагена и эластина. Аминокислота глицин участвует в синтезе коллагена и улучшает процессы регенерации. В совокупности ХР-02 оказывает репаративное действие и способствует восстановлению матрикса соединительной ткани.
В состав формулы Хондрорепарант® Гиалрипайер®-10 (ХР-10) входят ГК, аскорбилфосфат, цинк, цистеин и глутатион. Цинк включается в процессы репарации, участвуя в усилении фагоцитоза и активации неоангиогенеза, а также влияет на обмен нейротрансмиттеров, повышая болевой порог. Цистеин является аминокислотой с протеиногенным эффектом, которая не только стимулирует синтез коллагена, но и обладает выраженным внеклеточным антиоксидантным потенциалом. Олигопептид глутатион также является антиоксидантом и определяет окислительно-восстановительные характеристики внутриклеточной среды. Синергичное действие триады активных антиоксидантов обусловливает косвенное противовоспалительное и анальгетическое действие формулы ХР-10.
Н.М. Перова и соавт. в 2013 г. в доклиническом исследовании in vivo оценивали репаративные свойства препаратов. Моделям воспаления и травмы коленного сустава вводили внутрисуставно препараты ХР-02 и ХР-10. При гистологическом исследовании гиалинового хряща от животных с травмированным суставом авторы отметили, что ХР-02 и ХР-10 обладают выраженным стимулирующим репаративным эффектом: после проведенного лечения препаратом ХР-10 наблюдалось полное восстановление поверхности хряща, полярности и рядности хондроцитов. Более значимый эффект репарации при использовании ХР-10 может быть обусловлен его антиоксидантным действием. Это подтверждают данные о том, что окислительный стресс участвует в деструкции хрящевой ткани и снижении ее репаративного потенциала. В другом исследовании in vitro (работа Н.П. Михайловой и соавт. (2013)) было показано, что ХР-02 и ХР-10 способны активизировать пролиферацию фибробластов, синтез коллагена и неоангиогенез, а также длительно противостоять процессам биодеградации.
Результаты многоцентрового исследования трех схем применения Хондрорепарант® Гиалрипайер®
Материал и методы
Открытое проспективное многоцентровое исследование внутрисуставного применения трех различных курсов Хондрорепарант® Гиалрипайер® проводилось с апреля 2015 г. по январь 2018 г. в 49 медицинских учреждениях в 6 городах России: Москве, Санкт-Петербурге, Казани, Краснодаре, Екатеринбурге, Перми. В исследовании участвовали 147 пациентов с остеоартритом (из них 31,9% с посттравматическим ОА), получавших лечение в различных медицинских учреждениях: государственных поликлиниках (n = 17), государственных стационарах (n = 54), ведомственных поликлиниках (n = 25), ведомственных стационарах (n = 9), коммерческих поликлиниках (n = 19), кафедральных клиниках (n = 23). В исследовании были задействованы Российская медицинская академия последипломного образования, клиническая больница № 86 и Центр спортивной медицины ФМБА России, НМИЦТО им. Н.Н. Приорова, Клиника травматологии и ортопедии им. И.М. Сеченова, Северо-Западный государственный медицинский университет им. И.И. Мечникова, клиническая больница № 122 им. Л.Г. Соколова, Российский НИИ гематологии и трансфузиологии ФМБА России, Казанский государственный медицинский университет, Республиканская клиническая больница (Татарстан), городские клинические больницы № 1 и 3 г. Краснодара, Центральная городская больница № 2 им. А.А. Миславского г. Екатеринбурга, Пермская краевая клиническая больница и др.
Критерии включения: ОА коленного или тазобедренного сустава, подтвержденный рентгенологически, без проявлений синовита на день старта инъекционной терапии (визит 1). Пациенты с ОА и синовитом перед включением в исследование предварительно получали противовоспалительное лечение. Критерии исключения: внутрисуставное лечение препаратами ГК или артроскопическое вмешательство менее чем за 6 месяцев до начала исследования. Из исследования выводили пациентов с постинъекционным синовитом, но оставляли пациентов с менее выраженными нежелательными явлениями.
Рандомно включали пациентов с идиопатическим ОА коленного или тазобедренного сустава, а также с посттравматическим ОА коленного сустава, получавших в рамках исследования поддерживающее консервативное лечение либо проходивших послеоперационную реабилитацию.
В анамнезе у пациентов с посттравматическим ОА выявляли: частичное повреждение передней крестообразной связки (ПКС), состояние после артроскопической пластики ПКС (> 6 месяцев), состояние после артроскопической субтотальной резекции медиального мениска (> 6 месяцев), посттравматическую артропатию левого коленного сустава с частичным повреждением ПКС, хондромаляцию надколенника 2-й степени, хондромаляцию медиальных мыщелков и частичное повреждение медиальной крестообразной связки, посттравматический деформирующий гонартроз и состояние после разрыва кисты Бейкера.
В исследовании оценивали безопасность и эффективность трех различных курсов внутрисуставного введения Хондрорепарант® Гиалрипайер®: репаративный (три шприца ХР-02), анальгетический (один шприц ХР-10 и два шприца ХР-02), цитопротекторный (три шприца ХР-10). Пациенты были разделены на три группы в соответствии с назначенным курсом лечения. Схема инъекций – три введения с интервалом 14 дней, за один визит инъекция одного шприца 2,0 мл, лечение только одного сустава даже при двусторонней форме ОА (табл. 1).
Статистический анализ проводили по таким показателям, как возраст, пол, группа исследования (согласно назначенному курсу лечения), тип пораженного сустава (коленный или тазобедренный), основные параметры диагноза (идиопатический или посттравматический, количество пораженных одноименных суставов, стадия ОА, отсутствие или наличие синовита). Анализировали оценку врачом – боль при пальпации и пассивных движениях в суставе, переносимость манипуляции, а также оценку пациентом – боль в суставе при ходьбе, максимальную дистанцию при ходьбе без боли, возможность ходьбы по лестнице и суммарный индекс Лекена. Финальная оценка курсов лечения врачом проводилась по четырем признакам: переносимость полного курса, безопасность препаратов, анальгетическая и функциональная эффективность курса.
Полученные результаты прошли полный цикл статистической обработки, включая описательные статистики, сравнительные методы и корреляционный анализ. Все значения отнесли к непараметрическим данным, поскольку большинство показателей представляли собой балльную оценку того или иного признака, остальные показатели – обобщенные значения признаков, распределенные по порядковым рангам. Поэтому для статистической оценки применяли только непараметрические критерии. Сравнительный анализ признаков для К-независимых выборок проводили с использованием Н-теста Краскела – Уоллиса. Взаимосвязи изучали с помощью корреляционного анализа с применением коэффициента ранговой корреляции Спирмена (Rs). Сила связи определялась согласно принятым стандартным интервалам, например: (0; 0,250] – слабая корреляционная связь, [0,751; 1,0) – сильная.
Результаты и обсуждение
В исследование были включены 147 пациентов – 66 мужчин и 81 женщина. Преимущественный возрастной интервал среди лиц обоего пола составил 40–69 лет (91% мужчин и 72% женщин) (табл. 2). У 132 пациентов выявлен гонартроз стадий II–IV (у 88 с клиникой одностороннего поражения, у 44 – двустороннего), а у 15 – коксартроз стадий II–III (у 12 односторонний, у троих – двусторонний) (табл. 3). При выявлении двустороннего поражения пациенты получали лечение только с одной стороны, на которую при первичном осмотре предъявляли больше жалоб.
В группе гонартроза 89 пациентов имели проявления ОА без синовита, а 43 пациента обратились с синовитом и предварительно получали противовоспалительное лечение, после чего были включены в исследование. В группе коксартроза подобное соотношение составило 8:7. Далее пациенты были распределены на терапевтические группы в зависимости от назначенных курсов внутрисуставного введения Хондрорепарант® Гиалрипайер® (табл. 4).
При выборе курса исследователи руководствовались клиническими проявлениями – выраженностью болевого синдрома и наличием синовита, а также известными эффектами курсов. Согласно рекомендациям производителя, репаративный курс (первая группа) назначается при ОА без явлений синовита и умеренном болевом синдроме с целью улучшения структуры и функциональности гиалинового хряща и синовиальной мембраны. Анальгетический курс (вторая группа) – после купирования синовита, в ситуациях с более значимым болевым синдромом, при посттравматических состояниях. Курс представляет собой сочетание анальгетического и репаративного воздействия. Цитопротекторный курс (третья группа) показан при максимально выраженном болевом синдроме, после купирования яркого синовита либо при рецидивировании синовита от двух раз в год, при послеоперационной реабилитации с длительным восстановлением, когда требуется активное воздействие на воспалительное или травматическое повреждение тканей. С 1-го по 30-й день пациентам первой группы в течение трех визитов вводили ХР-02, пациентам второй – ХР-10 однократно, далее ХР-02 два раза, пациентам третьей группы – ХР-10 в течение трех визитов. Инъекции выполняли с двухнедельным интервалом.
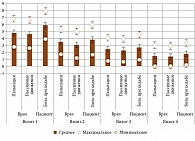
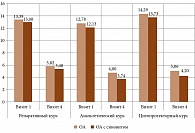
Описательная статистика. Динамика боли при пальпации и пассивных движениях, оцененная врачом, и боли при ходьбе, оцененная пациентом, а также динамика четырех показателей из анкеты Лекена в зависимости от визитов (первый – четвертый) представлены в табл. 5 и на рис. 1 и 2. Для общей альгофункциональной оценки финального состояния в сравнении с исходным подсчитывали суммарный индекс Лекена для первого и четвертого визитов и анализировали результаты в зависимости от курса лечения и клинической картины ОА, дополнительно разделив пациентов на группы без исходного синовита и с синовитом, имевшим место перед включением в исследование. Среднее значение показателя представлено на рис. 3.
В ходе исследования у шести пациентов из 147 первая инъекция препаратов вызвала следующие нежелательные явления. У четырех (2,72%) пациентов отмечались боль и отек после инъекции, которые купировались самопроизвольно без дополнительного лечения в течение от 30–60 минут до двух – четырех суток после введения. В трех случаях из четырех имела место реакция на введение ХР-10 пациентам без синовита, в одном – на введение ХР-02 пациенту с купированным на момент включения в исследование синовитом. Пациенты из исследования не выводились. У одного пациента с ОА и исходно купированным синовитом на вторые сутки после первого введения ХР-10 наблюдалось развитие постинъекционного синовита, сопровождавшегося усилением болевого синдрома и функциональной недостаточностью коленного сустава 3-й степени (0,68%), в связи с чем пациент был выведен из исследования и прошел повторный курс противовоспалительного лечения. В одном случае после введения ХР-02 зафиксировано нежелательное явление, не связанное с основным лечением, в виде обострения сопутствующего заболевания – острый корешковый синдром L5–S1. Назначено местное лечение радикулярного синдрома, пациент остался в исследовании.
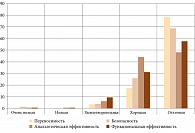
Оценка врачами трех курсов лечения представлена в табл. 6 и на рис. 4. Более 94,5% оценили переносимость и безопасность как хорошую или отличную. Анальгетическая эффективность курсов получила аналогичные оценки в 92,5% случаев, а функциональная эффективность – в 89,1%.
Сравнительный анализ. При попарном сравнении показателей по Визуальной аналоговой шкале (ВАШ) с помощью одностороннего дисперсионного анализа Краскела – Уоллиса (асимптотически, p = 0,01) при сопоставлении репаративного (первая группа) и анальгетического (вторая группа) курсов выявлены различия значений оценки врача на визите 3 и между всеми оценками на визите 4 (KW 0,12÷0,35, n = 115, p = 0,01). Схожие результаты получены при сравнении тех же показателей между первой и третьей группами (KW 0,01÷0,42, n = 74, p = 0,01), а также второй и третьей группами (KW 0,15÷0,39, n = 103, p = 0,01).
При аналогичном сравнении значений по анкете Лекена также были выявлены различия по признакам «максимальная дистанция при ходьбе без боли», «подъем по лестнице», «спуск по лестнице» при сопоставлении первой и второй групп (KW 0,11÷0,23, n = 115, p = 0,05), первой и третьей (KW 0,09÷0,37, n = 74, p = 0,05), второй и третьей (KW 0,04÷0,41, n = 103, p = 0,05).
Корреляционный анализ. Связь между полом пациентов и иными параметрами оценки не установлена. Напротив, возраст влиял на эффективность купирования клинических признаков: выявлена умеренная положительная корреляция с большинством признаков ВАШ и Лекена, что, очевидно, указывает на высокую эффективность внутрисуставного введения ГК у лиц более ранней возрастной категории (Rs 0,375÷0,431, n = 147, p ≤ 0,04). Аналогичная связь зарегистрирована между типом пораженного сустава и клиническими признаками: при гонартрозе положительная динамика была более значимой, чем при коксартрозе, что было явно выражено при финальной оценке (Rs 0,324÷0,478, n = 147, p ≤ 0,01).
Стадия ОА несомненно влияла на купирование альгофункциональных проявлений: средняя положительная статистически значимая связь свидетельствовала о скором разрешении симптомов при более ранних стадиях ОА (Rs 0,562÷0,689, n = 147, p ≤ 0,02). При этом при исследовании взаимосвязи причины ОА (идиопатический или посттравматический) и клинических проявлений в динамике установлена отрицательная умеренная значимая связь, что говорило о более выраженном устранении альгофункциональных нарушений у пациентов с посттравматическим ОА (Rs -0,371÷-0,247, n = 147, p ≤ 0,01).
Выбранный курс выявил умеренную положительную связь с клиническими признаками при оценке на визитах 3 и 4, особенно суммарного индекса Лекена и признаков оценки боли при различных активных нагрузках на сустав, что свидетельствовало о более значимой альгофункциональной эффективности курса, в котором превалировало количество ХР-10. Иными словами, цитопротекторный курс имел преимущество перед репаративным (Rs 0,376÷0,481, n = 147, p ≤ 0,05). Дополнительно оценивали каноническую (множественную) корреляцию с помощью критерия Уилкса. Выявление связи определяли между парами «курс лечения» + «ОА без синовита/с синовитом» и «оценка ВАШ пациентом при ходьбе визит 4» + «суммарный индекс Лекена визит 4». Установлена сильная отрицательная корреляционная связь между выбранным курсом и признаками (Rs -0,804÷-0,762, n = 147, p ≤ 0,03). При этом между клинической формой ОА и признаками связь была слабая положительная
(Rs 0,159÷0,244, n = 147, p ≤ 0,01). То есть цитопротекторный курс эффективнее устраняет выраженность болевых симптомов и альгофункциональные нарушения при ОА с синовитом или при исходно более выраженном болевом синдроме.
Отсутствовала корреляционная связь между переносимостью первой – третьей инъекций и возрастом, типом пораженного сустава, стадией ОА, наличием предшествующего перед включением в исследование синовита, а также выбранными курсами лечения. Это свидетельствовало об однородной переносимости трех исследуемых курсов независимо от характеристик диагноза ОА у различных пациентов (Rs х, n = 147, p ≥ 0,45).
Результаты проведенного открытого многоцентрового исследования говорят в пользу следующего выбора:
- Репаративный курс показан при умеренном болевом синдроме без явлений синовита или после полного его купирования, сопровождающем дегенеративно-дистрофические процессы при ОА, с целью репарации, то есть для восстановления матрикса соединительной ткани и любрикации.
- Анальгетический курс назначается при более выраженном болевом синдроме у пациентов после купирования синовита с целью единовременного последовательного анальгетического и репаративного воздействия, то есть купирования ОС тканей и последующей репарации.
- Цитопротекторный курс показан в случаях, когда присутствует наиболее выраженный, устойчивый к разрешению или рецидивирующий воспалительный компонент, а также при послеоперационной реабилитации с длительным восстановлением. Данный курс обеспечивает наиболее активное устранение ОС тканей и любрикацию сустава.
Как известно, метаболиты ГК в условиях ярко выраженного воспалительного процесса характеризуются провоспалительной активностью и способны инициировать обострение. Поэтому перед началом терапии ХР-02 и ХР-10 необходимо оценить возможное наличие и остроту воспалительного процесса в суставе и при необходимости предварительно назначить противовоспалительную терапию.
Заключение
Препараты Хондрорепарант® Гиалрипайер® обладают хорошей переносимостью и высокой безопасностью. Показаниями к их внутрисуставному применению являются первичный и вторичный ОА коленных и других синовиальных суставов без проявлений клинически выраженного вторичного (реактивного) артрита, а также посттравматические поражения суставов (менископатия, травмы связок, оперативное вмешательство на суставах и др.).
В исследовании нежелательные явления отмечались лишь у 3,4% больных, в большинстве случаев (2,72%) носили преходящий характер и не требовали отмены препарата или какой-либо медикаментозной интервенции. Большинство пациентов (88,7%) оценили результат лечения как хороший или очень хороший.
ГК обладает симптоматическим и болезнь-модифицирующим действием. Говоря о терапевтических эффектах ГК, следует отметить, что при ее применении статистически достоверно уменьшается интенсивность боли в целевом суставе на протяжении 6–12 месяцев по сравнению с плацебо. Представленные в данной статье результаты исследования фиксируют 45-дневный период наблюдения пациентов, однако дальнейшее наблюдение врачами пациентов не показало отличия от общей тенденции и лишь подтвердило эффективность препаратов и выбранных схем лечения: препараты Хондрорепарант® Гиалрипайер® уменьшают интенсивность боли в целевом суставе на период от шести до 12 месяцев.
Таким образом, результаты клинических исследований позволяют охарактеризовать терапевтическую активность линейки препаратов Хондрорепарант® Гиалрипайер® следующим образом.
Все препараты ГК:
- оказывают вискосапплементирующее действие;
- уменьшают интенсивность боли в целевом суставе, защищая болевые рецепторы в тканях сустава;
- нейтрализуют провоспалительные цитокины за счет адсорбции их ГК.
Специфические свойства комбинированного состава Гиалрипайер®:
- оказывает репаративный эффект, стимулирует синтетическую активность клеток, то есть образование матрикса за счет действия протеиногенных аминокислот (ХР-02);
- косвенное противовоспалительное действие (без воздействия на циклооксигеназы) за счет подавления активности провоспалительных цитокинов и ROS (ХР-10 > XP-02);
- снижает потребность в нестероидных противовоспалительных препаратах (ХР-02 и ХР-10);
- замедляет деградацию гиалинового хряща и снижает риск эндопротезирования при повторных курсах введения (ХР-02 и ХР-10).
Дискуссионными остаются вопросы целесообразности применения ГК для кратных повторных инъекций с коротким периодом биодеградации по отношению к химически стабилизированным препаратам однократного применения с длительным сроком присутствия в суставной полости. В защиту препаратов Хондрорепарант® Гиалрипайер® следует отметить, что клинические эффекты экзогенного «не сшитого» химическим путем гиалуронана имеют более продолжительный эффект в сравнении с периодом его нахождения в синовиальной жидкости в недеградированной форме. Это происходит вследствие того, что ГК после введения активно воздействует на гомеостаз всей синовиальной среды, в том числе гиалиновый хрящ, улучшая эндогенную продукцию ГК, присутствующую в суставе уже после того, как экзогенный гиалуронан биодеградировал и вступил во взаимодействие с тканями [35].
Полученные с использованием технологии твердофазной модификации препараты Хондрорепарант® Гиалрипайер® в шприцах для внутрисуставного введения применяются для временного восполнения вязкоэластичных свойств синовиальной жидкости и хондрорепарации. Модификация пространственной структуры макрокомплекса обусловливает затруднение «узнавания» гиалуронидазами модифицированной ГК, благодаря чему увеличивается время действия.
Отличительной особенностью препаратов Хондрорепарант® Гиалрипайер® является их способность к быстрой активации антиоксидантных и репаративных процессов, что обеспечивается комбинированным составом с аскорбилфосфатом, аминокислотами и олигопептидами. Для усиления терапевтического эффекта с целью комбинированного лечения пациентов с остеоартритом синовиальных суставов препараты Хондрорепарант® Гиалрипайер® могут быть использованы не только в режиме монотерапии, но и в сочетании с противовоспалительными препаратами, а также другими симптоматическими препаратами медленного действия.
(the Results of the Open Prospective Multicenter Study of Intraarticular Application of Three Courses of Chondroreparant® Hyalrepair®)
V.V. Badokin, M.A. Strakhov, I.F. Akhtyamov, K.V. Raymuyev, S.N. Ivanov
Russian Medical Academy of Continuing Professional Education
Center for Sports Medicine of FMBA of Russia
Institute of Advanced Training of FMBA of Russia
Kazan State Medical University
I.I. Mechnikov North-Western State Medical University
L.G. Sokolov Memorial Hospital № 122 (St. Petersburg)
Contact person: Vladimir Vasilyevich Badokin, vbadokin@yandex.ru
Chondroreparants represent a new class of medical devices based on hyaluronic acid salts modified by low molecular weight bioactive compounds – ascorbyl phosphate, amino acids and oligopeptides. This article gives the results of an open prospective multicenter study of the efficacy and safety of three different regimens combining two formulae of preparations Chondroreparant® Hyalrepair ® in various etiological forms of osteoarthritis.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.